基层医院药械不良反应事件监管的实践与探索
刘丽 缑小荣
1.陇南市武都区中医医院,甘肃 陇南 746000;2.王尹镇卫生院,甘肃 天水 741000
近年来,随着我国医药技术的提高、药品医疗器械不断发展、更新和引进,在临床诊疗中发挥了重要的作用,但伴随的不良反应事件却不容忽视。为了加强监管,国家陆续出台相关法律法规。2008 年发布了《医疗器械不良事件监测和再评价管理办法(试行)》;2019年1 月1 日正式实施《医疗器械不良事件监测和再评价管理办法》(国家市场监督管理局第1 号令)[1],标志着开展器械不良事件监测有了法律依据;2019 年新修订并颁布《中华人民共和国药品管理法》[2],为不良反应事件监测提供了法律依据,推动我国药械不良反应事件管理规范化。
陇南市武都区中医医院药械不良反应事件上报工作从2012 年正式开始,早期全院70%的医护人员对药品医疗器械不良反应事件的认知度较低,平时发现的药品不良反应大都归结为输液反应或者患者疾病变化/个体差异等其他原因,即使患者发生不适反应,临床医生给予对症治疗后因对原患疾病影响不大就不上报;对于出现严重不适反应的又顾虑是不是用药不当,担心承担责任而不愿上报。医疗器械出现故障,操作者首先担心是不是自己操作不当引起的,害怕承担责任而不敢上报;其次认为器械出现故障是厂家的责任,与自己无关。工作初期,由于对开展此项工作的目的、意义认识不到位,重视程度欠缺,医院不良反应事件年报告病例数只有1~2 例。随着省、市级药监部门对药品医疗器械不良反应事件的宣传引导,本院重视程度逐步加强,相关的管理措施也进一步建立与完善,从初步尝试登陆国家药品不良反应监测平台完善医院信息到熟练掌握系统操作,上报不良反应事件病例的数量、监管质量逐步得到了提升和发展。
1 药械不良反应事件管控实践
1.1 监管制度的建立 制定本院相关的规章制度、奖惩办法(每季度统计各科室上报的不良反应事件病例数,并与绩效挂钩);成立药品医疗器械不良反应事件监测领导小组,主管药械的副院长任组长,药械科为监测管理部门;每个科室指定1 名护理人员为监测联络员,负责收集上报发现的可疑不良反应事件;指定一名医院监测员负责收集、审核不良反应事件填报信息的准确性、完整性,通过国家监测系统开展报表网络直报,确保日常监管工作的顺利进行。
1.2 加强宣传培训
1.2.1 传统方式宣传培训。医院每年举行两次以上宣传活动,在医院公告栏、就诊大厅醒目位置张贴海报、发放宣传册,提高患者和家属对药品、医疗器械不良事件的知晓率;给医务人员重点宣讲药品医疗器械不良事件报告的内容、风险分析评价报告和统计资料是加强药品医疗器械监督管理,指导合理用药用械的依据,不作为医疗纠纷、医疗诉讼和处理医疗质量事故的依据[1]。提高医务人员的法律意识、责任意识,解除医护人员因上报不良反应事件引发医疗纠纷的顾虑。为了增强培训效果,监测员以科室为单位轮流给各科医务人员通过PPT,从药品医疗器械不良反应事件的发展史、相关概念、医院开展药械不良反应事件监测的必要性、报告表质量提升等四个方面详细阐述药品医疗器械不良反应事件监测相关知识;现场指导医护人员查看药品医疗器械标签内容,识别药品器械名称、批准文号、规格/型号、生产/出厂日期,详细讲解如何按时间为基线,准确描述患者诊断、用药(药械)情况、不良反应事件开始时间、不良反应症状体征(仪器故障表现)、干预处理措施及不良反应事件终结时间等相关内容;同时发放《药品不良反应知识100 问》《医疗器械不良事件监测基础知识100 问》《器械不良事件典型实例》,对照学习、识别药品器械不良反应事件,减少漏报。
1.2.2 运用自媒体宣传培训。①建立不良反应管理微信群。护士长是科室不良反应事件上报责任人,鼓励医护人员对发现的不良反应事件在群里交流、探讨,及时拉响预警,尽可能避免不良反应事件重复发生。②分享不良反应事件新动态。监测员不定期通过医院OA 平台和微信群推送不良反应事件信息动态,提高医护人员对新的不良反应事件的识别和判断能力,规避或者减少药品器械使用过程中的风险。
1.3 药品医疗器械不良事件监管流程 为了加强监管,提高上报质量,我院规范了上报流程。见图1。
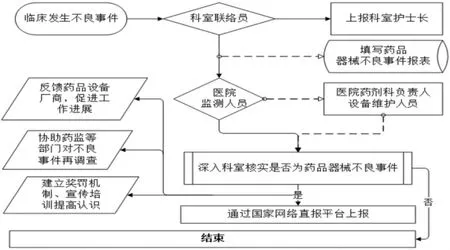
图1 武都区中医医院不良反应事件上报监管流程图
1.4 不良事件信息处置 监测员收到科室报表信息或者群里反应的问题,第一时间同药剂科负责人/设备维修人员深入临床一线调查了解药品/仪器信息,核实事件的性质,对患者造成伤害的,积极救治、妥善处理,经评估有安全隐患的上报主管领导立即停用。普通的仪器故障由本院维修师处理,部分进口精密仪器故障联系专业售后维修,将与售后商谈维修事宜进程及时反馈给科室,以便科室对仪器统筹使用,减少因仪器故障给患者带来的不便。
2 实施措施与取得的成效
2.1 医院重视、数量和质量提升 随着国家、省、市对不良反应事件监管力度的逐步加强,此项工作得到医院管理层的高度重视,在计算机网络信息系统支持、监测人员配备、部门工作协调等方面得到落实,本院药品医疗器械不良反应事件监测体系已初步形成,随着监测工作的逐步推进,大大降低了患者及医务人员使用药品医疗器械的风险,减少了严重不良事件的重复发生,不良反应事件报告病例数量逐渐增加,报表质量逐步提高。见表1。

表1 2017~2021 年我院上报的药品医疗器械不良事件
2.2 调查分析,重点监控,针对性采取措施,效益明显①发生严重不良反应的药品立即停用:如某药厂生产的脑蛋白水解物注射液临床使用中发生严重不良反应1 例,上报医院主管领导,该药立即下架停用;某厂生产的中药制剂发生严重的不良反应2 例,厂家紧急召回全部药品,避免不良事件重复发生。②一次性耗材:当有一个科室上报一次性耗材(棉签、输液器、注射器等)出现漏气(封口不严)、破损、异物、缺少部件的,监测员调查后通知其他科室,注意使用前检查,以免疏忽大意使用被污染的耗材对患者造成伤害。问题物品科室暂存,统一到耗材领取处兑换,由设备材料科与厂家沟通处理退换货;并根据发生不良事件的类型、频次、影响程度替换了部分耗材厂家,无菌物品漏气、异物、破损情况大幅下降,保证了临床使用安全。③某厂生产的特定电磁波治疗仪:发现该仪器底座固定螺丝滑丝,灯头固定杆、支撑杆有断裂情况,存在严重的安全隐患,厂家看到平台推送的不良事件信息后,主动联系医院商量解决事宜,考虑到科室使用不能中断,返厂维修路途运输花费时间较长,最终厂家同意无偿提供零配件快递到医院,医院安排专人负责带零配件上科室维修,极大地解决了针灸理疗科治疗仪故障、破损、残缺、闲置的问题,增加了器械的使用率。④某厂生产的一次性肛门镜:发现某批次产品多个漏气(密封不严),潜在用物污染,通过平台上报后,厂家积极联系医院调查核实情况,紧急召回问题产品,及时阻止了不合格产品临床误使用给患者带来的潜在危险,也挽回了医院的经济损失。将企业更换补偿的合格产品奖励给科室,该科上报的积极性明显增强。对典型不良事件分析评价、实施恰当的干预方法以及取得的收益结果影响医务人员上报的积极性。
3 讨论
药品医疗器械不良反应事件监测工作的实质是对可疑药品/医疗器械不良事件的发现、报告、评价,并采取有效的控制措施,以避免严重不良事件的重复发生和蔓延[3-4]。建议从以下四个方面加强监管,构建合理的工作机制,共同促进和保障公民的健康安全。
3.1 加强宣传力度,促进主动上报 开展形式多样的宣传培训,深入到各个阶层的人群:监测员深入临床一线,以科室为单位开展宣传培训,面对面交流探讨,指导填报,避免统一组织学习培训而影响临床工作,占用时间少,医护乐于接受;有利于医务人员快速掌握如何规范填报,如何识别药品医疗器械标签信息,填报注意事项等;利用微信、QQ 等自媒体定期发布不良反应事件相关新动态;实物奖励调动上报的积极性;建议设立专项基金,使奖励的经费得到保障,用于奖励在监测工作中表现突出的单位或者个人。
3.2 加大专业医疗器械维修人员的培养和引进 本研究调查得知,大部分基层医院缺乏专业医疗器械维修人员,通常由电工兼职承担器械维修。大部分医院重视医疗器械采购,轻视管理,对器械不良事件监测任务的重要性认识不够,对发生的不良事件没有采取针对性的措施,对器械安全隐患没有制定应急预案,导致不良事件重复发生。随着医院新业务不断拓展,各类高精仪器大量投入使用,如何保障各类仪器安全运行,发挥医疗设备效能,为临床高效、精准治疗和检查保驾护航则显得尤为重要,因此建议医院管理层将培养器械工程技术人员列入医院人才培养计划,重视专业医疗器械维修人员的引进和培养,负责对院内各类医疗器械的使用、储存、保养进行规范化培训、监督和管理;承担医疗器械不良事件的监测任务,在仪器发生故障时不仅能及时解除故障,提高维修效率,方便临床使用,还给医院节约了高额的专业售后维修费用。
3.3 注重药品和医疗器械购进前调研考察 建议医院紧密联系当地、国家不良事件监测中心,了解相关药品医疗器械不良事件信息,并结合本院对药品医疗器械的安全性、有效性监测和不良反应评价的结果来指导临床药物使用和医疗器械的购进[3],将器械不良事件记录拉入医疗器械购进前的考察内容,采购临床反应性价比高的耗材器械,对临床发现的不良反应频发、评估风险高的耗材器械通过平台上报,问题产品联系厂家退换货,免费维修等处理。
3.4 建立健全不良反应事件的监督反馈机制 医院管理者要加强药品医疗器械监测管理的监督反馈体系建设,从药品医疗器械的采购、验收入库、储存/养护、使用/销售、维修和报损各个环节实现全流程的监督管理。医院药械不良反应监测组织要定期将各科上报的不良反应事件信息进行汇总、讨论分析,出具风险分析评价报告,并对出现的问题提出改进措施,反馈给相关部门进行整改落实,并监督措施落实情况,评估收效,以此更新完善管理措施,使不良反应事件监测工作良性循环,保证医疗工作安全,促进医院的发展。
我国的医疗器械不良事件监测工作进入新的发展时期,在大幅度提高报告数量,扩大监测覆盖面的同时及时研究分析评价方法,提高报告的可利用度,探索上市后医疗器械的安全性评价,成为当前我国医疗器械不良事件监测工作发展进程中的核心工作之一[5]。在医院大力开展医疗器械不良事件监测上报的同时,监测部门要加强企业的法律法规培训,督促企业主动开展医疗器械安全性研究,并依法及时上报不良事件,对通过平台收集、获知医院上报的不良事件监测信息进行分析、评价,利用,由此改进医疗器械结构和性能,推进新产品研发,降低和控制产品风险,企业实现良性健康发展。药品不良反应监测具有弥补药品上市前研究的不足,为上市后再评价提供服务;为遴选、整顿和淘汰药品提供依据,促进药品研发。
通过本文案例,希望对基层医院开展不良反应事件有参考意义,提升对药械不良反应事件的重视,从管理流程、宣传培训、针对性采取措施上提供经验,探讨应对方法和对策,共同推动药品医疗器械不良反应事件监测工作的开展,保障公众健康和社会稳定。

