不同海拔油橄榄对自然低温的生理响应及抗寒性差异
海光辉 ,张正武 ,王 茜 ,雍巧宁 ,邓 煜 ,海 宏
(1. 陇南市经济林研究院,甘肃 武都 746000;2. 陇南市经济林研究院 油橄榄研究所,甘肃 武都 746000;3. 陇南市武都区花椒服务中心,甘肃 武都 746000)
油橄榄Olea europaea与油茶Camellia oleifera Abel、 油 棕Elaeis guineensis Jacq、 椰 子Cocos nucifera并称为世界四大木本食用油料树种,用油橄榄鲜果冷榨而成的橄榄油保存了天然营养成分,被誉为“液体黄金”。世界上有油橄榄品种2 000多种,广泛分布于地中海沿岸国家[1]。甘肃陇南以北纬33°独特的地理位置、与地中海沿岸相似的气候和土壤条件,被国际油橄榄理事会(IOC)认定为油橄榄一级适生区,全市种植面积达5万hm2,是中国油橄榄的主栽区。陇南辖区内沟壑纵横,高山河谷交错分布,油橄榄主要栽植在白龙江流域低山河谷区及沿岸海拔650~1 624 m的山坡上,受山地地形、大气环流和太阳辐射的影响,种植区气候差异悬殊[2]。有研究表明,冬季一定程度的低温积累有利于油橄榄花芽分化[3],但当低温低于油橄榄能忍受的极限温度,或未低于最低极限温度但持续时间较长,就会冻伤树体,使树干管胞丧失输水功能,严重的甚至会死亡[4-6]。长时间低温胁迫后,脂肪酸去饱和酶(FAD)基因表达和果实中不饱和脂肪酸的组成发生变化[7]。因此,冬季低温是影响油橄榄引种、栽培、生产、油品质的重要因素[7-8]。
油橄榄主要栽培品种有320种[1],由于遗传背景不同,品种间的抗寒能力存在明显差异。金银春等[9]结合叶片表型和生理抗性指标分析,认为皮削利抗寒性较好、鄂植8号抗寒性适中、莱星抗寒性较差。尉淑珍[10]认为,佛奥、鄂植8号、莱星3个品种丙二醛含量低而脯氨酸含量高,抗寒性强;配多灵、皮削利、阿斯3个品种丙二醛含量高而脯氨酸含量低,抗寒性差。张正武[2]通过实地调查发现,油橄榄1~3年生幼苗遭受低温冻害后,主栽品种中阿斯抗寒性最强,科拉蒂抗寒性最弱;新引进的西班牙品种中豆果抗寒性最强,奇迹抗寒性最弱。令凡等[11-13]应用电导率法、隶属函数分析法和主成分分析法进行分析,认为油橄榄品种的抗寒性由强到弱依次为:皮削利、配多灵、莱星、阿斯、鄂植8号、佛奥。同时,植物在生长发育过程中,一系列生物因子和非生物因子都会影响其抗寒性,利用电解质渗透法、叶绿素荧光法等单一方法测定植物抗寒性,无法准确、全面体现出植物的抗寒性强弱,还需利用多个指标综合分析评价[14-15]。国内外对油橄榄抗寒性的研究主要集中在低温对脂肪酸组成和油品质的影响、人工模拟气候室法对油橄榄离体叶片进行低温胁迫处理等方面,且所用材料大多为1~3年生幼苗,不一定能真实反映出油橄榄在自然生长环境下的抗寒性,而不同海拔生长的油橄榄大树对自然低温的生理响应及抗寒性评价鲜有报道,对不同海拔区域科学种植油橄榄、扩大栽培面积缺少理论指导。
鉴于此,为更贴切生产实践,本研究通过开展田间植株受冻害程度与恢复情况调查的同时,分析不同海拔生长的油橄榄对自然低温的生理响应,综合评价其抗寒性,对筛选出适宜不同海拔区域栽培的油橄榄品种具有重要的理论意义和实践价值。
1 材料与方法
1.1 试验材料
试验材料来自陇南市武都区江南街道办大堡村油橄榄种质资源库(海拔1 000 m)和陇南市宕昌县沙湾镇大寨村风鞍山油橄榄园(海拔1 300 m),分别为阿斯(Ascolana)、莱星(Leccino)、奇迹(Koroneiki)、鄂植8号(Ezhi8)和阿尔波萨纳(Arbosana),5个品种在两个不同海拔的油橄榄园均有分布,均为8年生扦插苗,枝干均达到二级分枝,平均树高为3.16 m,平均地径为15.35 cm,株行距为3 m×4 m,水肥管理条件一致。不同海拔油橄榄园的立地条件见表1。
1.2 试验设计
根据陇南市气象局发布的天气预报,2022年1月22—28日,全市有较明显雨雪天气,经过连续观察,1月27日全市大部分地方出现降雪天气,1月28日出现自然低温现象。根据天气网数据记录,1月28日,武都区最低温度-4 ℃,宕昌县最低温度-8 ℃。根据温度计测定,大堡油橄榄种质资源库的温度为2 ℃,风鞍山油橄榄园的温度为-3 ℃。本试验设置2个海拔梯度:1 000和1 300 m,取样时间为1月28日早上,选取生长健壮、无病虫害的植株,剪取3年生枝条中间约10~15 cm,用湿毛巾包裹后置于冰盒。待全部取样结束,将叶片剪下并放置在-80 ℃冰箱保存。

表1 不同海拔油橄榄园的立地条件Table 1 The site conditions of olive garden at different altitudes
1.3 受冻和恢复情况调查方法
参考张正武[2]和李在山等[16]的方法,1月28日出现自然低温后至油橄榄萌芽期间,在油橄榄园内,沿着园区对角线,每个品种选取20株样树,做好标记,对油橄榄样本树的冻害等级及恢复情况进行精确划分,并做好记录。0级,无任何冻害症状,不影响新芽发育;Ⅰ级,顶芽发蔫,叶片轻微卷曲,春季正常发芽;Ⅱ级,部分顶芽和嫩叶失水干枯,脱落后可萌发新芽;Ⅲ级,枝条上的叶片均失水干枯,脱落后可萌发新芽,受冻害枝条数量不超过树冠所有枝条的一半;Ⅳ级,树冠的枝条全部干枯,主干在春季可以长出新梢;Ⅴ级,整株树木干枯死亡,无法恢复。
1.4 生理指标测定方法
叶绿素含量采用丙酮萃取法测定,具体操作依据李玲等[17]方法进行。可溶性蛋白质含量使用总蛋白(TP)测定试剂盒(考马斯亮蓝法)(A045-2-2)测定,可溶性糖含量使用植物可溶性糖含量测试盒(比色法)(A145-1-1)测定,丙二醛(MDA)含量采用丙二醛(MDA)测定试剂盒(TBA法)(A003-1-2)测定,脯氨酸含量采用脯氨酸(Pro)测定试剂盒(比色法)(A107-1-1)测定,过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性分别使用过氧化氢酶(CAT)测定试剂盒(可见光法)(钼酸铵法)(A007-1-1)、过氧化物酶(POD)测定试剂盒(测植物)(比色法)(A084-3-1)、总超氧化物歧化酶(T-SOD)测试盒(羟胺法)(A001-1-2)测定。这些试剂盒均购自南京建成生物工程研究所。同一海拔下每个指标重复测定5株树。
1.5 抗寒性评价方法
应用隶属函数法综合评价不同油橄榄品种抗寒性[12,18-19]:采用模糊数学的隶属函数法计算每个品种各抗性相关指标的隶属度。其中,与抗寒性呈正相关的蛋白质含量、脯氨酸含量、总叶绿素含量、可溶性糖含量和抗氧化酶(SOD、POD和CAT)活性用公式(1)计算:

与抗寒性呈负相关的相对电导率、MDA含量用公式(2)计算:

式(1)~(2)中,U(Xijk)为第i个品种第j个海拔梯度第k项指标的隶属度,且U(Xijk)∈[0,1];Xijk表示第i个品种第j个海拔梯度第k个指标测定值;Xmax、Xmin为所有试验品种中第k项指标的最大值和最小值。用每个品种各项指标隶属度的平均值作为各品种抗寒能力的综合评价标准,进行比较。
1.6 数据处理
采用Excel 2007及SPSS 20.0软件进行试验数据分析,样品可变性用标准差(standard deviation,SD)表示。统计方法为单因素方差分析(Anova),两两比较用Turkey方法,差异显著性水平P<0.05。油橄榄生理指标热图使用TBtools软件构建,各项参数依照软件内定程序设置[20]。
2 结果与分析
2.1 自然低温下不同海拔油橄榄的受冻情况与恢复情况
在海拔1 000 m处,本次自然低温对阿斯、莱星、奇迹、鄂植8号、阿尔波萨纳生长没有影响;在海拔1 300 m处,各个品种油橄榄遭受冻害的情况不同。其中,阿斯没有遭受冻害,少部分莱星、奇迹、鄂植8号、阿尔波萨纳遭受Ⅰ级冻害,极少数的奇迹遭受Ⅱ级冻害(表2)。根据春季调查的油橄榄生长恢复情况,所有品种油橄榄都能正常发芽,长势旺盛,没有出现因冻害而影响生长发芽的情况。
2.2 自然低温下不同海拔油橄榄新陈代谢关键物质的变化
自然低温下不同海拔油橄榄新陈代谢关键物质随海拔升高变化有差异(表3)。
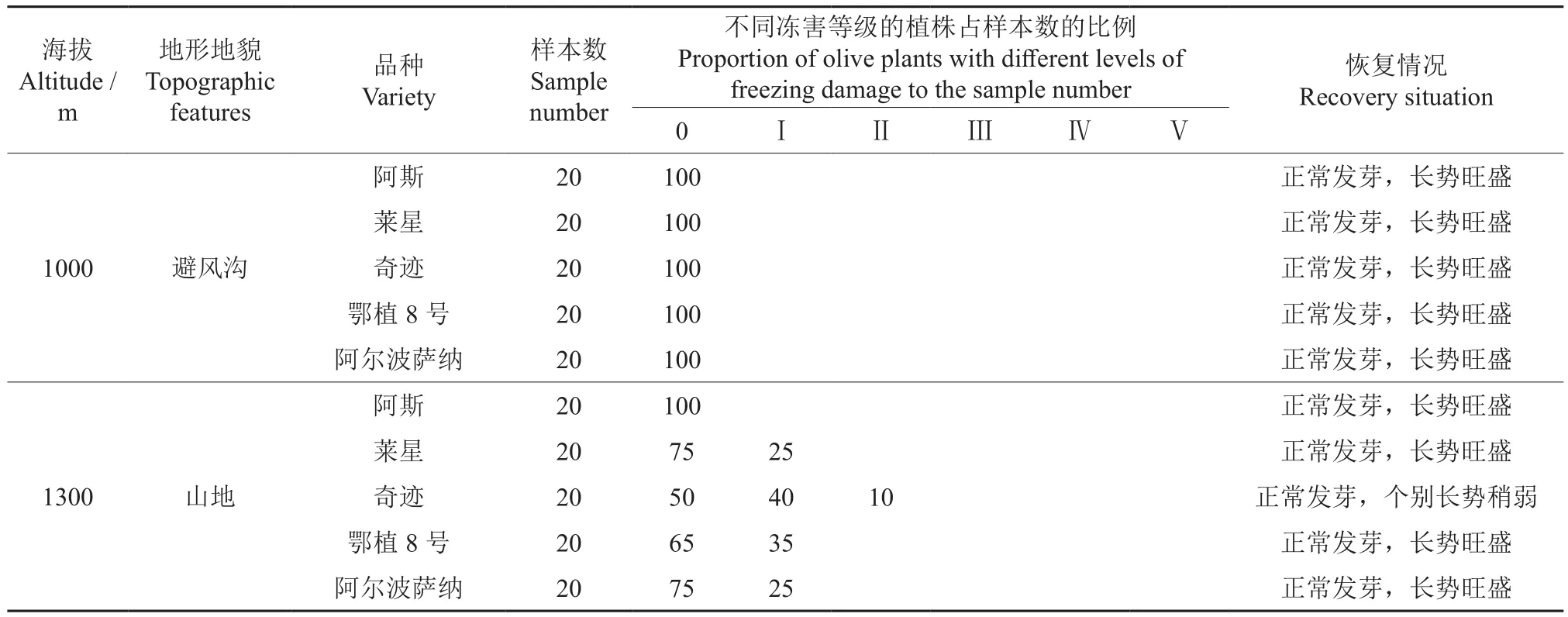
表2 自然低温下不同海拔油橄榄的受冻情况和恢复情况†Table 2 Freezing and recovery of olive at different altitudes under natural low temperature

表3 自然低温下不同海拔油橄榄新陈代谢关键物质的变化†Table 3 The changes of key metabolites in olive at different altitudes under natural low temperature
可溶性蛋白质含量:同品种油橄榄可溶性蛋白含量随海拔上升发生一定变化,其中莱星、鄂植8号、阿尔波萨纳在1 300 m比1 000 m分别提高了14.02%、20.95%、11.88%,阿斯降低了35.23%,奇迹几乎不变,且阿斯和鄂植8号差异显著。同一海拔不同油橄榄品种的可溶性蛋白质含量存在一定差异。在1 000 m,阿斯的可溶性蛋白质含量最高,是最低的鄂植8号的1.19倍,差异显著;而莱星、奇迹、阿尔波萨纳与阿斯和鄂植8号的差异均不显著。在1 300 m,可溶性蛋白质含量最高的是莱星,是最低的阿斯的1.64倍,差异显著;而奇迹、鄂植8号、阿尔波萨纳与莱星差异均不显著,但都明显高于阿斯。
可溶性糖含量:阿斯、莱星、奇迹、鄂植8号随海拔升高分别降低了13.62%、19.06%、6.05%、7.31%,而阿尔波萨纳提高了17.94%,且阿斯、莱星、阿尔波萨纳变化差异显著。在1 000 m,阿斯的可溶性糖含量最高,奇迹最低,二者相差1.76倍;莱星明显低于阿斯,但鄂植8号、阿尔波萨纳与奇迹之间的差异不显著。在1 300 m,最高的阿斯与最低的奇迹相差1.61倍,差异显著;阿尔波萨纳明显低于阿斯,莱星、鄂植8号与奇迹间差异不显著。
总叶绿素含量:随海拔升高,同一品种油橄榄总叶绿素含量存在一定变化,其中,阿斯提高了27.93%,莱星、奇迹、阿尔波萨纳分别降低了14.17%、19.01%、10.07%,鄂植8号几乎不变,阿斯和奇迹差异显著。在1 000 m,总叶绿素含量最高的是阿尔波萨纳,最低的是鄂植8号,二者相差1.33倍,差异显著;奇迹与阿尔波萨纳、阿斯与鄂植8号间差异均不显著,莱星与阿尔波萨纳、鄂植8号间差异也不显著。在1 300 m,总叶绿素含量最高的是阿斯,最低的是莱星,二者相差1.35倍,差异显著;阿尔波萨纳与阿斯差异不显著,奇迹、鄂植8号与莱星间差异不显著。
2.3 自然低温下不同海拔油橄榄细胞代谢的变化
自然低温下不同海拔油橄榄细胞代谢变化较大(图1)。
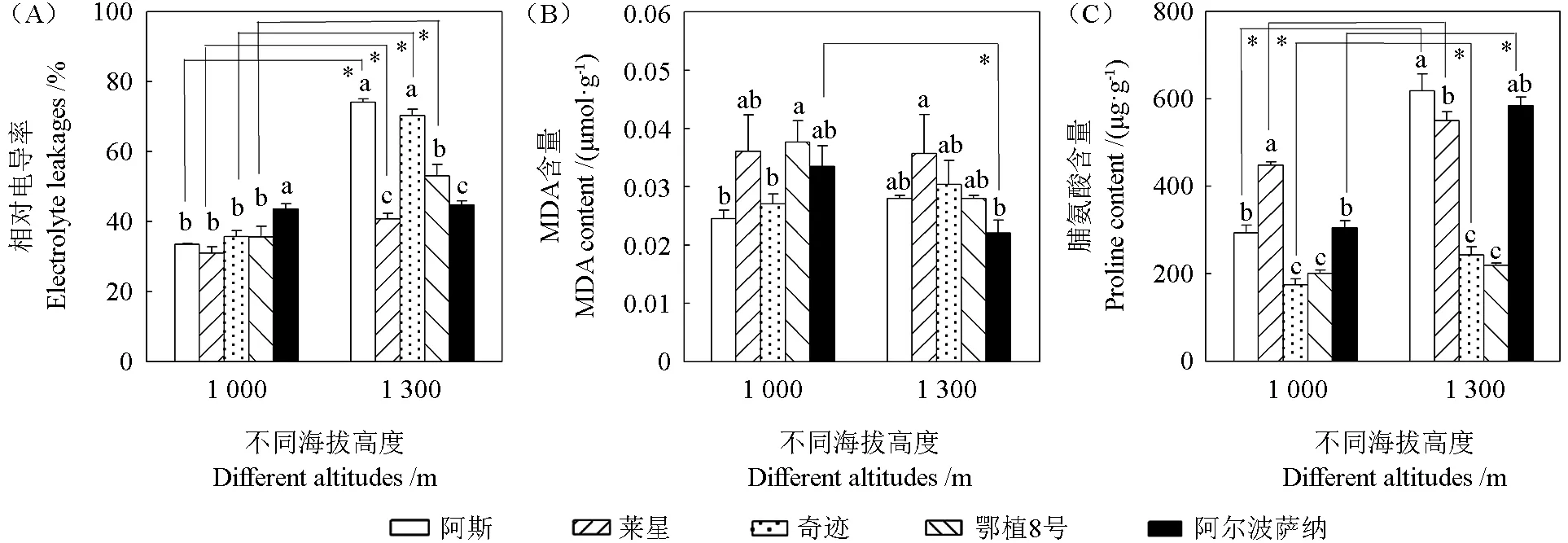
图1 自然低温下不同海拔油橄榄细胞代谢变化Fig. 1 The changes of cellular metabolism in olive trees at different altitudes under natural low temperature
细胞受损情况:测定相对电导率反映细胞损伤结果。图1A显示,随海拔升高,同一品种油橄榄相对电导率呈升高趋势,阿斯、莱星、奇迹、鄂植8号、阿尔波萨纳分别提高了121.47%、31.72%、96.86%、49.03%、2.71%,且阿斯、莱星、奇迹、鄂植8号的变化差异显著。在1 000 m,相对电导率最高的是阿尔波萨纳,最低的是莱星,二者相差1.41倍,差异显著;其余3个品种与阿尔波萨纳差异均显著。在1 300 m,相对电导率最高的是阿斯,最低的是莱星,二者相差1.82倍,差异显著;奇迹与阿斯、阿尔波萨纳与莱星差异不显著,鄂植8号与阿斯、莱星差异显著。
MDA含量:图1B显示,随海拔升高,阿斯、奇迹的MDA含量分别提高了14.29%、12.18%,鄂植8号、阿尔波萨纳分别降低了25.73%、34.03%,莱星变化较小,但仅有阿尔波萨纳差异显著。在1 000 m,MDA含量最高、最低的分别是鄂植8号、阿斯,相差1.54倍,差异显著;莱星、阿尔波萨纳分别与鄂植8号、阿斯均没有显著差异;在1 300 m,莱星的MDA含量是阿尔波萨纳的1.62倍,差异显著,其余3个品种与莱星、阿尔波萨纳差异均不显著。
脯氨酸含量:图1C显示,随海拔升高,阿斯、莱星、奇迹、鄂植8号、阿尔波萨纳分别提高了110.89%、22.64%、39.26%、9.41%、91.51%,且阿斯、莱星、奇迹、阿尔波萨纳的变化差异均显著。在1 000 m,莱星的脯氨酸含量最高,是最低的奇迹的1.56倍,差异显著;阿斯、阿尔波萨纳分别与莱星、奇迹、鄂植8号差异显著,但阿斯与阿尔波萨纳差异不显著。在1 300 m,阿斯是鄂植8号的2.82倍,差异显著;阿尔波萨纳与阿斯、莱星均差异不显著,与奇迹、鄂植8号差异显著。
2.4 自然低温下不同海拔油橄榄抗氧化酶活性的变化
自然低温下不同海拔油橄榄抗的氧化酶活性发生较大变化(图2)。
CAT活性:随海拔升高,同一品种油橄榄CAT活性呈升高趋势,莱星、奇迹、鄂植8号、阿尔波萨纳分别提高了42.72%、6.48%、36.86%、73.69%,阿斯变化较小,莱星、阿尔波萨纳变化差异显著。在1 000 m,CAT活性最高的是阿斯,是最低的奇迹的4.32倍,差异显著;且除莱星与鄂植8号、阿尔波萨纳差异不显著外,其余各品种两两之间差异均显著。在1 300 m,CAT活性最高的是阿尔波萨纳,最低的是奇迹,二者相差4.33倍;莱星、鄂植8号分别与阿斯、奇迹、阿尔波萨纳存在显著差异,但阿斯与阿尔波萨纳、莱星与鄂植8号差异均不显著。

图2 自然低温下不同海拔油橄榄抗氧化酶活性变化Fig. 2 The changes of antioxidant enzyme activity in olive trees at different altitudes under natural low temperature
POD活性:随海拔升高,阿斯、莱星、奇迹、阿尔波萨纳分别提高了9.91%、129.21%、30.95%、40.47%,鄂植8号降低了9.64%,但仅莱星差异显著。在1 000 m,POD活性最高的是鄂植8号,是最低的莱星的1.23倍,且5个品种之间差异不显著。在1 300 m处,POD活性最高的是莱星,最低的是鄂植8号,二者相差2.06倍,差异显著;其余3个品种均明显低于莱星,且与鄂植8号差异不显著。
SOD活性:随海拔升高,阿斯、莱星、阿尔波萨纳分别提高了102.76%、27.37%、12.17%,奇迹、鄂植8号分别降低了21.12%、36.34%,且阿斯、莱星、奇迹、鄂植8号差异显著。在1 000 m,SOD活性最高的鄂植8号是莱星的1.77倍,差异显著;其余3个品种均明显低于鄂植8号,且与莱星差异均不显著。在1 300 m,SOD活性最高的是阿斯,最低的是奇迹,二者相差2.32倍,差异显著;其余3个品种均低于阿斯高于奇迹,但两两之间差异不显著。
2.5 自然低温下油橄榄抗寒性的综合评价
应用隶属函数法对5个油橄榄品种各抗寒性生理指标进行综合分析,发现阿斯、阿尔波萨纳、莱星抗寒性总体优于鄂植8号和奇迹;阿斯、阿尔波萨纳、莱星、鄂植8号、奇迹的平均隶属度从大到小依次为0.635、0.559、0.496、0.326、0.286(表4)。平均隶属度综合体现了各品种抗寒能力的大小,数值越大说明抗寒性越强。因此,自然低温下5个油橄榄品种的抗寒性由强到弱依次为:阿斯>阿尔波萨纳>莱星>鄂植8号>奇迹。
3 讨论与结论
3.1 讨 论
油橄榄起源于地中海海岸的中东部,喜欢“夏季炎热干燥、冬季温和多雨”的气候,对低温比较敏感[2,21-22],观察自然低温下油橄榄叶片的表型变化,可为判断品种抗寒性强弱提供理论依据。随海拔升高,本次自然低温对阿斯、莱星、奇迹、鄂植8号、阿尔波萨纳的冻害等级分别为0级、Ⅰ级、Ⅰ~Ⅱ级、Ⅰ级、Ⅰ级,整体上使油橄榄遭受了轻微冻害。各品种抗寒性的强弱大致可分为3个梯度:第一梯度为阿斯,抗寒性较强;第二梯度为莱星、鄂植8号和阿尔波萨纳,抗寒性中等;第三梯度为奇迹,抗寒性较弱,这与张正武[2]的研究结果一致。
自然低温下,随海拔升高,油橄榄新陈代谢关键物质可溶性蛋白、可溶性糖和总叶绿素与抗寒密切相关。可溶性蛋白含量,在莱星、鄂植8号、阿尔波萨纳中均上升,可以有效降低细胞液冰点,避免因结冰而伤害致死[23];在阿斯中下降,说明蛋白的合成受到限制,可能对其造成伤害,这与刘国宇等[24]在自然低温对金边假连翘的影响研究中可溶性蛋白含量变化结果基本一致。可溶性糖含量,在阿尔波萨纳中上升,一定程度上降低了细胞渗透势,有助于提高抗寒能力[25];在阿斯、莱星、奇迹、鄂植8号中下降,说明可溶性糖一直处于消耗状态,抵御低温的能力下降,这与刘国宇等[24]的研究结果基本一致。有研究表明,温度降低到半致死温度会威胁植物生长,叶片开始表现出蜷曲、萎蔫的表型,变得很脆且容易折断[26]。本研究中总叶绿素含量,在阿斯中上升,叶绿素合成速度大于分解速度,说明此次自然低温对阿斯的生长没有影响,在莱星、奇迹、阿尔波萨纳中下降,叶绿素分解速度大于合成速度,说明此次自然低温对这3个品种的生长稍有影响,这些均与田间调查受冻情况的结果一致;此外,在海拔1 300 m处,阿斯和阿尔波萨纳中的总叶绿素含量均高于其余3个品种,这与抗寒性强的品种维持较高的叶绿素含量相一致[27]。

表4 自然低温下5个油橄榄品种各指标隶属函数值及抗寒性综合评价值Table 4 The subordinate function value of each index and the comprehensive evaluation value of cold resistance of the 5 olive varieties under natural low temperature
植物细胞膜具有调节控制细胞内外物质交换的屏障作用,其稳定性是评价植物抗逆性强弱的重要指标。低温胁迫下,抗寒性弱的植物,其细胞膜系统稳定性较差,细胞内电解质外渗量大,相对电导率大[12,25]。本试验中,5个油橄榄品种的相对电导率随着海拔的升高呈上升趋势,表明海拔升高各品种油橄榄叶片细胞受到不同程度损害。MDA是细胞内不饱和脂肪酸被氧化后产生的,对细胞膜结构和功能有毒害作用,其含量越低,细胞受伤害程度越轻[28]。随海拔升高,只有阿尔波萨纳中MDA含量明显下降,说明此时细胞可以通过正常的代谢功能来降低细胞膜受到的伤害,而其余4个品种受到的膜毒害作用仍在持续。脯氨酸含量的高低对植物的抗寒性起着重要作用[29]。5个品种油橄榄中的脯氨酸含量随着海拔升高呈上升趋势,表明与各品种的抗寒能力有关;阿斯和阿尔波萨纳中脯氨酸含量的增加幅度最大,说明抗逆性强的植物能积累更多的脯氨酸,这与郝小琴等[29]的研究结果一致。
CAT、POD、SOD是植物对膜脂过氧化酶促防御系统的保护酶。在植物遭受逆境时,这些保护酶作为一个抗氧化的膜保护系统,能够清除植物体内多余的自由基[30-31]。令凡等[13]认为,油橄榄叶片CAT、POD、SOD活性随胁迫温度降低总体上呈先升后降趋势;但刘国宇等[24]发现,自然低温下植物的POD和SOD活性整体呈上升趋势,而CAT活性在不同植物中的升降趋势各不相同。本研究中,阿斯、阿尔波萨纳的CAT和SOD活性始终较高,说明对低温胁迫具有较强的防御作用;莱星中CAT、POD和SOD活性均在中上水平,说明对低温胁迫具有一定的抵御作用;而奇迹、鄂植8号中CAT、POD和SOD活性没有明显增强甚至出现减弱情况,可能是由于低温影响了酶的结构或抑制了酶的表达,从而导致酶活性减弱[32]。
抗寒性是由多因素联合控制的综合性数量性状,依据单一生理指标难以准确、全面地反映植物抗寒性的强弱,在许多研究中均利用隶属函数法来综合评价多个指标[13-14,19,33]。本研究表明,5个油橄榄品种中的9个单项指标的变化值与抗寒性综合评价结果并不完全一致,进一步说明在利用生理指标评价抗寒性时,需要结合统计分析方法,这样才能保证评价结果的科学性与可靠性。此外,本研究结果虽然能部分反映出不同品种油橄榄在自然低温下的抗寒性强弱,但仅分析了1年的数据,而在自然条件下生长的植物每年经历的气温变化不同,植物会随之发生一定幅度的变化,为了能更加科学地反映出各品种油橄榄的抗寒性,尚需3年以上连续不间断地进行田间观察。准确掌握不同品种油橄榄的抗寒性,有利于加强引种工作的针对性和推广工作的区域性。同时,植物抵御低温胁迫的过程是非常复杂的,涉及形态、生理和基因调控等多方面的响应。随着油橄榄基因组图谱的发布[34-35],解析油橄榄抗寒的生理与分子机制是培育抗寒新品种[36]的必由之路,目前调控油橄榄抗寒性[37]的主要生理代谢途径和关键基因还不清楚,还有待进一步研究。
3.2 结 论
自然低温下,5个油橄榄品种均表现出一定的抗寒性,9个单项生理指标变化有差异。
1)根据自然低温下油橄榄叶片的表型变化,各品种抗寒性的强弱大致为:阿斯较强,莱星、鄂植8号和阿尔波萨纳中等,奇迹较弱。
2)随海拔升高,不同品种油橄榄9个单项生理指标的变化各不相同。阿斯的总叶绿素含量、相对电导率、MDA含量、脯氨酸含量、POD活性、SOD活性均升高,可溶性蛋白质含量和可溶性糖含量降低,CAT活性不变;莱星的可溶性蛋白质含量、相对电导率、脯氨酸含量、CAT活性、POD活性、SOD活性均升高,可溶性糖含量和总叶绿素含量降低,MDA含量不变;奇迹的相对电导率、MDA含量、脯氨酸含量、CAT活性、POD活性均提高,可溶性糖含量、总叶绿素含量、SOD活性均降低,可溶性蛋白质含量不变;鄂植8号的可溶性蛋白质、相对电导率、脯氨酸含量、CAT活性均提高,可溶性糖含量、MDA含量、POD活性、SOD活性均降低,总叶绿素含量不变;阿尔波萨纳可溶性蛋白质含量、可溶性糖含量、相对电导率、脯氨酸含量、CAT活性、POD活性、SOD活性均提高,总叶绿素含量和MDA含量降低。
3)根据油橄榄不同品种的平均隶属度,各品种抗寒性顺序:阿斯>阿尔波萨纳>莱星>鄂植8号>奇迹。

