大洋表层沉积物中甲烷代谢古菌群落的组成及分布特征
刘皓 ,许秋彤 ,王春生 ,荆红梅
( 1. 中国科学院深海科学与工程研究所 中国科学院深海极端环境模拟重点实验室,海南 三亚 572000;2. 自然资源部第二海洋研究所,浙江 杭州 310012;3. 中国科学院三亚海洋科学综合(联合)实验室,海南 三亚 572000;4. 南方海洋科学与工程广东省实验室(珠海),广东 珠海 519082;5. 海南省热带海洋生物技术重点实验室,海南 三亚 572000;6. 中国科学院南海海洋研究所,广东 广州 510301)
1 引言
海洋沉积物覆盖约2/3的地球表面,含有丰富多样的微生物类群。在沉积物表层,氧气被快速消耗,随着海洋深度的增加,绝大部分沉积物处于厌氧环境[1]。海洋沉积物中的有机质厌氧氧化的终产物甲烷,主要是由微生物驱动的甲烷循环代谢过程产生[2]。甲烷所引起的温室效应是等摩尔的二氧化碳的34倍,贡献了全球变暖的20%[3],因此海洋沉积物中甲烷的代谢过程对全球气候变化起着重要的作用。
海洋沉积物中直接参与甲烷代谢的微生物包括产甲烷菌(Methanogens)和厌氧型甲烷氧化菌(Anaerobic Methanotrophs, ANME)。产甲烷菌是形态结构各异但生理功能非常相近且极端厌氧的一类古菌的总称,属于古菌域(Archaea)中的广古菌门(Euryarchaeota)[4],广泛分布于各类氧化还原电位很低的厌氧环境中。目前已知的主要产甲烷途径包括:乙酸盐裂解产甲烷途径、氢气还原二氧化碳产甲烷途径和甲基化合物产甲烷途径。厌氧型甲烷氧化菌属于广古菌门,能够在厌氧的环境中将甲烷氧化成二氧化碳。ANME在冷泉、泥火山和麻坑等甲烷富集沉积物中大量存在[5-8],也存在于热液喷口的烟囱和岩石的厌氧层[9]。向上的甲烷流体的流速和沉积物中微生物的丰度是影响微生物甲烷氧化(Anaerobic Oxidation of Methane, AOM)过程的主要因素,甲烷流体的流速过快,微生物就不能充分氧化甲烷;微生物含量较低的沉积物,氧化甲烷的效率就较低[10]。海洋沉积物所赋存的环境条件特殊且十分复杂,具有温度、甲烷浓度、氧浓度、微量金属元素等多种环境因子差异。这些环境因子变量不仅影响着甲烷氧化微生物的群落结构和活性,而且还将进一步影响AOM过程[11-13]。
近年来,多采用物种或功能特异的标识记基因调查环境中甲烷氧化微生物的多样性。16S rRNA基因是微生物生态学研究中最常用的标记基因[8,14-15],但对产甲烷菌和甲烷氧化菌的特异性不高[3,16]。目前,甲烷代谢保守功能基因mcrA是研究甲烷代谢菌的主要功能基因[17],其编码甲基辅酶M还原酶并存在于所有已知的产甲烷菌和甲烷氧化菌中[18-19]。迄今,以16S rRNA基因和mcrA基因相结合来探究甲烷代谢古菌群落的多样性和组成与基因丰度已被广泛应用于不同海洋生境,包括加利福尼亚湾瓜伊马斯盆地热液区[20]、南海北部陆坡[21]和大西洋边缘冷泉区[22]等区域。然而,大多数海洋甲烷代谢微生物类群的生态学研究都局限于单一海域,所以本研究通过mcrA基因的高通量测序分析,结合荧光实时定量PCR技术,对典型性大洋(大西洋、印度洋和太平洋)表层沉积物样品中甲烷代谢古菌群落的组成多样性与基因丰度进行了研究,以探究甲烷代谢古菌的生态分布特征。
2 材料和方法
2.1 样品采集
沉积物样品涵盖大西洋、印度洋和太平洋三大海区(共计20个样品,图1):包括南大西洋中脊样品(A1-A9站位);西北印度洋脊样品(I10-I14站位);太平洋样品包含了马里亚纳海沟(P15-P17站位)和南海北部(P18-P20站位)两个区域。样品所处海区深度范围为1 015~7 015 m(表1)。除马里亚纳海沟样品(P15-P17,柱状样)由“蛟龙”号利用Push-Core采集外,其余样品均为由抓斗或箱式取样器采集的沉积物表层样品。样品采集后于-80℃保存。
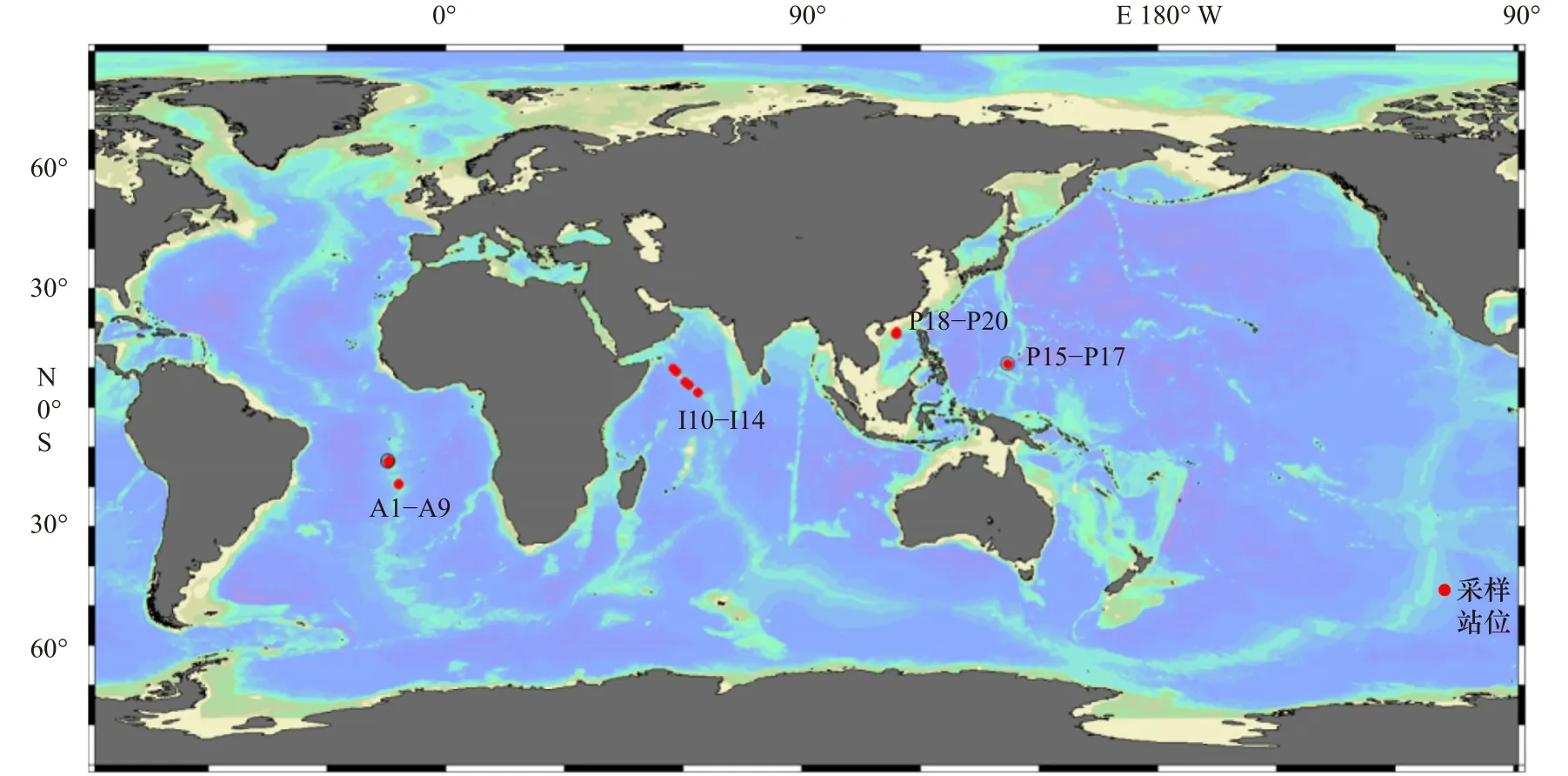
图1 各大洋采样站位分布Fig. 1 Distribution of sampling stations in different oceans
2.2 DNA 提取、mcrA基因的PCR扩增与测序
称取0.5 g沉积物样品,采用PowerSoil® DNA Isolation Kit(MOBIO, USA)试剂盒对表1中20个沉积物样品提取环境总DNA。提取操作步骤参照厂家说明书,提取后的DNA保存于-20℃。mcrA基因使用引物mcrA-F(5′-GGTGGTGTMGGATTCACACARTAYGCWACAGC-3′)和mcrA-R(5′-TTCATTGCRTAGTTWGGRTAGTT-3′)扩增[16]。扩增采用20 μL反应体系:2 μL 10×Buffer,2 μL MgCl2(50 mmoL/L),1.5 μL dNTPs(2.5 mmol/L),1.5 μLmcrA-F (10 μmol/L),1.5 μLmcrAR (10 μmol/L),0.3 μL Taq DNA Polymerase (Invitrogen,USA),2 μL模板DNA,补超纯水至20 μL。反应条件为:95℃预变性4 min;95℃变性45 s,53~52℃退火45 s,72℃延伸1 min,35~40个循环;72℃延伸10 min。PCR产物用1%的TAE琼脂糖凝胶电泳检测,检测合格后,利用PureLinkTM Quick Gel Extraction Kit(Invitrogen, 美国)进行纯化。以等摩尔浓度的扩增子构建扩增子库,并使用454高通量测序仪GS Junior(Roche,Switzerland)进行测序。在本研究所用的20个样品中,I12和P19因扩增mcrA基因片段目的条带太弱未能达到建库要求,因此只对剩余18份样品进行了高通量测序。
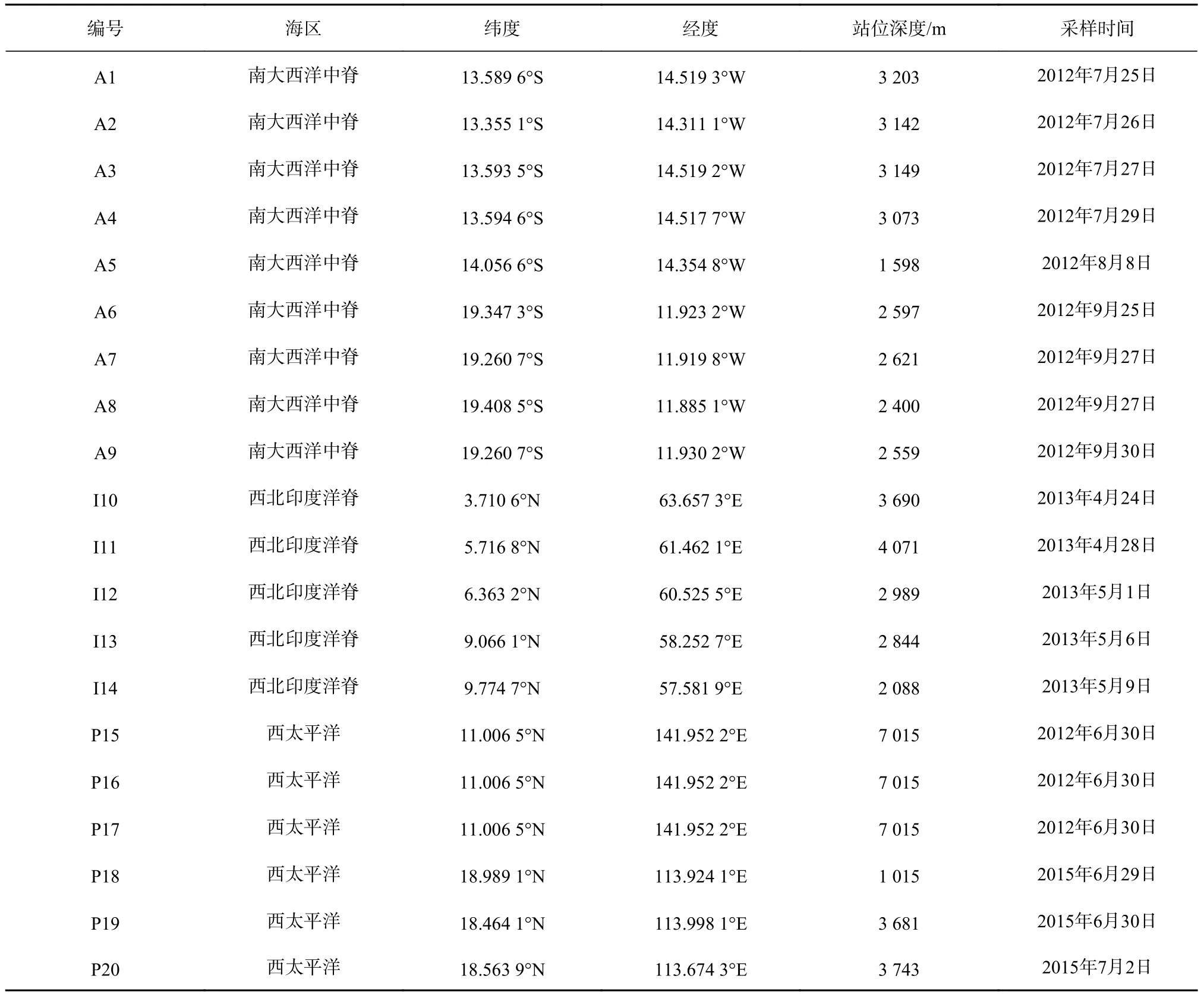
表1 沉积物样品的采样环境参数Table 1 Sampling parameters in different ocean sediments
2.3 实时荧光定量PCR
通过实时荧光定量PCR仪(qPCR,ABI 7500 Fast,USA)对样本中古菌16S rRNA和甲烷代谢古菌的mcrA基因的丰度进行实时定量。古菌16S rRNA基因的引物为344F(5′-ACGGGGCGCAGCAGGCGCGA-3′)和518R(5′-ATTACCGCGGCTGCTGG-3′)[16],反 应条件为:95℃预变性10 min;95℃变性15 s,60℃退火1 min,45个循环。mcrA基因的引物为mcrA-F(5′-GGTGGTGTMGGATTCACACARTAYGCWACAGC-3′)和mcrA-R(5′-TTCATTGCRTAGTTWGGRTAGTT-3′)[16],反应条件为:95℃预变性30 s;95℃变性5 s,55℃退火30 s,40个循环。qPCR采用20 μL反应体系:10 μL 2×SYBR Green Premix,0.2 μL ROXⅡ,1 μL前端引物 (10 μmol/L),1 μL后端引物(10 μmol/L),1 μL模板DNA,补超纯水至20 μL。
2.4 数据分析
2.4.1 序列和多样性指数分析
通过Roche GS Junior获得的mcrA基因原始序列利用mothur软件[23](http://www.mothur.org/)分析处理序列数据。通过去除低质量、长度不正确和含有模糊碱基读数的序列后,进行去噪处理;并与美国生物技术信息中心(National Center for Biotechnology Information, NCBI)数据库中mcrA基因参考序列比对后,移出非mcrA基因序列,最终用97%作为Cutoff值,经过分析后得到分类操作单元(Operational Taxonomic Unit, OTU)表格。利用PAST[24]进行均匀度指数和辛普森多样性指数(两者均为α多样性指数)分析,用单因素方差分析(One-way ANOVA)来比较大洋沉积物甲烷代谢古菌多样性指数和群落结构间的差异性,p<0.05代表具有显著差异。将每个站位处于同一分类归属的OTU合并汇总,得到各站位甲烷代谢古菌种类与相对丰度。将本研究产生的mcrA基因序列的代表序列提交至NCBI数据库,并获得序列号(PRJNA-846686)。
2.4.2mcrA基因系统发育树构建
用mothur软件按97%相似度Cutoff值得到的丰度最高的30个OTU进行系统发育分析,这前30个OTU的序列丰度占到了所有样品中序列的98%以上。将前30个OTU的代表序列上传至NCBI Genbank数据库中,进行Blast比对,挑选比对结果中序列同源度最高的mcrA基因序列片段,用Mega 7[25]构建系统进化树。基于构建的进化树,确定前30个OTU的进化地位归属。OTU1-OTU30是本研究所获得的大洋沉积物序列,其余序列为NCBI数据库下载的参考序列。采用Kimura2-parameter+Gamma Distributed (K2+G)模型和Maximum Likelihood算法建树,bootstrap值为1 000。
3 结果
3.1 各大洋沉积物甲烷代谢古菌的多样性及群落结构
均匀度指数显示,太平洋在所有海区中多样性指数最低;大西洋多样性指数跨度最大,大西洋和印度洋的α多样性指数显著高于太平洋(p<0.05)(图2)。多样性指数趋势与均匀度指数趋势相似,太平洋在所有海区中最低;大西洋多样性指数跨度最大,大西洋和印度洋的α多样性指数显著高于太平洋(p<0.05)。
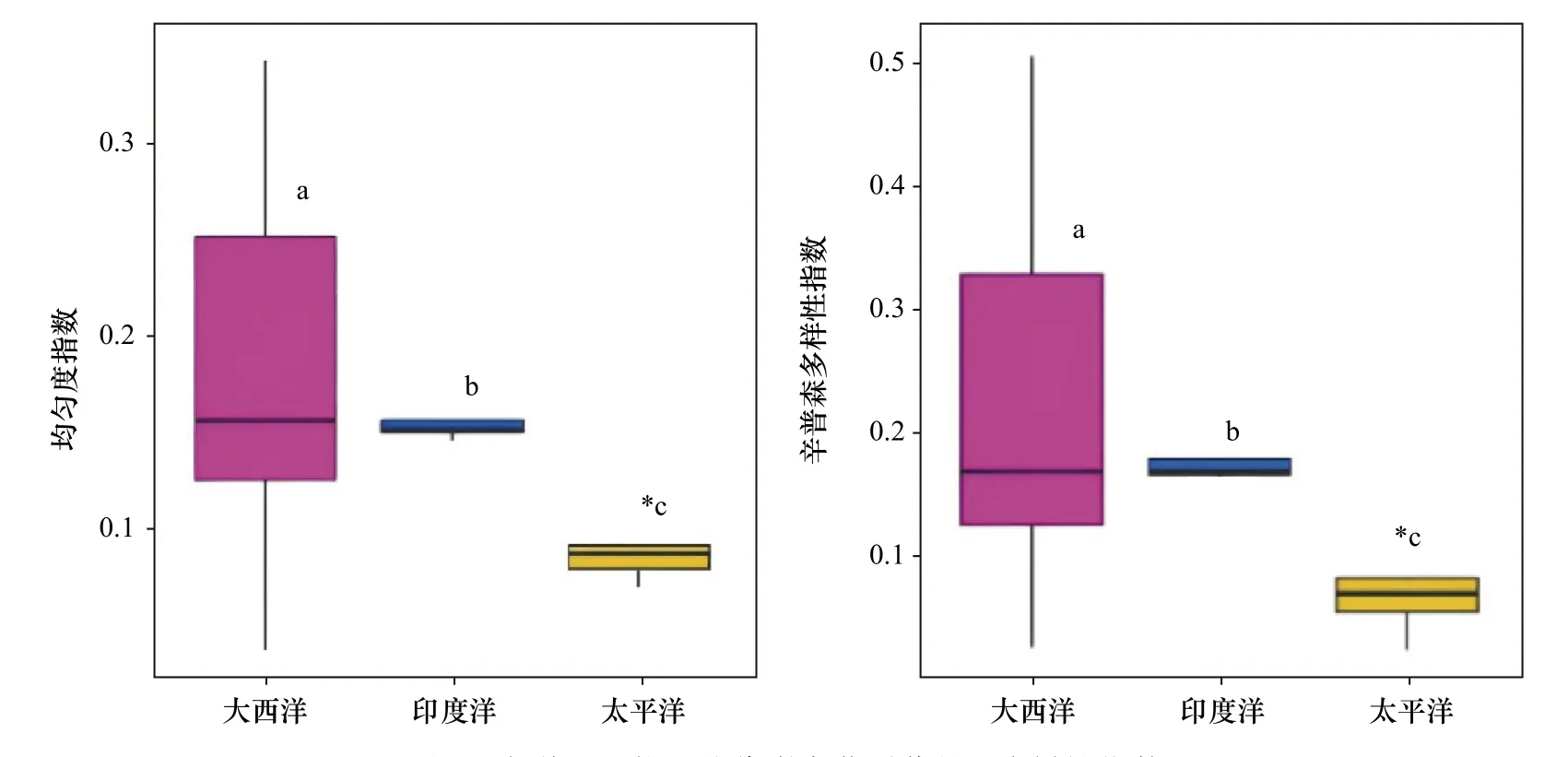
图2 大洋沉积物甲烷代谢古菌群落的α多样性指数Fig. 2 α-diversity index of the methane metabolic microbes in different ocean sediments
甲烷微菌目是本研究所发现的占比最高的类群,其次是甲烷八叠球菌目,甲烷杆菌目仅在马里亚纳海沟P16样品中被发现,仅包含一个属—甲烷短杆菌属,相对丰度为0.21%(图3)。各海区在群落结构上不具有显著差异。
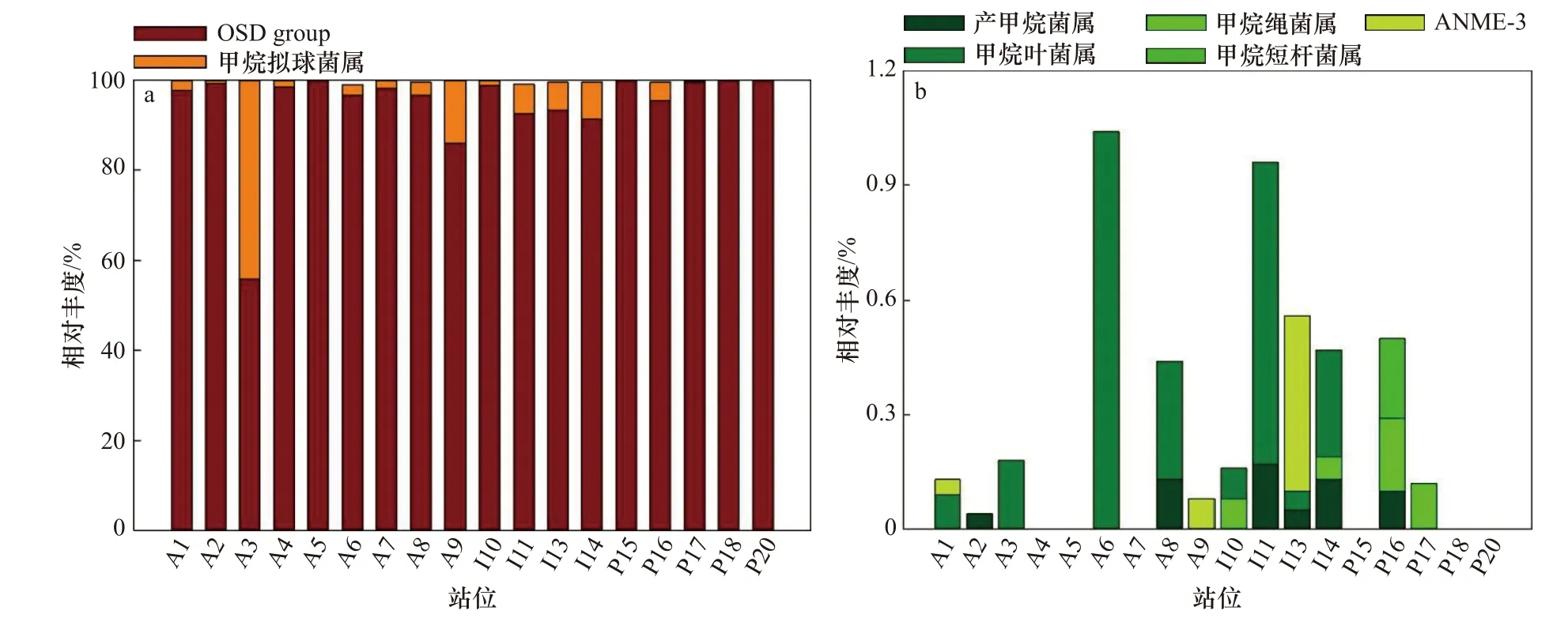
图3 大洋沉积物样品中甲烷代谢古菌的群落结构Fig. 3 Community structure of methane metabolic archaea in different ocean sediments
甲烷微菌目在所有样品中具有绝对优势(A3除外,55.97%),平均丰度达到85%以上。各海区间甲烷微菌目相对丰度存在差异。大西洋海区平均相对丰度较低(92.10%),不同站位间差异性较大(55.97%~99.98%)。印度洋海区具有95.25%的相对丰度,各站位间差异较小。太平洋两个海区平均相对丰度最高(马里亚纳海沟98.55%;南海北部99.93%),最低的P16也有95.61%的相对丰度。本研究中甲烷微菌目由甲烷绳菌属(Methanoline)、产甲烷菌属(Methanogenium)和一个未知类群构成。分析显示,该未知类群隶属于甲烷微菌目,但与其他甲烷微菌目所属分类单元关系较远。因其在本研究所获大洋沉积物样品中的广泛分布,暂命名为Oceanic Sediments Dominant group(OSD group)。OSD group作为所有大洋沉积物样品中的最大类群,相对丰度在55.97%~100%之间,其中P15所获全部序列均由OSD group构成。甲烷绳菌属仅在印度洋(I10、I14),马里亚纳海沟(P16、P17)有极少量发现。产甲烷菌属仅在大西洋(A2、A8),印度洋(I11、I13、I14)和马里亚纳海沟(P16)有少量被发现,相对丰度均小于0.5%(图3)。
甲烷八叠球菌目占比第二高,各大洋沉积物中均有发现(P15除外)。大西洋海区的平均相对丰度最高,但不同站位间差异性很大。印度洋海区次之,除I10号站位(1.12%)较低外,其余站位相对丰度较平均(6.73%~8.59%)。太平洋两海区的平均相对丰度最低。唯一未检测到甲烷八叠球菌目的站位就隶属于太平洋海区。马里亚纳海沟最高有4.17%的相对丰度,南海北部最高丰度仅0.07%。本研究中甲烷八叠球菌目共发现3个属,其中甲烷拟球菌属(Methanococcoides)占优势。除A6(68.95%)、I11(89.15%)外,在其他站位甲烷拟球菌属在甲烷八叠球菌目中的占比达90%以上(图3)。甲烷叶菌属(Methanolobus)仅在大西洋和印度洋的部分站位中被发现,最高相对丰度仅1.04%(A6)。唯一被发现的厌氧甲烷氧化菌ANME-3类群的相对丰度则更低,仅在A1、A9和I13站位样品中被发现。其在印度洋相对丰度最高,但也仅有0.46%,大西洋相对丰度均低于0.1%(图3b)。
3.2 各大洋沉积物甲烷代谢古菌进化地位及系统发育树
系统进化分析显示,占比最高的前30个OTU分属于甲烷微菌目(Methanomicrobiales)、甲烷八叠球菌目(Methanosarcinales)和甲烷杆菌目(Methanobacteriales)(图4)。仅有OTU15隶属于甲烷杆菌目的甲烷短杆菌属(Methanobrevibacter)。甲烷八叠球菌目则有3个属被检测到:OTU10、OTU12、OTU19、OTU23隶属于甲烷叶菌属;OTU3、OTU6、OTU13、OTU18、OTU20、OTU24、OTU25、OTU30隶属于甲烷拟球菌属。甲烷微菌目包含的OTU数目最多,共16个,分属2个属和1个分类地位不明晰的类群。OTU14属于甲烷绳菌属;OTU26、OTU29隶属于产甲烷菌属。其余13个OTU属于一个进化地位不明晰的类群。这13个OUT聚为一类,其置信度高达95%(图4),但是没有任何已知序列与该类群有超过90%的相似度。系统发育树显示,该类群隶属于甲烷微菌目,与产甲烷菌属分支关系较近。该类群与产甲烷菌属归为一个大支的置信度仅有36%。现有研究尚不能对该类群做出明确的进化地位界定。
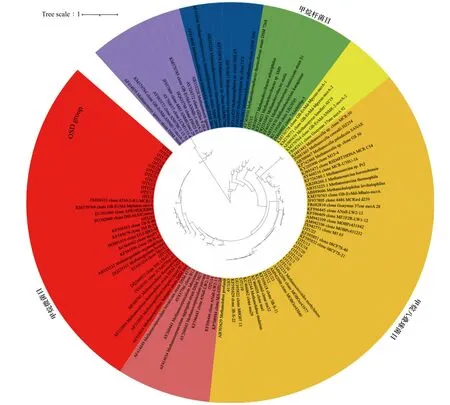
图4 基于甲烷代谢古菌mcrA基因核酸序列构建的系统进化树Fig. 4 The phylogenetic tree based on nucleic acid sequence of mcrA gene of methane metabolizing archaea
3.3 大洋甲烷代谢古菌的丰度
大洋沉积物样品中古菌16S rRNA基因丰度(湿重,下同)范围为1.38×106~3.07×107copies/g,基因平均丰度为8.81×106copies/g。其中,大西洋古菌16S rRNA基因平均丰度为3.30×106copies/g,低于印度洋(1.37×107copies/g)和太平洋(1.30×107copies/g)。马里亚纳海沟沉积物样品中古菌16S rRNA基因平均丰度(3.32×106copies/g)低于南海北部(2.26×107copies/g),且随着沉积物深度增加呈降低趋势。所有样品中,南海北部(P20)的古菌16S rRNA基因丰度最高,而马里亚纳海沟(P17,底层)丰度最低(图5)。
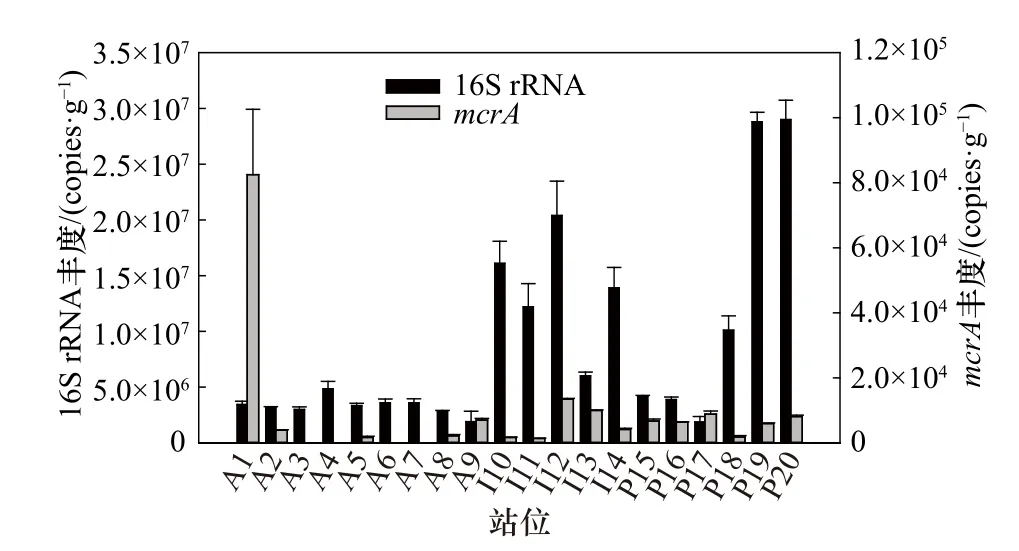
图5 大洋沉积物中的古菌16S rRNA和甲烷代谢古菌mcrA基因的丰度分布Fig. 5 Distribution of abundance of the archaeal 16S rRNA gene and methane metabolic mcrA gene in different marine sediments
大洋沉积物中mcrA基因丰度范围是1.32×103~1.03×105copies/g,平均丰度为1.04×104copies/g。各大洋之间,大西洋平均丰度最高(1.95×104copies/g),太平洋次之(6.30×103copies/g),印度洋最低(6.16×103copies/g),印度洋与太平洋无显著性差异。其中,大西洋各站位丰度具有明显差异,A1显著高于其他站位(p<0.01),因此大西洋是mcrA基因丰度跨度最大的海区。太平洋各站位之间基因丰度差异性相对较小,马里亚纳海沟略高于南海北部海区。马里亚纳海沟沉积物样品由浅及深的基因丰度呈先降后升的趋势(图5)。
4 讨论
4.1 甲烷代谢古菌的群落组成
α多样性指数显示,太平洋在所有海区中最低;大西洋多样性指数跨度最大,这可能是由于样品所采集的平均深度所导致。在太平洋的平均采样深度(4 914 m)远高于大西洋(2 705 m)和印度洋(3 136 m),水深越深,到达沉积物表层可被微生物利用的有机物越少,从而导致群落多样性减少。这一趋势进一步证实了深度是影响微生物多样性的主要因素之一[26]。同时由于有机物通量的减少而导致电子受体(氧、硝酸盐等)消耗速度变慢,使得能够高效利用这些受体的特定甲烷代谢古菌群落在大洋沉积物中占优势。总体而言,所有沉积物样品的均匀度指数最高值为0.35,这表明甲烷代谢古菌不同类群的空间分布差异较大,可能存在着某个或某几个占据大洋沉积物绝对优势的甲烷代谢古菌类群。
本研究中产甲烷菌的甲烷微菌目在大洋表层沉积物中占有绝对优势,平均丰度达到95%以上。已有研究表明产甲烷菌在太平洋东岸以甲烷拟球菌属的Methanococcoides burtonii和Methanococcoides alaskense为主[27-28],在西岸以甲烷微菌目和甲烷八叠球菌目为主[29-30];南海南部陆坡表层沉积物以甲烷杆菌目为主[31]。这表明了多样的产甲烷菌和潜在的甲烷产生途径广泛存在于深海沉积物中[32],该生境相对于热液、冷泉和近岸河口更不易受到到环境因素(如温度、盐度和pH等)的影响,导致大约有10%的有机物被产甲烷菌转化成CH4[33]。此外,不同大洋沉积物中的甲烷代谢古菌群落结构单一。这可能是因为大洋沉积物不具有高甲烷底物的环境特征,且一般营养物质偏低,使得适应此种环境的甲烷代谢古菌的类群组成较为单一。因而与有大量甲烷气体溢出的冷泉区中的类群存在明显不同,形成了源自生境条件的群落差异。
4.2 大洋沉积物古菌的基因丰度
本研究结果表明,大洋沉积物样品中古菌16S rRNA基因平均丰度相较于北冰洋(格陵兰岛东岸)、北大西洋、地中海[34]和南海地区(海马冷泉、西沙海槽、F冷泉)的表层沉积物[35]低1~2个数量级。这可能是因为本研究中的样品采集自寡营养的大洋沉积物,且深度较深所造成的。此外,本研究中马里亚纳海沟的沉积物柱状样中古菌的基因丰度与采样深度呈负相关,这与小笠原海沟(位于马里亚纳海沟北部)的研究结果趋势相一致[36],进一步证明了有机物分布的差异可以影响古菌16S rRNA基因丰度分布。
大洋沉积物中检测到的mcrA基因丰度显著低于南海槽冷泉区[37]、海马冷泉区[13]、日本海冷泉区[38]和冲绳热液区[39]。这可能是因为冷泉区和热液区具有包含甲烷在内的大量气体不断涌出,为周边甲烷代谢古菌提供碳源与能源,促进了mcrA基因丰度的显著增高。
4.3 OSD group在大洋沉积物的分布及近缘类群
OSD group是本研究发现的一种相对丰度占优势的甲烷代谢古菌类群。与NCBI数据库的比对结果显示,其序列与目前已发表的序列最高相似度都低于90%。NCBI数据库中与OSD group相似度较高的序列,除已获得基因组全序列的CP002117来源于近海油田外,其余8个所处的生境均为厌氧环境。CP002117源自人工培养的甲烷盘菌属菌株(Methanoplanus petroleariustype strain)(SEBR 4847T)[40]。该菌株严格厌氧,属于CO2/[H]型产甲烷菌,其原始生境与本研究中的大西洋站位处于同一纬度,距离较近。
本研究显示,OSD group可能广泛分布于大洋沉积物中,在所有样品中其相对丰度均过半。甲烷代谢古菌中单个类群具有如此高占比的现象在冷泉沉积物表层中已被报道过[13],其独特的生境条件造就了如此单一的群落结构。但大洋沉积物并不具备类似冷泉的条件,因此现有研究还不能找到解释此现象的有力证据,该类群在大洋沉积物生境中的生态功能还需进一步探究。
5 结论
(1)因大洋沉积物具有寡营养特征,特别是甲烷底物偏低,其深海表层沉积物中广泛存在结构单一的甲烷代谢古菌群落,以及丰度显著低于其他海洋生境的古菌和甲烷代谢古菌。
(2)甲烷微菌目是大洋表层沉积物中的主要甲烷代谢古菌类群,其中以一簇未知类群(OSD group)占优势;该簇与已知序列均不具有较近亲缘关系,进化地位尚不明晰,还需要进一步研究。

