AA-CYP表氧化酶代谢产物对胰岛β细胞增殖和细胞周期的影响
玉斯日古楞,白兆星,吴贞思,陈彦汝,么宏强
(1.内蒙古农业大学兽医学院,内蒙古 呼和浩特 010011 ; 2. 农业农村部动物疾病临床诊疗技术重点实验室,内蒙古 呼和浩特 010011)
花生四烯酸(Arachidonic acid,AA)是一种人体必需脂肪酸,也是一种多不饱和脂肪酸,是在生物体内分布最广、含量最丰富的一种脂肪酸。在心血管系统中,细胞色素P450(Cytochrome P450,CYP)是代谢AA的主要酶类。AA经过细胞色素P450表氧化酶途径生成环氧二十碳三烯酸(Epoxyeicosatrienoic acids,EETs)和20-羟基二十碳四烯酸(20-hydroeicosatetraenoic acid,20-HETE),这些代谢产物具有较强的生物活性[1-4]。
随着人们生活水平的提高,糖尿病的发病率越来越高,糖尿病所导致的心脑血管系统和肾脏等并发症也明显增多。糖尿病的主要病理生理问题是胰岛素抵抗和胰岛β细胞损伤[5]。研究发现,EETs与糖尿病的发生有密切关系,在防治糖尿病过程中具有重要作用[6]。20-HETE在糖尿病、心血管疾病、肿瘤等疾病的发生发展进程中也具有非常重要的作用[6-8]。有研究表明,11,12-EET和14,15-EET有很强的促进有丝分裂作用,它们可以有效促进肾脏内皮细胞的有丝分裂[9-10]。那么,EETs和20-HETE是否具有促进胰岛β细胞增殖的作用?目前尚无定论。因此,本试验将探讨EETs和20-HETE对胰岛β细胞增殖和细胞周期的影响。
1 材料与方法
1.1 试验材料
1.1.1 细胞来源 胰岛β细胞:MIN6小鼠胰岛β细胞(hz10123),购自上海沪震生物科技有限公司。
1.1.2 主要试剂 PBS(10010023)、青霉素-链霉素(15140122)、DMEM培养基(11995065)、胰酶-EDTA溶液(25200056)和胎牛血清(10270106),均购自Gibco公司;20-HETE、11,12-EET(ab141537)、14,15-EET(ab141538)、LY 294002和PI3-kinase抑制剂(ab120243),均购自Abcam公司;20-Hydroxy(H3023),购自Sigma公司;HRP标记羊抗小鼠二抗(BA1051),购自武汉博士德生物工程有限公司。
1.1.3 主要仪器 流式细胞分析仪,购自Beckman公司;微量移液器,购自Eppendorf公司;二氧化碳(CO2)培养箱(3111)和离心机(MICROCL 17),均购自Thermo公司;生物安全柜(BS-1300IIA2),购自苏州安泰空气技术有限公司;倒置荧光显微镜(CKX41),购自OLYMPUS公司。
1.2 试验方法
1.2.1 细胞培养及传代 MIN6细胞采用胰酶消化、PBS清洗后,加入培养液制成细胞悬液。取适量细胞悬液进行台盼蓝染色,在倒置显微镜下计数活细胞并计算细胞密度。取2×106个细胞,加10 mL新鲜DMEM培养基至10 cm培养皿中,于37 ℃、5% CO2培养箱中培养。待细胞密度达到90%以上时,进行试验,其余细胞冻存备用。
1.2.2 CCK-8试验检测细胞增殖 将细胞接种到96孔板上,每孔的细胞数量调整到约2×104个。培养12 h后将细胞分组处理(表1),即分别加入不同浓度EETs或不同浓度比的20-HETE/EETs(1∶10和1∶20),每组3个重复。在不同时间点(培养12、24 h和48 h)收取细胞样品,采用CCK-8方法检测细胞的增殖情况,测定OD450 nm值,以明确EETs和20-HETE/EETs对β细胞增殖的影响是否具有时间和浓度依赖性。

表1 细胞分组和处理Table 1 Cell grouping and treatment
1.2.3 流式细胞术检测细胞周期 将细胞接种到6孔板上,每孔的细胞数量约3×105个,培养12 h后分组处理细胞(表2)。继续培养12 h后,胰蛋白酶消化、收集细胞,PBS清洗2次,使用预冷的75%酒精4 ℃固定过夜。离心去上清,PBS清洗、重悬,加入终浓度为50 μg/mL的RNase,37 ℃消化30 min后,加入碘化丙啶(PI)染色液避光放置20 min,最后上流式细胞仪检测细胞周期。用CellQuest软件、ModFit软件分析试验结果,统计分析各组细胞周期的分布。

表2 细胞分组和处理Table 2 Cell grouping and treatment
1.2.4 Western blot检测细胞增殖相关信号转导通路 为探索EETs和20-HETE/EETs对胰岛β细胞增殖影响的信号转导机制,采用信号转导通路抑制剂干预处理β细胞增殖(表3),即给予β细胞EETs和20-HETE/EETs刺激的同时,给予PI3K/AKT信号转导通路的抑制剂(LY294002,终浓度为15 mmol/L),孵育24 h后,收集细胞,提取蛋白,BCA法测定蛋白浓度。蛋白变性10 min,按配方配制SDS-PAGE胶,电泳,转PVDF模,室温封闭2 h,加一抗4 ℃孵育过夜;次日加二抗于摇床上室温孵育2 h。加ECL化学发光混合液,曝光显影,使用Image J软件分析蛋白质条带的灰度值,统计分析蛋白表达量。

表3 细胞分组和处理Table 3 Cell grouping and treatment
1.2.5 数据统计处理 应用SPSS 19.0软件进行统计学分析,每个试验重复3次,数据以“平均值±标准差”方式表示,单因素多组之间比较采用One-way ANOVA,之后组间比较采用t检验,以P<0.01表示差异极显著,P<0.05表示差异显著。
2 结果
2.1 对细胞增殖的影响 胰岛β细胞经过传代、计数、分组,用EETs和20-HETE/EETs分别处理,12、24 h和48 h时进行CCK-8检测。结果如图1所示,在12、24 h和48 h时,与空白组(B组)相比较,溶剂组(C组)对胰岛β细胞增殖的影响均不显著(P>0.05),说明溶剂对胰岛β细胞增殖无影响。与空白组(B组)相比较,在12 h和24 h时,浓度为100 nmol/L的14,15-EET(E组)对胰岛β细胞增殖具有极显著促进作用(P<0.01),其中12 h时差异最大(图1A);在48 h时,各组间没有明显差异性(P>0.05)(图1C)。

图1 胰岛β细胞的增殖情况Fig.1 Cell proliferation of pancreatic β cellsA:12 h; B:24 h; C:48 h与空白组(B组)比较,*:P<0.05,**:P<0.01;下同Compared with the blank group(group B),*:P<0.05,**:P<0.01. The same as below
2.2 对细胞周期的影响 流式细胞术检测结果如图2所示,与空白组(A组)比较,浓度为100 nmol/L的11,12-EET处理组(C组)胰岛β细胞中G0/G1期细胞由(51.27±1.48)%减少至(42.57±1.06)%;而S期细胞由(28.81±1.89)%升高至(33.17±1.42)%;G2/M期细胞由(19.92±0.64)%升高至(24.26±0.83)%,两组间均差异显著(P<0.05);浓度为100 nmol/L的14,15-EET处理组(D组)胰岛β细胞中G0/G1期细胞由(51.27±1.48)%减少至(44.92±1.85)%,两组间差异显著(P<0.05);S期细胞由(28.81±1.89)%升高至(29.01±1.87)%,但差异不显著(P>0.05);G2/M期细胞由(19.92±0.64)%升高至(26.07±1.03)%,两组间差异显著(P<0.05)。
2.3 影响细胞增殖的机制 细胞使用不同浓度EETs、20-HETE/EETs和抑制剂LY294002处理后,采集细胞、提取蛋白,采用Western blot检测AKT磷酸化水平和PI3K活化状况。结果如图3所示,与空白组(A组)相比较,EETs处理组(C组和D组)的PI3K表达水平显著上升(P<0.05),当20-HETE/EETs 联合处理(E组和F组)时,PI3K表达水平显著降低(P<0.05);与未加LY294002组(C组和D组)相比较,LY294002处理组(H组和I组)极显著抑制了PI3K表达水平(P<0.01)。PI3K蛋白表达量在11,12-EET组(C组)和14,15-EET组(D组)之间无明显差异(P>0.05)。
3 讨论
糖尿病的发病率逐年增多,尤其是2型糖尿病的患病率逐渐提高,成为继肿瘤、心脑血管疾病之后的又一个严重危害健康的慢性非传染性疾病[11],其主要病理生理特点是胰岛β细胞功能衰竭[11-12]。因此,β细胞损伤和功能障碍是糖尿病发生发展的主要原因。也就是说,避免β细胞损失和功能失调是改善糖尿病发展的有效方法[13-14]。研究证明,EETs不仅可以促进大鼠胰岛素的释放,还可以促进肾脏内皮细胞增殖和再生[9,15-16]。此外,研究还发现,11,12-EET和14,15-EET有很强的促进有丝分裂作用,可有效促进肾脏内皮细胞的有丝分裂[9-10]。20-HETE能够调控体内不同的生理作用,在糖尿病、心血管疾病和肿瘤等疾病的进程中也具有重要作用[5]。研究发现,在糖尿病肾病大鼠的肾小球中,CYP4A的表达和20-HETE的产生会明显减少,并且糖尿病大鼠的肾脏受损时,其20-HETE含量会明显减少[6]。可见,EETs和20-HETE均与糖尿病的发生有密切联系,但对它们的具体作用及其机制尚未深入研究。EETs和20-HETE是否可以促进胰岛β细胞的增殖,是否可以保护胰岛β细胞,使其免受损伤或功能失调,从而改善糖尿病的发生发展?目前尚未定论。

图2 EETs和20-HETE对胰岛β细胞细胞周期的影响Fig.2 Effect of EETs and 20-HETE on the cell cycle of pancreatic β cellsA:空白组(A组)流式细胞检测细胞DNA直方图; B:11,12-EET组(C组)流式细胞检测细胞DNA直方图; C:EETs和20-HETE作用后胰岛β细胞细胞周期的变化A:DNA histogram in control group (group A) detected by flow cytometry; B:DNA histogram in 11,12-EET group (group C) detected by flow cytometry; C:Effects of EETs and 20-HETE on cell cycle of pancreatic β cells
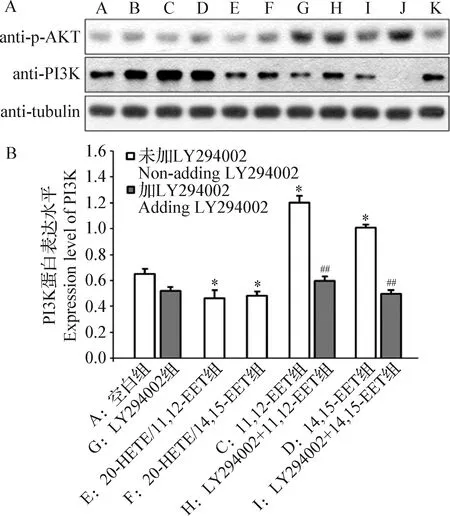
图3 EETs、20-HETE/EETs和LY294002处理后PI3K/AKT蛋白的表达水平Fig.3 Expression levels of PI3K/AKT protein after EETs,20-HETE/EETs and LY294002 treatmentA:Western blot 结果; B:PI3K蛋白表达水平的比较[与空白组(A组)比较,*:P<0.05; 与未加LY294002组(C组和D组)比较,#:P<0.05,##: P<0.01]A:Western blot results; B:Comparison of PI3K protein expression levels[Compared with the blank group (group A),*:P<0.05; Compared with the non-adding LY294002 groups (group C and D),#:P<0.05,##:P<0.01]
因此,本试验通过CCK-8方法检测EETs和20-HETE对胰岛β细胞增殖的影响。试验结果显示,在干预12 h和24 h时,浓度为100 nmol/L的14,15-EET对胰岛β细胞的增殖具有极显著促进作用,在12 h时其促进作用最显著。但是,以不同比例联合使用EETs和20-HETE时,对胰岛β细胞的增殖无显著影响。此结果表明,在一定范围内,14,15-EET的作用具有时间和浓度依赖性,这与Xu等[6]的研究结果一致。综上所述,使用14,15-EET干预胰岛β细胞12 h时,细胞增殖可以达到高峰,且其促增殖的最佳浓度为100 nmol/L。但联合使用EETs和20-HETE时,14,15-EET未能显示出上述促增殖的作用。
为进一步探讨EETs和20-HETE影响胰岛β细胞增殖的可能机制,本试验还应用流式细胞术和Western blot方法分别观察细胞周期的变化和PI3K/AKT信号转导通路的激活情况。细胞周期的G1期为DNA合成前期,此期为过渡至S期做准备;S期为DNA合成期,可反映细胞的分裂活力,增殖旺盛的细胞处于S期的比例较高;G2期为DNA合成后期,M期为有丝分裂期,(S+G2M)%为增殖指数,代表了细胞中增殖细胞的数量,在一定程度上可反映细胞的增殖状态。本试验的流式细胞术结果显示,11,12-EET和14,15-EET处理组(C组和D组)的G0/G1期细胞减少,S期与G2/M期细胞增多,说明EETs可能促使静止态的G1期细胞活跃,并向S期转变,使DNA合成量增加,从而促进细胞的增殖。此试验结果进一步验证EETs能够使胰岛β细胞处于增殖状态。Western blot试验结果显示,与空白组(A组)相比较,EETs处理组(C组和D组)的PI3K表达水平显著上升,但20-HETE和EETs 联合使用时(E组和F组),PI3K表达水平反而显著降低;与未加LY294002组(C组和D组)相比较,当使用PI3K/AKT信号转导通路抑制剂(LY294002)干预11,12-EET和14,15-EET处理组细胞后,显著抑制了PI3K活化状况。此结果提示,EETs能够促进胰岛β细胞的增殖,其分子机制可能是EETs激活了PI3K/AKT信号转导通路,与既往研究结论[5]相一致;同时,本试验结果也进一步说明20-HETE和EETs的联合使用对胰岛β细胞的增殖没有促进作用。
综上所述,本试验证实EETs可促进小鼠胰岛β细胞的增殖(14,15-EET的作用更加显著),其机制可能是EETs激活了PI3K/AKT信号转导通路,使胰岛β细胞处于增殖状态,且其促进作用具有时间和浓度依赖性。但是,20-HETE和EETs的联合使用,未显示出促胰岛β细胞增殖的作用,其机制有待于进一步深入研究。

