猪δ冠状病毒抗体间接ELISA检测方法的建立
尚再卓,于瑞明,张莉萍,王永录,潘 丽,杜晓华,刘 霞*,刘新生*
(1.甘肃农业大学 生命科学技术学院,甘肃 兰州 730070;2.中国农业科学院 兰州兽医研究所,甘肃 兰州 730030;3.甘肃农业大学 动物医学院,甘肃 兰州 730070)
猪δ冠状病毒(porcine deltacoronavirus,PDCoV)是一种新型猪肠道冠状病毒,主要引起哺乳仔猪呕吐、腹泻、脱水和死亡。2012年,WOO等[1]在对香港地区动物样品进行冠状病毒的检测中发现了PDCoV。DONG等[2]分析了2004-2014年间我国多个省份规模化猪场的215份粪便样品,首次证实我国内地猪场中PDCoV的存在。2014年,PDCoV在美国俄亥俄州、爱荷华州、伊利诺伊州及明尼苏达州等多地的猪场暴发[3-5],随后在腹泻仔猪肠道内容物和LLC-PK细胞中首次分离出PDCoV OH-FD22株[6]。随后,加拿大、韩国、泰国、老挝、越南、日本等许多国家报道了PDCoV感染的存在[7-12]。近年来,我国多个省份均有PDCoV疫情的相关报道,并呈逐年增长的趋势,且PDCoV与其他猪肠道病原共感染的现象也较为普遍[13],给我国养猪业造成了严重的经济损失[14]。目前,针对此病尚无特效治疗药物及疫苗免疫方法,也无市售商品化PDCoV特异性抗体ELISA检测试剂盒。因此,建立一种速度快、灵敏度高、特异性强的ELISA方法,对PDCoV的临床诊断及免疫防控具有重要意义。
PDCoV是单股正链RNA病毒,属于冠状病毒科、δ冠状病毒属,病毒颗粒呈球形或多型性,病毒直径约为100 nm,有囊膜和许多末端凸起的纤突,基因组大小为25.4 kb,是目前发现最小的冠状病毒成员[15]。与其他冠状病毒一样,PDCoV也含有4种主要结构蛋白:刺突蛋白(S)、包膜蛋白(E)、膜蛋白(M)和核衣壳蛋白(N)。其中 S蛋白在病毒与细胞受体结合,介导病毒入侵和感染中发挥重要作用[16];同时,S蛋白也是病毒诱导机体产生中和抗体的主要抗原[17]。SHANG等[18]用冷冻电镜技术解析了S蛋白的三维结构与功能,结果显示S蛋白由非共价连接的S1、S2两部分组成,S1包含 N末端受体结构域(NTD)和C末端受体结构域(CTD),而S1-CTD区域能够与宿主表面的未识别受体结合,推测该段包含主要RBD(受体结合区域)。因此,截短的S1-CTD蛋白可以作为建立ELISA检测方法的理想抗原。
PDCoV是一种肠道病原体,主要通过呼吸道和消化道进行传播,从而引起黏膜处上皮细胞的病变[15]。SIgA(分泌性IgA)是肠黏膜的主要免疫球蛋白,是维持肠道黏膜稳态的第一道防线,对肠道内的共生菌及入侵病原体具有抵御作用[19]。有研究表明,血清特异性IgA 抗体水平与局部黏膜免疫水平呈正相关,可在病毒感染或接种疫苗的猪血清和乳汁中检测到[20]。目前,猪传染性胃肠炎[21]、猪流行性腹泻[22]、猪繁殖与呼吸综合征[23]等传染病通过黏膜免疫均取得了很好的免疫保护效果,黏膜免疫主要效应因子SIgA已成为检测和判断黏膜免疫抗病毒水平的重要指标[24]。然而,现有的ELISA检测方法主要是检测血清中特异性IgG抗体,对PDCoV黏膜免疫水平的检测方法和评判标准未见报道。因此,本试验以大肠杆菌表达系统表达的PDCoV S1-CTD蛋白作为包被抗原,建立了能够检测血清PDCoV特异性IgA抗体的间接ELISA方法,为临床上监测母猪和仔猪血清中IgA抗体水平及评价疫苗免疫效果提供了新的方法。
1 材料与方法
1.1 病毒、血清及主要试剂PDCoV阳性血清采自本实验室攻毒7 d的仔猪,阴性血清采自甘肃临洮猪场未免疫母猪;猪流行性腹泻病毒(PEDV)、猪嵴病病毒(PKV)、口蹄疫病毒(FMDV)及猪瘟病毒(CSFV)的阳性血清由本实验室保存;E.coliDH5α感受态细胞、BL21(DE3)感受态细胞、Premix TaqTM酶购自宝日医生物技术(北京)有限公司;T4DNA连接酶、NheⅠ限制性内切酶和XhoⅠ限制性内切酶购自New England Biolabs(NEB)公司;96孔酶标板、山羊抗猪IgA-HRP购自北京索莱宝生物科技有限公司;AxyPrepTMDNA 凝胶回收试剂盒、AxyPrepTMPlasmid Miniprep Kit购自Axygen公司;酶标仪购自美国Bio-Rad Laboratories公司;血清稀释液、百迪泰酶标抗体稳定剂、单组份TMB底物显色液及终止液购自济南百迪泰生物科技有限公司。
1.2 引物设计截取优化后S基因中的抗原表位区CTD片段,利用SnapGene软件设计特异性引物,在上、下游引物中分别引入限制性内切酶NheⅠ和XhoⅠ(引物处下划线序列),S1-CTD-F:5′-CCGCTAGCCAACGTACTATTGTCACACTAC-C-3′;S1-CTD-R:5′-GGCTCGAGGCAGACATCA-GTGATTACACTAG-3′。引物由上海生工生物工程股份有限公司合成。
1.3S1-CTD基因原核表达载体的构建及鉴定以S基因为模板,S1-CTD-F、S1-CTD-R为引物,扩增S1-CTD基因;目的基因于10 g/L琼脂糖凝胶中电泳检测后,按胶回收试剂盒的说明书进行纯化,并将纯化产物及原核表达载体pET24a(+)用限制性内切酶NheⅠ和XhoⅠ酶切,酶切产物鉴定正确后胶回收纯化。利用T4DNA连接酶对酶切产物进行16℃过夜连接,连接后转化至E.coliDH5α感受态细胞,经双酶切及测序筛选出阳性克隆,命名为pET24a-S1-CTD。
1.4 重组蛋白S1-CTD的表达鉴定及纯化将重组质粒pET24a-S1-CTD转化至BL21(DE3)感受态细胞中,于37℃摇床培养至对数生长期,用IPTG诱导4~5 h,同时设置pET24a(+)空载对照组。8 000 r/min 离心10 min收集菌体,加入适量 PBS 重悬,超声破碎菌体后,收集上清及沉淀并进行 SDS-PAGE电泳鉴定重组蛋白S1-CTD的表达。确定目的蛋白表达后利用Ni柱纯化,以1∶500稀释的PDCoV阳性血清为一抗,1∶5 000稀释的山羊抗猪IgA-HRP为二抗进行Western blot鉴定;最后,利用试剂盒测定蛋白质量浓度,分装后-80℃保存。
1.5 间接ELISA反应条件的优化采用方阵滴定法分别对重组蛋白S1-CTD包被质量浓度(32,16,8,4,2,1 mg/L);包被条件(37℃ 2 h、37℃ 1 h及4℃过夜);封闭液(1%BSA、5%脱脂乳和百迪泰酶标抗体稳定剂);封闭条件(37℃ 30 min,37℃ 1 h和37℃ 2 h);血清稀释度(1∶10,1∶20,1∶40,1∶80,1∶160,1∶320);血清孵育时间(20,40,60 min);酶标二抗稀释度(1∶2 500,1∶5 000,1∶10 000,1∶20 000);酶标二抗孵育时间(15,30,45,60 min)和底物显色时间(5,10,15,20 min)进行优化。按常规 ELISA 方法操作,测定记录D450 nm值,阳性血清与阴性血清的D450 nm比值(P/N)最大时,确定为该反应的最佳条件。
1.6 临界值的确定确定检测条件后,检测已知状态的血清样品,根据各样品和阴、阳性对照的D450 nm值,计算样品S/P值[S/P=(样品D450 nm-阴性对照D450 nm)/(阳性对照D450 nm-阴性对照D450 nm)]。使用MedCalC软件绘制血清检测特征曲线(receiver operating characteristic,ROC),对统计数据进行图像化分析,选择正确率较高的临界值确定为该方法的临床检测临界值。
1.7 特异性试验使用优化好的ELISA方法,检测PEDV、PKV、FMDV和CSFV的标准阳性血清,并设立PDCoV阴阳性血清对照,每份样品设3孔重复。利用酶标仪检测D450 nm值,依据阴阳临界值,判断该方法与其他猪常见病毒病的病原有无交叉反应。
1.8 重复性试验选取5份PDCoV阳性样品,分别在3块同一批次包被的抗原板上和3块不同批次包被的抗原板上检测,计算批内和批间变异系数,评价该方法的重复性。
1.9 敏感性试验使用血清稀释液对4份PDCoV阳性血清进行倍比稀释,利用建立好的间接ELISA方法进行检测,并设阴阳性血清对照,测定D450 nm值,计算出S/P值,分析该方法的敏感性。
1.10 间接ELISA检测方法的初步应用应用本研究建立的检测血清中PDCoV特异IgA抗体的间接ELISA方法,对本实验室保存的60份阳性血清和40份阴性血清进行检测,并设阴阳性血清对照,测定D450 nm值,计算出S/P值,以验证间接ELISA方法的检测结果是否可靠。
2 结果
2.1S1-CTD基因原核表达载体的鉴定通过PCR扩增S1-CTD基因,得到与预期大小相符的目的条带,为422 bp(图1)。使用T4DNA连接酶将目的基因与载体连接后转化至E.coliDH5α感受态细胞,提取质粒,经过限制性内切酶(NheⅠ、XhoⅠ)双酶切鉴定为阳性(图2),测序结果比对正确,说明原核表达载体构建成功。

M.DNA 分子质量标准;1.PDCoV S1-CTD基因;2.pET24a载体

M.DNA 分子质量标准;1~3.重组质粒pET24a-S1-CTD双酶切产物
2.2 重组蛋白S1-CTD的表达鉴定及纯化将pET24a-S1-CTD重组质粒转化至BL21(DE3)感受态细胞中,经IPTG 37℃诱导5 h后,SDS-PAGE鉴定发现S1-CTD蛋白以包涵体形式表达,约19 kDa。对菌液超声处理,8 mol/L Urea溶解包涵体,使用Ni柱纯化,得到较纯的目的蛋白(图3),质量浓度为0.39 g/L。Western blot结果显示S1-CTD蛋白能与PDCoV阳性血清发生特异性反应(图4)。

A.S1-CTD重组蛋白诱导表达;B.S1-CTD重组蛋白的纯化。M.蛋白分子质量标准;A1.诱导的pET24a-S1-CTD;A2.未诱导的pET24a-S1-CTD;A3.诱导的pET24a(+)空载体;A4.诱导的pET24a-S1-CTD上清;A5.诱导的pET24a-S1-CTD沉淀;A6.诱导的pET24a(+)空载上清;A7.诱导的pET24a(+)空载沉淀;B1.蛋白纯化;B2.蛋白透析

M.蛋白分子质量标准;1.PDCoV阳性血清;2.PDCoV阴性血清;←.主要抗原成分,含有二硫键结构的蛋白;◀.透析不彻底,不含二硫键结构的蛋白
2.3 间接ELISA反应条件的优化通过用方阵滴定法优化,得到该ELISA方法的最优反应条件。结果显示(表1,2,3),抗原包被最佳质量浓度为8 mg/L,血清最佳稀释度为1∶10;最佳包被条件为37℃ 1 h;最适封闭液为百迪泰酶标抗体稳定剂;最佳封闭条件为37℃ 1 h;血清最佳反应时间为37℃ 40 min;酶标抗体最佳稀释度为1∶5 000,最佳反应时间为37℃ 45 min;TMB底物溶液最佳显色时间为37℃ 10 min。
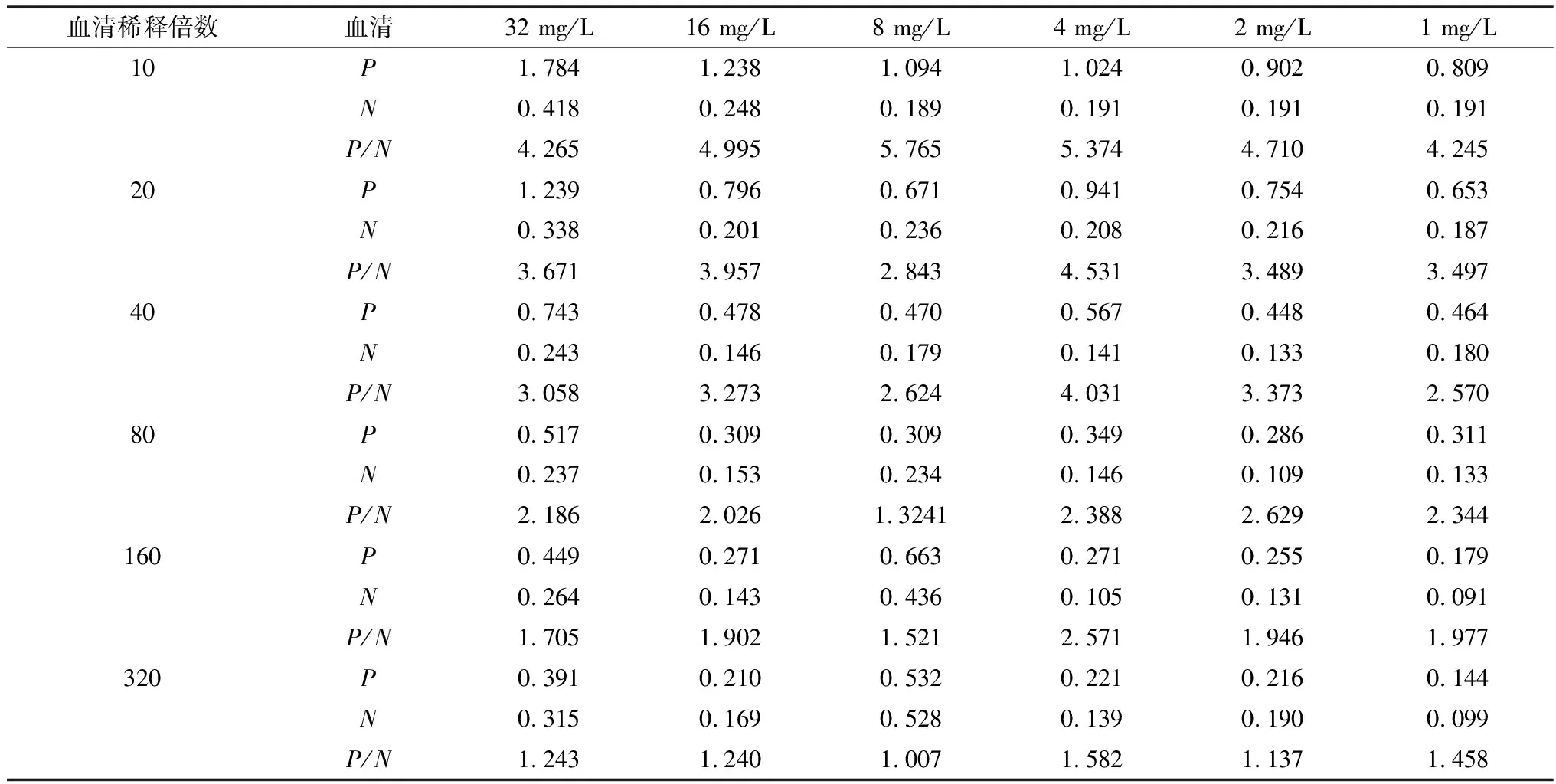
表1 抗原包被质量浓度及血清稀释倍数的优化
2.4 临界值的确定确定间接ELISA反应条件之后,用该方法检测PDCoV 24份阴性血清和24份阳性血清,测定每份样品D450 nm值,计算S/P值。统计数据,并绘制ROC曲线进行数据分析。结果显示,当S/P≥ 0.489时为100%阳性,S/P<0.489时为100%阴性(图5)。

A.血清检测数据统计;B.血清检测ROC曲线确定临界值
2.5 特异性试验取PEDV、PKV、FMDV及CSFV等4种常见猪病毒病的标准阳性血清,用本研究建立的间接ELISA进行特异性检测,每份血清设3孔重复。结果显示,4种标准阳性血清S/P值均小于0.489(图6),说明本研究建立的PDCoV间接ELISA抗体检测方法均具有良好的特异性。

表2 包被条件、封闭液、封闭时间及血清孵育时间的优化

表3 酶标二抗稀释度、酶标二抗孵育时间及底物反应时间的优化

图6 特异性试验结果
2.6 重复性试验选取5份阳性血清,使用建立的方法分别在同一批包被的检测板上和不同批次包被的检测板上进行3次重复检测。结果显示,批内变异系数为2.09%~3.24%,批间变异系数为3.53%~6.10%(表4)。重复检测变异系数均低于10%,说明该方法具有良好的重复性。

表4 重复性试验
2.7 敏感性试验选取4份PDCoV阳性血清,用血清稀释液从1∶10开始进行倍比稀释,利用建立好的间接ELISA方法进行检测,分析此方法的敏感性。结果显示,在血清1∶40稀释时,4份血清全为阳性;1∶80稀释时,4份血清全为阴性(图7)。结果表明,该方法具有良好的敏感性。

图7 敏感性试验结果
2.8 间接ELISA检测方法的初步应用应用本研究建立的检测血清中PDCoV特异IgA抗体的间接ELISA方法,对本实验室保存的60份阳性血清和40份阴性血清进行检测,测定D450 nm值,计算S/P值。结果显示,60份阳性血清检测结果均为阳性,符合率为100%(60/60),40份阴性血清中,38份检测为阴性,2份为阳性,符合率为95%(38/40),总符合率为98%。结果表明,本试验建立的间接ELISA方法的检测结果准确、可靠,具有临床应用价值。
3 讨论
PDCoV是一种新发现的猪肠道病毒,具有传播速度快、病死率高的特点,尤其新生仔猪病死率高达80%,如不能得到及时有效的控制,会对养殖业带来巨大的经济损失。由于PDCoV与PEDV、TGEV等其他猪肠道病毒存在交叉感染,引起的临床症状也极其相似,因此对该病的诊断主要依靠实验室检测[14]。间接ELISA检测方法具有灵敏度高、特异性强、简单快速等优点,被广泛用于临床样品检查和血清流行病学调查。
有研究表明,仔猪在感染PDCoV后 14 d,在血清中能够同时检测到特异性抗体IgG和IgA,此后特异性抗体滴度逐渐增加并保持较高水平,直至猪从临床疾病完全恢复[25]。黏膜免疫在病毒性腹泻的免疫机制中起着关键的作用,黏膜处分泌的SIgA抗体能有效阻止病原体的入侵,是预防仔猪肠道传染病的有效途径[26]。目前,国内很多学者基于M、N蛋白建立了检测特异IgG抗体的间接ELISA方法[27-30]。但是,MA等[31]发现PEDV和PDCoV N蛋白上保守或相似的表位可能导致2种病毒的抗原产生双向交叉反应;GIMENEZ-LIROLA等[32]用以PEDV M蛋白作为包被抗原建立的ELISA方法对PDCoV阳性血清进行抗体检测时,出现了阳性结果,推测两者之间可能存在共同的抗原表位;因此,M、N蛋白并不是建立血清学检测方法的最佳抗原。PDCoV S蛋白的S1区域含有多个诱导机体产生中和抗体的主要抗原受体结构域,是制备抗体检测ELISA试剂盒良好的候选蛋白。THACHIL等[33]开发了基于PDCoV S1蛋白的抗IgG间接ELISA试剂盒,是全世界首个检测PDCoV的ELISA方法。LU等[34]以HEK-293T细胞表达的PDCoV S1蛋白作为包被抗原建立了检测母乳中特异性IgA抗体的间接ELISA方法,批内、批间变异系数为3.12%~8.47%和1.81%~14.26%;与其相比,本试验建立的检测血清中特异性IgA抗体的间接ELISA方法,批内、批间变异系数为2.09%~3.24%和3.53%~6.10%,具有更好的重复性。王经纬等[35]以昆虫杆状病毒表达系统表达的S1蛋白为包被抗原建立了ELISA检测方法,但真核表达成本高、纯化困难、周期长,不适于开发试剂盒。据报道,S蛋白基因在冠状病毒成员中具有高度的变异性,可能导致基于S蛋白建立的ELISA方法的重复性和敏感性降低[36]。瞿欢等[37]利用大肠杆菌表达系统表达S1-CTD基因(832~1 848 bp)并建立了检测IgG抗体的间接ELISA方法,其截短的S1-CTD基因包含部分S2区域,而本研究截取了S1-CTD抗原表位的核心区(877~1 299 bp),能够有效地减少S基因的变异点,提高间接ELISA方法的特异性和重复性;另外瞿欢等[37]建立的 PDCoV ELISA检测方法是用来检测血清中特异性IgG抗体的,而本研究建立的是对PDCoV防制更具有临床实践意义的IgA抗体ELISA检测方法。
本试验选取的S1-CTD基因序列中含有7个半胱氨酸残基,在天然的蛋白结构中可形成3对分子内二硫键;由于研究选择原核表达系统表达该目的蛋白,且以包涵体形式表达,因此表达的蛋白在未透析前不存在二硫键结构。为了使其更接近天然蛋白结构,在透析液中加入了氧化还原对(还原性谷胱甘肽/氧化型谷胱甘肽),使其形成二硫键结构。SDS-PAGE结果显示,透析后蛋白相对分子质量稍大于透析前蛋白相对分子质量,证明本研究中透析后的蛋白存在分子内二硫键,更接近于天然蛋白结构。在Western blot鉴定中,样品选用透析后的重组蛋白S1-CTD,由于透析可能存在不彻底,因此图中显示为2条带,稍大的为主要抗原成分,存在二硫键结构的蛋白,稍小的为不存在二硫键结构的蛋白(或存在部分二硫键)。
综上,本试验成功建立了检测血清中PDCoV特异性IgA抗体的间接ELISA方法,通过反应条件优化,确定抗原最佳包被质量浓度为8 mg/L、37℃包被 1 h;最佳封闭条件为百迪泰酶标抗体稳定剂37℃封闭 1 h;血清最佳反应条件为1∶10稀释,37℃孵育 40 min;酶标抗体最佳反应条件为1∶5 000 稀释,37℃ 孵育45 min;TMB底物溶液最佳显色时间为37℃ 10 min。结果表明,该方法检测速度快,具有良好的特异性、重复性和敏感性,为临床上PDCoV的诊断、疫苗免疫水平的监测及研究提供了新的技术方法,为进一步开发临床检测试剂盒奠定了基础。

