基于石墨烯偏振吸收光学传感的心血管疾病标志物的定量检测
李凌宇, 齐 昊, 高晓光*, 张校亮, 李晓春
(1.太原理工大学生物医学工程学院,山西太原 030024;2.山西医科大学第一医院,山西太原 030001)
目前,我国现有心血管疾病患者约3.3亿,远高于肿瘤及其它种类疾病[1,2]。研究表明,炎症是导致心血管疾病的主要因素之一,炎症标志物的定量检测对心血管疾病的早期诊断及治疗具有重要意义[3,4]。超敏C反应蛋白(hypersensitive C Reaction Protein,hs-CRP)是存在于人血浆中的一项能反映机体炎症状态的指标。研究显示,成人体内hs-CRP大于3 μg/mL即表示存在心血管疾病风险[5]。血清淀粉样蛋白A(Serum Amyloid A,SAA)是一类由肝细胞合成,能反映机体感染情况的指标。研究表明,SAA浓度与心血管疾病及其并发症的严重程度相关,并被用于预测冠心病患者的死亡率[6]。综上,hs-CRP和SAA双重指标对心血管疾病的早期诊断和风险评估具有重要意义。
目前,检测CRP和SAA的方法主要有免疫层析法、酶联免疫吸附测定法(Enzyme Linked Immunosorbent Assay,ELISA)、化学发光法等。2012年,Timucin等人提出了一种基于抗体阵列的免疫传感器,利用酶联免疫吸附的原理,实现了对SAA的快速定量检测[7]。2020年,Bravin等人提出了一种基于荧光共振能量转移的免疫荧光传感器,实现了对CRP的定量检测[8]。2021年,Zhao等人提出了一种基于多孔有机框架材料Cd-MOF-74的免疫传感器,通过将强导电性的金纳米颗粒/氮化碳材料作为基底,采用差分脉冲伏安法检测Cd-MOF-74中Cd2+的信号,实现了对CRP的高灵敏度定量检测[9]。以上方法基本都能实现对CRP和SAA的快速定量检测,但存在需要对生物分子进行标记、易受外界因素干扰和重现性差等缺点。因此,快速、免标记、高灵敏度和抗干扰能力强的检测方法已经成为研究热点。
石墨烯凭借其优异的光学、电学和力学特性在材料、能源、生物医学和药物传递等领域有着广泛应用[10]。Ye等人发现在全反射条件下,不同厚度的石墨烯对s偏振光的吸收都远大于p偏振光[11]。Xing等人搭建了基于石墨烯偏振吸收的折射率传感装置,用于对单个癌细胞的检测[12]。Jiang等人通过在石墨烯表面修饰抗体,实现了对兔IgG的高灵敏度检测[13]。此外,石墨烯还被用于气体传感领域[14,15]。在本研究中,我们发展了基于石墨烯偏振吸收性质的新型光学传感技术,引入锁相放大系统来消除环境光等外界因素的干扰,实现了对心血管疾病标志物hs-CRP和SAA的高灵敏度定量检测,为心血管疾病的早期诊断提供了新的方法。
1 实验部分
1.1 主要仪器与试剂
Edge Dimension原子力显微镜(Bruker Corporation,德国),inViaTMQontor®共焦显微拉曼光谱仪(Renishaw,英国),JSM-7900F热场发射扫描电子显微镜(JEOL,日本),SR865A锁相放大器(Stanford Research,美国),ZEPTO-W6氧等离子刻蚀机(上海尔迪仪器科技有限公司),KQ-400DE数控超声波清洗机(江苏昆山市超声仪器有限公司),PSD Series紫外臭氧清洗机(Novascan Technologies,美国),TKA-Genpure UV超纯水系统(Thermo Fisher Scientific,美国),KW-4A旋涂仪(Kemet Technology,美国),MultiskanTMFC酶标仪(Thermo Fisher Scientific,美国)。
氧化石墨烯(GO,昂星新型碳材料常州有限公司),聚二甲基硅氧烷(PDMS,Dow Corporate,美国),磷酸盐缓冲溶液(PBS,北京中杉金桥生物技术有限公司),兔免疫球蛋白G(rabbit IgG)、山羊抗兔免疫球蛋白G(goat anti rabbit IgG)、牛免疫球蛋白M(bovine IgM)、重组人C反应蛋白(recombinant human CRP)、C反应蛋白抗体(anti-CRP)、重组人血清淀粉样蛋白A1(recombinant human SAA1)和血清淀粉样蛋白A1抗体(anti-SAA1)购自北京博奥森生物技术有限公司。人超敏C反应蛋白(hs-CRP)ELISA试剂盒和人血清淀粉样蛋白A1(SAA1)ELISA试剂盒购自上海纪宁实业有限公司。牛血清白蛋白(BSA)、甘氨酸、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC,0.4 mol/L)和N-羟基丁二酰亚胺(NHS,0.1 mol/L)购自阿拉丁试剂(上海)有限公司。

图1 光学传感系统示意图Fig.1 Schematic diagram of optical sensing systema:helium-neon laser,b:polarizer,c:1/2 wave plate,d:chopper,e:sensor chip,f:diaphragm,g:Wollaston prism,h:balanced detector,i:lock-in amplifier,j:computer.
1.2 实验装置
如图1所示,波长为632.8 nm的激光先后经过偏振片和1/2波片成为偏振方向可调的线偏振光。之后,依次通过透镜、斩波器和反射镜以全反射角从棱镜入射与石墨烯发生相互作用。传感芯片上微流通道的两端引出毛细塑料管,毛细塑料管连接注射器,由恒流注射泵驱动实现加样。反射光经过反射镜、光阑和渥拉斯顿棱镜,产生s偏振光和p偏振光。两束光的光强差由平衡探测器采集,产生电压信号,信号经锁相放大器降噪和放大,由计算机专用软件采集并处理。
1.3 芯片的制备
芯片的制备主要由三部分组成。(1)还原氧化石墨烯(RGO)的制备:配制浓度为5 mg/mL的GO溶液,将GO溶液均匀地旋涂在经亲水处理的石英片上,放入管式炉,在95%Ar/5%H2气氛中以800 ℃高温还原,制备得到RGO,RGO通过范德华力结合在石英片表面。(2)微流通道的制备:将PDMS的预聚物A和交联剂B以质量比10∶1混合并搅匀,放入真空干燥箱中排出因搅拌产生的气泡,随后倒入预先制备好的模板上,在75 ℃下加热2 h,使其完全固化。将固化的PDMS取下,在通道的两端打孔完成制备。微流通道的尺寸为10 mm×2 mm×1.2 mm。(3)RGO与PDMS的键合:RGO和PDMS用紫外臭氧清洗机处理15 min,然后立即把RGO和PDMS贴合在一起,75 ℃下加热3 h,完成传感芯片的制备。实验中,使用恒流注射泵将微流通道内注满待测溶液进行检测,检测过程仅需要24 μL待测溶液。
1.4 RGO的表面活化与修饰
实验中需要对RGO的表面进行活化,以实现后续抗体在RGO表面的固定。首先,向微流通道中依次注入PBS、EDC/NHS混合溶液,用来活化RGO表面的含氧官能团。30 min后,再注入PBS,冲洗3 min。然后注入抗体溶液(山羊抗兔IgG或anti-CRP或anti-SAA1,250 μg/mL),抗体以共价结合的方式固定在RGO表面。再注入封闭液BSA(10 mg/mL),阻断RGO表面的非特异性结合。最后,注入PBS清洗微流通道,以PBS的信号作为基线。在整个过程中,恒流注射泵提供的流速为80 μL/min。
1.5 抗原的检测
首先,用PBS配制不同浓度的兔IgG,将其注入RGO表面固定有山羊抗兔IgG的传感芯片中。抗原抗体发生特异性结合,此时可以观察到信号变化,待信号稳定后,注入PBS冲洗掉多余的抗原。再注入甘氨酸(0.01 mol/L,pH=2),使抗原从抗体上解离。最后注入PBS冲洗,信号回到基线。同样地,用PBS配制不同浓度的hs-CRP和SAA1,将它们分别注入RGO表面固定有对应抗体的传感芯片中,用计算机上的数据采集软件记录整个过程中的信号变化,其中每个浓度重复检测3次。
2 结果与讨论
2.1 检测原理
图2为RGO表面抗原抗体特异性结合的示意图。如图2A所示,首先要对RGO表面进行活化,这有利于后续抗体的固定。图2B为抗体通过氨基和羧基的共价结合固定在RGO表面。图2C为当抗原注入微流通道时,抗原和RGO表面的抗体发生特异性结合的示意图。这种特异性结合会引起RGO表面折射率的变化,导致平衡探测器检测到的p偏振光和s偏振光的光强差发生变化,从而实现对抗原的定量检测。
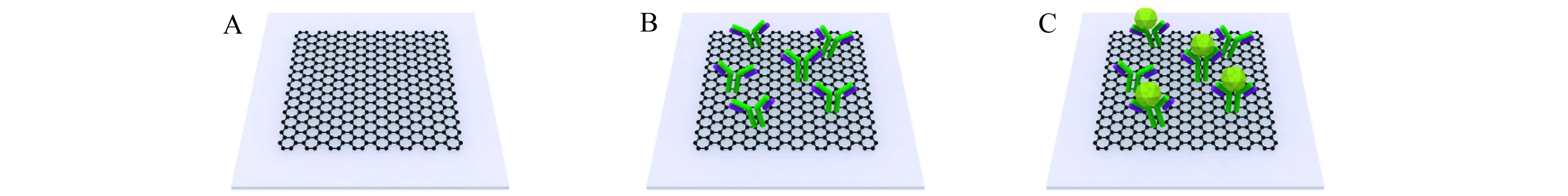
图2 (A)石英片上RGO的示意图;(B)RGO表面固定有抗体的示意图;(C)RGO表面抗原抗体结合的示意图Fig.2 (A)Schematic diagram of RGO on a quartz plate;(B)Schematic diagram of the antibody immobilized on the surface of RGO;(C)Schematic diagram of the binding of antigen and antibody on the RGO surface
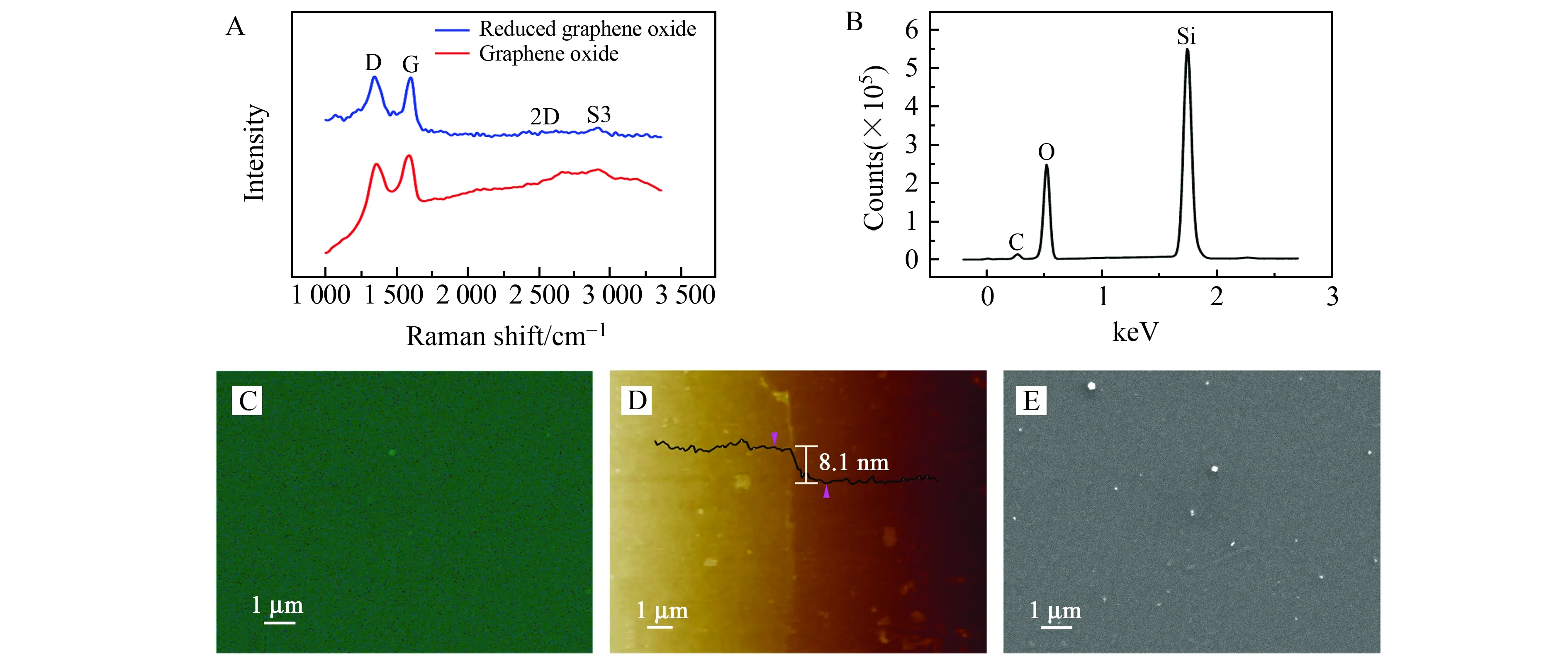
图3 (A)GO和RGO的拉曼光谱;(B~E)分别为RGO的EDS元素分析结果、EDS图、AFM图和SEM图Fig.3 (A)Raman spectra of GO and RGO;(B)EDS elemental analysis results,(C)EDS image,(D)AFM image and (E)SEM image of RGO
2.2 RGO的表征分析
实验中用到的RGO是通过高温还原GO的方法制备的。图3A为GO和RGO的拉曼光谱图。图中RGO样品ID/IG(拉曼光谱图中D峰强度与G峰强度的比值)比GO大,证明高温还原过程中形成了品质较高的石墨烯[16,17]。图3B和图3C为RGO样品的能谱仪(EDS)元素分析结果。其中Si元素和O元素来源于SiO2基底,C元素来源于RGO。从EDS的结果可以看出,RGO的制备过程没有杂质引入。此外,图3D为RGO的原子力显微镜(AFM)图,可以看出实验中用到的RGO厚度在8 nm左右,其厚度可以通过改变GO溶液的浓度和旋涂仪的转速来调节。图3E为RGO样品的扫描电子显微镜(SEM)图。从图中可以看出,RGO表面除了些许碎片外,整个样品十分平整,形成了均匀的薄膜。
2.3 传感系统的灵敏度和折射率分辨率
运用多层介质膜传输理论可以定量计算RGO对光的反射、吸收和透射。图4A为不同厚度的RGO对偏振光的反射率差值随入射角度的变化关系。从图4A可以看出,当RGO厚度为8 nm,入射角度为全反射角时,RGO对s偏振光和p偏振光的反射率差值ΔR最大,对折射率变化最为敏感。如图4B所示,不同浓度的NaCl具有不同的折射率,会引起该传感系统信号的变化。根据相关公式[12],计算出该传感系统的灵敏度和折射率分辨率分别为2.14×107mV/RIU和4.67×10-9。
图4C和图4D分别是该传感系统的灵敏度和折射率分辨率随RGO表面介质折射率变化的曲线,可以看出,介质的折射率在1.33~1.40范围内,灵敏度和折射率分辨率都会随介质折射率的降低而大幅增加,即表面介质的折射率越接近1.33(纯水的折射率),灵敏度和折射率分辨率越高,这为检测超低浓度的生物分子以及疾病标志物提供了理论支持。
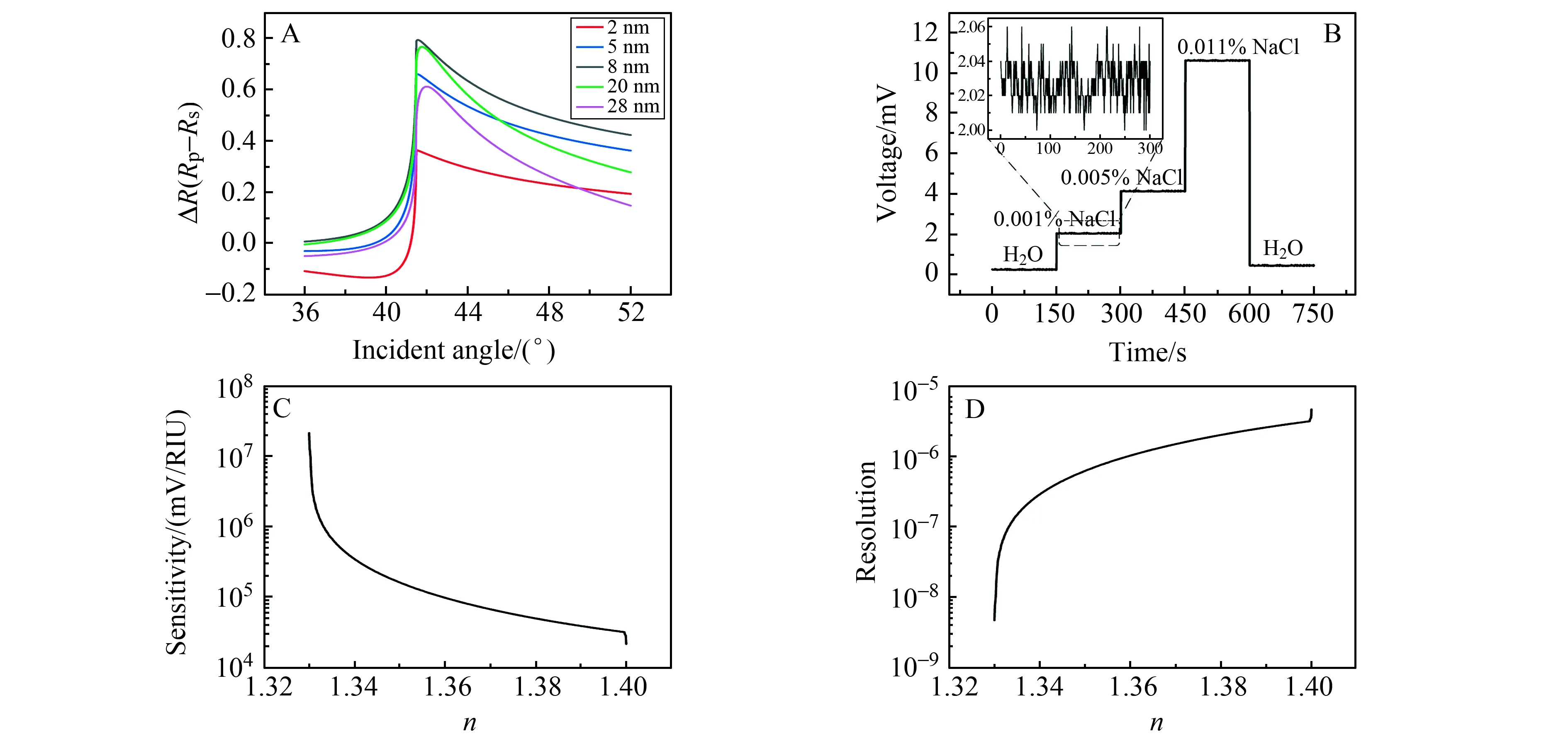
图4 (A)理论模拟不同厚度RGO对偏振光反射率的差值随入射角度的变化关系;(B)不同浓度NaCl注入时传感系统的响应,插图显示了该传感系统的噪声幅值;(C)传感系统的灵敏度和(D)折射率分辨率随RGO表面介质折射率(n)的变化关系Fig.4 (A)Theoretical simulation of the relationship between the difference in the reflectivity of polarized light of RGO with different thicknesses and the angle of incidence;(B)Response of the sensing system with different concentrations of NaCl.The illustration shows the noise amplitude of the sensing system;(C)Relationship between the sensitivity and (D)refractive index resolution of the sensing system and the refractive index of the RGO surface medium
2.4 兔IgG的定量检测
该传感系统首先被用于兔IgG的检测。图5A为固定抗体的过程中传感信号随时间的变化关系,把PBS的信号作为基线,注入EDC/NHS后,由于微流通道内RGO表面的折射率发生变化,信号也随之发生变化。30 min后注入PBS,信号回落但没有回到初始基线,说明RGO表面活化完成。再注入250 μg/mL的山羊抗兔IgG溶液,待稳定后注入PBS冲洗,信号下降但并没有回到基线,证明山羊抗兔IgG已经成功固定在RGO表面。之后,把PBS的信号作为新的基线,注入25 μg/mL的兔IgG溶液,微流通道内的兔IgG会被RGO上固定的山羊抗兔IgG特异性捕获,导致信号增大,待信号稳定后再注入PBS冲洗掉未结合的兔IgG,整个过程如图5B所示。该传感系统对不同浓度兔IgG的检测结果如图5C所示,在0.025~25 μg/mL浓度范围内检测结果具有很好的线性,校准曲线为y=0.969x+0.369,检测的最低浓度为0.025 μg/mL。通过测量20个空白样品的信号,计算得到该传感系统对兔IgG的检测限为0.014 μg/mL。
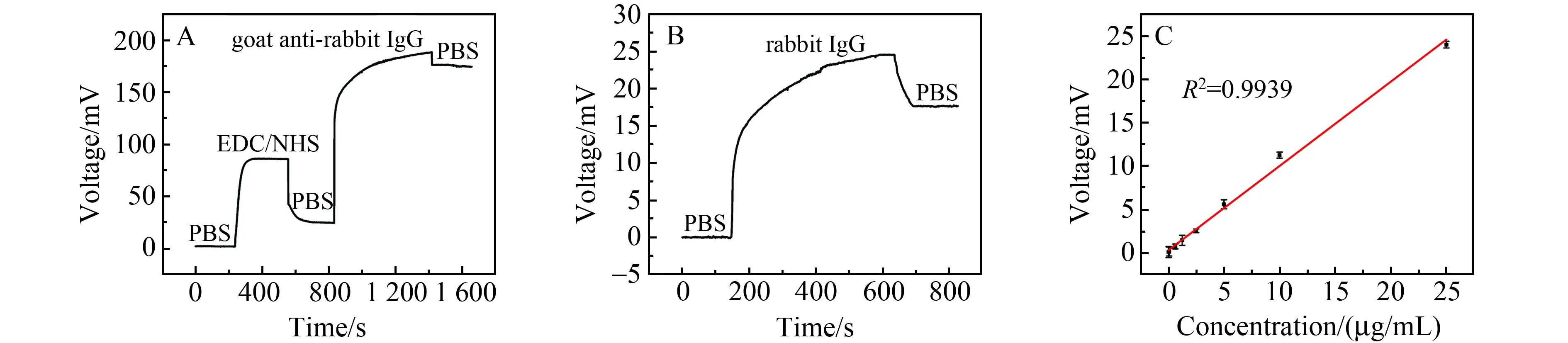
图5 (A)抗体的固定过程;(B)兔IgG的实时检测结果图;(C)不同浓度兔IgG的检测结果Fig.5 (A)Antibody fixing process;(B)Real-time detection results of rabbit IgG;(C)Detection results of different concentrations of rabbit IgG
2.5 心血管疾病标志物的定量检测及准确性考察
为了评估该传感系统对于心血管疾病标志物的检测性能,选用hs-CRP和SAA1作为检测指标进行了实验。图6A、图6C分别为该传感系统对不同浓度hs-CRP及SAAI的检测结果。从图中可以看出该传感系统信号与hs-CRP及SAAI的浓度线性范围均为0.1~25 μg/mL范围内均呈现出很好的线性,hs-CRP 校准曲线为y=0.888x+0.305,检测限为0.020 μg/mL;SAAI校准曲线为y=0.809x+0.439,检测限为0.023 μg/mL。两者的检测限均远低于临床检测标准10 μg/mL。此外,该传感系统对生物分子检测的特异性也得到了验证。用固定有hs-CRP和SAA1抗体的传感芯片分别检测浓度为20 μg/mL的hs-CRP,兔IgG,牛IgM和SAA1,实验结果如图6B和图6D所示,hs-CRP和SAA1信号较强,其他生物分子的信号较弱,表明该传感系统能够实现对生物分子的特异性检测。
为了验证本研究中传感系统的准确性和可靠性,我们用该传感系统与商用酶标仪分别测定相同浓度的hs-CRP和SAA1,并将结果进行对比。配制不同浓度的hs-CRP标准样品(16 μg/mL、8 μg/mL、4 μg/mL、2 μg/mL、1 μg/mL、0.5 μg/mL)和SAA1标准样品(24 μg/mL、12 μg/mL、6 μg/mL、3 μg/mL、1.5 μg/mL、0.75 μg/mL),将传感系统测定的电压值与商用酶标仪测得的吸光度值进行拟合,结果如图6E和图6F所示,两种仪器的测定结果呈现良好的线性相关性,证明基于石墨烯偏振吸收性质的光学传感系统可以准确检测hs-CRP和SAA1的浓度。

图6 (A)不同浓度hs-CRP的检测结果;(B)传感系统对hs-CRP的特异检测;(C)不同浓度SAA1的检测结果;(D)传感系统对SAA1的特异检测;(E)传感系统和商用酶标仪对hs-CRP检测结果的相关性;(F)传感系统和商用酶标仪对SAA1检测结果的相关性Fig.6 (A)Detection results of different concentrations of hs-CRP;(B)Specific detection of hs-CRP by the sensor system;(C)Detection results of different concentrations of SAA1;(D)Specific detection of SAA1 by the sensor system;(E)Correlation between the detection results of hs-CRP by the sensing system and the commercial microplate reader;(F)Correlation between the detection results of the SAA1 by the sensing system and the commercial microplate reader
3 结论
本文利用石墨烯在全反射条件下对不同偏振光吸收的不同,发展了一种基于石墨烯偏振吸收性质的新型光学传感技术。引入锁相放大系统,消除了环境光和震动等外界因素的干扰。通过在石墨烯表面修饰抗体,检测抗原抗体特异性结合时引起的折射率变化,该传感系统实现了对心血管疾病标志物hs-CRP和SAA的高灵敏度定量检测。基于石墨烯偏振吸收性质的光学传感技术具有免标记、高灵敏度和微体积检测的优点,对心血管疾病的早期诊断及风险评估具有重要意义。

