基于网络药理学探讨肝积方治疗肝细胞癌作用机制
王珏,张春蕾,杨铭,杨悦,郑培永,宋海燕
1.上海中医药大学附属龙华医院脾胃病研究所,上海 200032;2.上海中医药大学附属龙华医院,上海 200032;3.上海中医药大学附属龙华医院国家药物临床试验机构办公室,上海200032
原发性肝癌最常见的类型为肝细胞癌(hepatocellular carcinoma,HCC),约占75%~85%[1]。2018年全球新发肝癌病例中,约46.7%在我国[2]。虽然近年来关于HCC的诊断和治疗有显著进步,但尚未达到控制该病的目的。在我国,中医药在肝癌治疗中发挥了重要作用,尤其是大量晚期肝癌患者。
肝积方以名老中医邱佳信为首的上海中医药大学附属龙华医院肿瘤科组方,临床治疗肝癌效果良好,可单独或联合靶向药抑制肝癌生长和转移、改善患者症状和生存质量。临床试验显示,肝积方单独用于治疗晚期原发性肝癌的患者1年生存率为31%(18/58),而对照组为4.5%(1/22)[3]。动物实验研究显示,肝积方可预防二乙基亚硝胺(DEN)诱发大鼠肝癌的发生[4],可抑制HCC细胞增殖和皮下瘤的生长[5]。然而,肝积方抑制HCC的作用机制尚不明确。因此,本研究采用网络药理学方法,通过筛选肝积方有效成分,根据生物基因组、蛋白质相互作用、疾病和药物靶点等信息,综合评价该复方对HCC的效应,并分析其潜在作用靶点和相关调控机制。进一步通过药物对HCC动物模型的干预实验,探讨肝积方治疗HCC的药效及部分机制。
1 材料与方法
1.1 肝积方主要化学成分收集和筛选
利用TCMSP(https://old.tcmsp-e.com/tcmsp.php)[6]、HIT(http://hcls.hit.edu.cn/hclsen/main.htm)[7]、TCMID(http://bidd.group/TCMID/)及STITCH(http://stitch.embl.de/)[8]数据库检索太子参、白术、茯苓、岩柏、马兰根、夏枯草、鳖甲、天南星、牡蛎、丹参、八月札,获取相应化学成分,将收集到的化学成分理化特征与已知药物的相同特征按照类药性评估指标(quantitative estimate of druglikeness,QED)[9]评估化合物ADME(吸收、分布、代谢、排泄)性质。QED=,式中di为整合8种主要分子描述符的渴求函数,分别为化合物相对分子质量、油水分配系数、氢键受体数、氢键供体数、分子极性表面积、化合物中可旋转键数、化合物中芳香环数及非药子结构数[10]。通过计算DrugBank数据库(https://go.drugbank.com/)[11]中美国食品药品监督管理局(FDA)批准上市的1 805种药物的QED值,按QED阈值≥0.2对化学成分进行初步筛选。
1.2 主要作用靶点收集和筛选
应用美国国立生物技术信息中心(NCBI,https://www.ncbi.nlm.nih.gov)数据库的基因搜索功能对化学成分作用靶点名称进行标准化处理。对搜索结果按下式采用基于二项分布P(X≥k)的富集评分算法筛选作用靶点,计算靶点分值(gene score,GS)。

式中,k为对所研究靶点起作用的化合物数量,n为化合物总数,g表示平均作用于每个靶点的化合物数量。P(X≥k)指经过错误发现率方法调整后,以随机机会衡量目标物与n个化合物中的k个以上化合物发生相互作用的可能性。P值低(P<0.05)提示观察到的相互作用化合物的数量显著大于预期数量,可认为是核心目标。本研究以基因靶点关联阈值≥400、靶点分值≥0.2、P<0.05为条件进行筛选,建立肝积方作用靶点数据库。
1.3 疾病靶点收集
通过GeneCards(https://www.genecards.org/)数据库检索“Hepatocellular Carcinoma”,获取肝癌疾病相关基因,设置相关性得分(relevance score)≥10,提取高关联度靶点基因,建立疾病相关基因靶点数据库[12]。
1.4 靶点生物功能富集分析
对肝积方和HCC 的靶点进行GO 富集分析及KEGG通路富集分析,GO富集分析包括分子功能、生物过程、细胞组分三部分。采用超几何分布模型评估靶点群(gene set)是否与特定的基因本体及通路显著关联。经过FDR(false discovery rate)法调整的P值可反映作用靶点与GO功能条目或KEGG通路的关联强度。以调整的P<0.01为显著关联,通过基因的富集分析探讨肝积方治疗HCC的可能机制。
1.5 实验验证
1.5.1 动物
18只SPF级雄性SD大鼠(6周龄),购于上海斯莱克实验动物有限责任公司,动物生产许可证号SCXK(沪)2007-0005,饲养于上海中医药大学SPF级动物房,温度(22±2)℃,湿度55%±10%,每日光照12 h。动物实验步骤、实验操作遵循实验动物饲养和使用指南,由上海中医药大学实验动物福利与伦理委员会批准(PZSHUTCM210514001)。
1.5.2 主要试剂与仪器
DMEM培养基(货号11965092),美国赛默飞世尔科技公司;胎牛血清(货号C0237),美国Life Techonlogies公司;青霉素-链霉素(货号15140122),美国Gibco公司;蛋白酶抑制剂(批号5892791001)、磷酸酶抑制剂(批号4906837001),瑞士ROCHE 公司;SDS-PAGE蛋白上样缓冲液(批号P0015)、RIPA蛋白裂解液(批号P0013B),碧云天生物技术有限公司;p-AKT(货号#4058)、AKT(货号#9272),美国CST 公司;钙黏蛋白-E(E-cadherin,货号20874-1-AP)、钙黏蛋白-N(N-cadherin,货号22018-1-AP)、波形蛋白(Vimentin,货号10366-1-AP),武汉Proteintech 公司;锌指转录因子(Snail,货号A11794),武汉ABclonal公司;微量BCA蛋白定量试剂盒(批号CW0014S)康为世纪生物科技有限公司;脱脂奶粉(批号232100),美国BD公司;ECL发光底物(批号WBKLS0500),美国Millipore公司。
Heracell 150i型二氧化碳培养箱(赛默飞世尔科技公司),SynergyH4 型酶标仪(美国BioTek 公司),Western 电泳、转膜系统(美国BIO-RAD 公司),CPA3235 型电子天平(德国Sartorius 公司),Tanon 4600生物发光成像仪(上海天能科技有限公司)。
1.5.3 细胞及药物
大鼠肝癌细胞McA-RH7777细胞,购于中国科学院上海细胞所。以DMEM高糖培养基(美国Gibco公司),加入10%胎牛血清、1%青霉素-链霉素,置于恒温37 ℃、5%CO2细胞培养箱内培养。肝积方(太子参15 g,珠儿参9 g,麸炒白术9 g,茯苓12 g,丹参9 g,岩柏15 g,马兰根15 g,牡蛎15 g,夏枯草15 g,鳖甲9 g,天龙9 g,地龙9 g,八月札9 g,制天南星6 g,山慈菇6 g,制半夏9 g),饮片购于上海中医药大学附属龙华医院药剂科中药房,沸水煮0.5 h,煮2次,合并后浓缩,药液置于4 ℃保存备用。
1.5.4 造模及药物干预
大鼠按体质量完全随机分为对照组6只、造模组12只。对照组予生理盐水皮下注射。造模组初次给予3 mL/kg 纯CCl4皮下注射,后续将CCl4和橄榄油按1∶1比例混合后按2 mL/kg皮下注射,每周2次,以诱导肝纤维化。12周后,取对数生长期的McARH7777细胞制成单细胞悬液,造模组大鼠肝包膜注射4×106个细胞。3 d后造模组大鼠根据体质量随机分为模型组和肝积方组,每组6只。根据实验动物和人临床给药剂量折算系数及大鼠体质量计算给药剂量,肝积方组大鼠灌胃肝积方16.9 g原药材/kg,灌胃体积5 mL,模型组灌胃等体积生理盐水,每日1次,连续2周。干预结束后用2%戊巴比妥钠麻醉并处死大鼠,取原位肝癌组织测量大小并称重,冻存备用。
1.5.5 Western blot检测AKT相关蛋白表达
采用加入蛋白酶抑制剂和磷酸酶抑制剂的RIPA蛋白裂解液及匀浆提取各组大鼠肝癌组织蛋白,通过BCA法进行蛋白定量。蛋白变性后应用10%SDS-PAGE分离蛋白,转膜至PVDF 膜,封闭后加入p-AKT、AKT、E-cadherin、N-cadherin、Vimentin、Snail 一抗(均为1∶1 000),4 ℃孵育过夜。TBST洗膜3次,加入二抗,室温孵育1 h,加入ECL发光液反应,采用发光成像仪进行条带采集分析。
1.5.6 统计学方法
采用SPSS24.0和GraphPad Prism 7.0软件进行数据统计分析和作图。符合正态分布且方差齐时,实验数据以表示,多组间比较采用方差分析,用LSD-t检验进行两样本间比较;不符合正态分布或方差不齐时,多组间比较采用Kruskal-WallisH检验,两样本间采用Mann-WhitneyU检验。P<0.05表示差异有统计学意义。
2 结果
2.1 肝积方有效化学成分
通过TCMSP、HIT、TCMID、STITCH数据库检索后以QED阈值≥0.2对化学成分进行初步筛选,得到肝积方的有效化学成分127个。主要活性成分包括β-榄香烯、姜辣烯酮、芍药醇、茯苓酸、丹参酮、黄芩苷等,见表1。

表1 肝积方主要活性成分(前20位)
2.2 肝积方有效成分作用靶点及肝癌疾病靶点
将肝积方各化学成分作用靶点信息应用NCBI数据库的基因搜索功能对其名称进行标准化,建立肝积方主要作用靶点数据库。基于二项分布的富集评分算法,筛选出主要作用靶点301个,包括Caspase-3、AKT、SEC61A1等。靶点分值前20位的靶基因见表2。

表2 肝积方活性成分作用靶点(前20位)
通过GeneCards 数据库,以“Hepatocellular Carcinoma”关键词进行检索,选择相关性评分>10的基因,建立疾病相关基因靶点数据库,前60位与疾病相关的主要靶基因见表3。

表3 HCC主要相关靶点(前60位)
2.3 GO和KEGG通路富集分析
肝积方主要作用靶点及HCC疾病靶点GO富集分析见图1。可以看出,二者显示出共关联性。与两者显著共关联的GO生物过程主要有氨基酸代谢、蛋白质水解、免疫调节、细胞周期调节过程等。
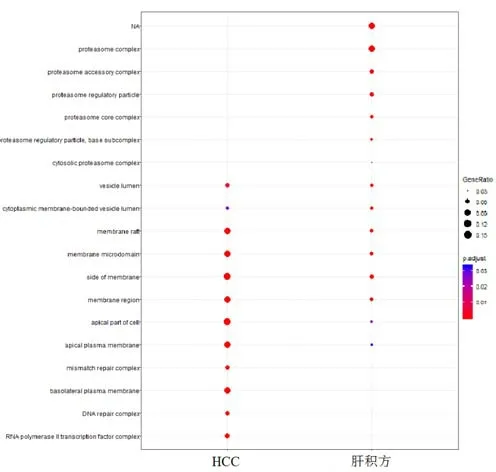
图1 肝积方与HCC靶点GO生物过程富集分析
对肝积方靶点和HCC靶点进行KEGG通路富集分析。肝积方靶点与74条信号通路显著相关,HCC靶点与63条信号通路相关联,与两者共关联有31条(P<0.05)。主要共关联信号通路包括PI3K-AKT、TNF-α、IL-17、Focal adhesion、drug resistance 等。这些信号通路与肿瘤细胞增殖、耐药、炎性或细胞迁移、免疫逃逸等肝癌发生和进展病理过程密切相关,提示肝积方可能通过调控这些信号通路发挥治疗HCC的作用。见表4、图2。

表4 肝积方治疗HCC靶点显著关联的信号通路(前12条)
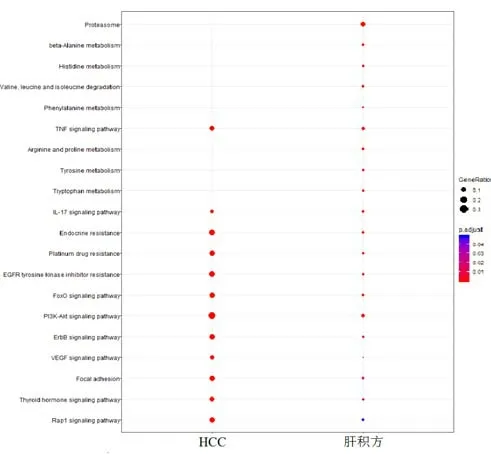
图2 肝积方与HCC靶点KEGG通路富集分析
2.4 肝积方对大鼠原位肝癌的生长及瘤组织AKT活化水平的影响
肝癌发生发展与肿瘤微环境密切相关,临床有80%患者具有肝纤维化或肝硬化的背景[13]。因此采用伴有肝纤维化微环境的非免疫缺陷大鼠原位肝癌模型验证部分网络药理学分析结果。由于建立原位癌手术中导致1只对照组及2只模型组死亡,故剩余对照、模型、肝积方组各5只完成后续生理盐水或药物干预过程。实验结果显示,15只大鼠HCC原位肿瘤造模均成功。模型组中肿瘤体积和质量均较对照组增加;与模型组比较,肝积方组大鼠肿瘤质量和体积均显著减小(P<0.05,P<0.01)。见图3A、图3B。
PI3K-AKT信号转导通路具有广泛的生物活性,可参与调节肿瘤细胞周期、增殖、凋亡、迁移等多种过程,是恶性肿瘤发生发展的关键通路[14-15]。因此,采用Western blot验证肝积方对该通路的调控作用。结果显示,各组AKT表达无明显变化,模型组瘤组织的p-AKT/AKT水平较对照组明显上调,而肝积方组可抑制该比例(P<0.05),见图3C、图3D。表明肝积方可抑制纤维化环境HCC组织中AKT通路的活化水平。

图3 各组大鼠原位肝癌生长情况及肝癌组织AKT蛋白表达
2.5 肝积方对大鼠原位肝癌组织相关分子的影响
肿瘤细胞受炎性、低氧、纤维化等肿瘤微环境诱导发生上皮间质转化(EMT),促进细胞肿瘤干性、抗凋亡、侵袭、迁移等能力。EMT与肝癌恶性程度密切相关,而PI3K-AKT 是促进肿瘤EMT 的重要调控通路[16],因此检测大鼠肝癌组织中EMT相关调控因子的表达水平。Western blot结果显示,模型组E-cadherin表达较对照组明显下调,N-cadherin、Vimentin、Snail表达显著上调。与模型组比较,肝积方组E-cadherin表达明显上调,N-cadherin、Vimentin、Snail表达均下调(P<0.01,P<0.05)。见图4。提示肝积方具有逆转纤维化微环境导致的肝癌细胞EMT作用。

图4 各组大鼠肝癌组织EMT相关蛋白表达
3 讨论
HCC是消化系统常见恶性肿瘤,目前尚缺乏有效治疗方法。HCC中医病机总属本虚标实,正虚邪实[17]。肝积方据此组方,攻补兼用,具有健脾益气、清热解毒、软坚化痰作用,在长期用于肝癌治疗中取得较好效果,尤其对于耐药、术后及晚期肝癌患者能够发挥一定作用。但由于其成分复杂性,动物模型无法模拟临床肝癌病理,也难以用药物直接干预细胞进行体外实验,其作用机制迄今仍不清楚。
本研究运用网络药理学的方法对肝积方的活性成分、HCC相关靶点和通路进行分析。共筛选出肝积方有效活性成分127种,主要包括β-榄香烯、姜辣烯酮、芍药醇、茯苓酸等。依据这些靶标进一步筛选出301个主要作用靶点,包括Caspase-3、AKT、SEC61A1等,这些靶点与HCC高度相关。随后对这些药物靶标进行GO和KEGG通路富集分析,显示肝积方可调控多条与HCC发生发展相关的生物过程和信号通路,生物过程主要包括氨基酸代谢、蛋白质水解、免疫调节、细胞周期调节过程,信号通路包括PI3K-AKT、TNF-α、IL-17、Focal adhesion、drug resistance 等信号通路。这些信号通路与HCC恶性进展密切相关,肝积方可能通过对这些通路多靶点、多环节的调控发挥抑瘤作用。
PI3K-AKT信号通路具有广泛的生物学作用,该通路激活会促进HCC的代谢、增殖、抗凋亡、血管生成及耐药[18]。该通路在多种肿瘤中活化,尤其在缺氧、炎症、纤维化等微环境诱导下,酪氨酸激酶生长因子受体、G蛋白偶联受体和癌基因(如RAS)的激活会导致PI3K-AKT信号通路的活化增强[19-22]。本研究中,模型组大鼠肿瘤体积和质量较对照组增加,与模型组比较,肝积方组大鼠的肿瘤体积和质量均显著减小。同时,模型组瘤组织的p-AKT/AKT水平较对照组明显上调,而肝积方组中该比例下调。以上结果提示肝积方能够抑制HCC生长,其作用机制与PI3K-AKT信号通路有关。
研究表明,活化的PI3K-AKT信号通路可直接或通过参与其他分子信号通路诱导肝癌细胞发生EMT,在肝癌进展中发挥重要作用[23-24]。PI3K-AKT 介导EMT的过程作为预防和治疗肿瘤转移复发和耐药的潜在靶点引起了广泛关注。EMT指具有极性的上皮型细胞在某些因素刺激下失去基底膜附着极性,细胞间失去紧密连接和黏附能力,转换为间质型细胞的过程。EMT与肿瘤恶性程度密切相关,在肿瘤细胞的存活、转移、免疫逃逸、肿瘤耐药等病理过程中,EMT扮演着重要的角色[25]。E-cadherin表达缺失是EMT产生的标志,会促使细胞内发生信号级联反应,继而促进HCC细胞侵袭迁移能力增强[26]。EMT发生时,细胞骨架发生重大改变,细胞角蛋白骨架会转化成Vimentin为主的间质细胞形态[27]。N-cadherin也是一种介导细胞与细胞间黏附的跨膜蛋白,当EMT发生时,N-cadherin 表达会升高[28]。Snail 是EMT 的关键诱导因子,是肝癌EMT中最重要的转录调控因子[29]。PI3K-AKT通路是EMT中一条重要的调控通路。一方面,AKT表达能抑制Snail降解,另一方面PI3K-AKT活化能直接促进Snail表达,调控Vimentin转录表达升高,并降低E-cadherin表达[23]。本研究显示,与模型组比较,肝积方组E-cadherin表达显著上调,N-cadherin、Vimentin、Snail被明显抑制,表明肝积方能有效抑制HCC发生EMT。
综上所述,本研究通过网络药理学分析,以及进一步的肝积方干预大鼠原位肝癌的体内实验,明确了肝积方抑制HCC的作用,并揭示调控PI3K-AKT信号通路抑制EMT是促进其药效作用的部分机制。由于AKT/EMT是导致肿瘤干性、侵袭转移、耐药等的重要机制,因此可为肝积方在临床发挥抑瘤生长、转移及改善耐药等作用提供生物学依据。此外,本研究还发现SEC61A1、Caspase-3等分子是肝积方治疗HCC的潜在靶点,TNF-α、IL-17、Focal adhesion、drug resistance等信号通路可能是其干预的信号途径,为后续更广泛深入的相关药理机制研究提供了方向,有待通过体内及体外实验进一步明确。

