超声自动功能成像评估2型糖尿病病人心肌早期损害的临床价值
卿顺华,龚元淑,陈玲玲,梁柏松,张平洋
随着我国人民生活水平的改善,糖尿病(diabetes mellitus,DM)的发病率呈直线上升趋势,且糖尿病死亡病例中近80%是由于心血管疾病,死亡率是未患糖尿病人群的2倍之多。现已证明2型糖尿病能够在无明显冠状动脉或大血管病变的情况下发生糖尿病性心肌损害,并最终发展为心功能不全甚至心力衰竭[1]。目前临床上往往关注糖尿病并发冠状动脉粥样硬化等引起的继发性心脏病变,而忽视糖尿病性心肌病(diabetic cardiomyopathy,DCM)本身的损害,尽管糖尿病的治疗手段不少,但心血管并发症的死亡率却未见明显下降。因此,准确评价糖尿病性心肌损害尤其是早期实时监测和诊断具有重要意义[2]。目前,临床对DCM的早期诊断较为困难,心内膜活检虽然可以判定,但系有创检查,且费用昂贵,难以推广应用[3]。超声自动功能成像(automated function imaging,AFI)技术基于二维斑点追踪显像,无角度依赖性,快速简捷,重复性好,可提供心肌应变牛眼图,并且可用不同颜色标识左室心肌节段的应变大小,直观反映左室壁节段的收缩功能变化,对评价室壁运动有明显优势,尤其左室壁各节段长轴收缩期峰值应变(LPSS)可发现常规超声心动图不能发现的心肌早期损害[4]。本研究基于超声自动功能成像技术探讨轻型2型糖尿病病人左室收缩期心肌力学特征,以期寻求早期准确诊断DCM的新方法。
1 资料与方法
1.1 一般资料 选取2016年1月—2019年12月江苏省人民医院浦口分院明确诊断为2型糖尿病的病人42例为病例组,其中,男26例,女16例,年龄39~68(55.66±8.11)岁。入选标准:符合1999年世界卫生组织(WHO)制定的2型糖尿病诊断标准[5],常规超声心动图检查未见明显心脏大小异常且左室射血分数(LVEF)>55%。另外,随机选取同期性别、年龄相匹配的32名健康成年人作为对照组,均无心血管病史,而且经过超声心动图、心电图及生化等检查排除明显心肺疾患,男18名,女14名,年龄42~62(52.59±7.51)岁。所有受检者均签署知情同意书,本研究获得我院伦理委员会批准后实施。
1.2 设备与方法 采用GE Vivid E95彩色超声诊断仪,配有M5S探头(频率1.0~4.5 MHz)和6S探头(频率2.7~8.0 MHz),频帧70~80帧/s,超声仪内置AFI分析软件。检查时,嘱受检者左侧卧位,连接心电图,平静呼吸,首先进行常规超声检查,主要采集左室长轴切面M型超声图像,检测左室舒张末期内径(LVEDD)、左室质量指数(LVMI)、左室短轴缩短率(FS)、LVEF、每搏量(SV),并计算心排血量(CO),记录二尖瓣口舒张早期峰值血流速度/舒张晚期峰值血流速度(E/A)。在日常超声心动图检查完成后,分别获取3~5个连续心动周期的左室心尖四腔心、两腔心、心尖左心室长轴切面的二维灰阶动态图像及左室心尖五腔切面采集的主动脉血流频谱静态图像,存储图像,以备下一步进行心肌应变分析[4]。
1.3 图像分析 首先,根据主动脉频谱确定主动脉瓣关闭时间点,对左室心尖长轴观的动态图像进行分析。在心尖左心室长轴观动态图像AFI模式下,按照提示依次选择二尖瓣两侧瓣环点和心尖点三点心内膜,由此自动程序显示心内膜轮廓,必要时也可辅以手动微调,使得宽度与心肌厚度基本一致,此后系统自动分析得出追踪结果,接下来同样的方法对心尖四腔观和两腔观的动态图像进行分析,程序自动分析获得整个左室17个节段LPSS的牛眼图及应变平均值(见图1)。

图1 1例糖尿病病人的AFI结果 [AFI显示左室心肌整体应变降低,整体长轴收缩峰值应变(GLPS)=-18.2%]
重复性检验:随机选取病例组和对照组各10例,由两名同年资、有经验的超声医生,在并不知晓受检者病情和检查结果的情况下独立完成。2名检查者分别对每个受检者测量2次,然后对同一检查者的2次检测结果和不同检查者的检测结果进行重复性检验。
1.4 血液生化检测 所有受检者均于超声检测当日清晨留取空腹外周静脉血样本,采用Vidas-Blue全自动荧光免疫分析仪及其配套原装试剂进行血清超敏肌钙蛋白I(hs-cTnI)及血浆N末端B型钠尿肽前体(NT-proBNP)水平的检测;同期采血样用酶联免疫吸附试验(ELISA)法,按照基质金属蛋白酶-2(MMP-2)试剂盒及基质金属蛋白酶组织抑制因子(TIMP)试剂盒说明书(武汉博士德公司)操作,用iMARK 680型酶联仪(Bio-Rad公司)检测受检者血清MMP-2及TIMP-1浓度;另外,检测血液中C反应蛋白(CRP)、肌酸激酶同工酶(CK-MB)水平。

2 结 果
2.1 两组超声参数、血液检测指标比较 病例组与对照组LVEDD、LVMI、LVEF、FS、SV、CO以及CK-MB、CRP、NT-proBNP、MMP-2、TIMP-1比较差异均无统计学意义(P>0.05),而病例组GLPS绝对值、E/A明显减小,hs-cTnI明显增高,差异均有统计学意义(P<0.01)。详见表1。

表1 两组超声参数、血液检测指标比较(±s)
2.2 两组左室壁各节段心肌长轴应变比较 病例组左室前壁基底段、前间隔基底、后间隔基底、后间隔中段、侧壁中间段、前壁心尖段、间隔心尖段、侧壁心尖段、心尖部LPSS的绝对值较对照组明显降低(P<0.01)。病例组正常左室壁心肌应变的超声表达特征,即由基底段向心尖段逐渐增大的趋势不复存在,左室心肌GLPS绝对值降低(P<0.01)。详见表2。

表2 两组左室壁各节段心肌长轴应变比较(±s) 单位:%
2.3 hs-cTnI≤0.1 ng/mL与>0.1 ng/mL的糖尿病病人超声参数及血生化指标比较 与hs-cTnI≤0.1 ng/mL的糖尿病病人相比,hs-cTnI>0.1 ng/mL的糖尿病病人GLPS绝对值、E/A明显性降低(P<0.01),而其他超声参数、血液检测指标比较差异均无统计学意义(P>0.05)。详见表3。

表3 hs-cTnI≤0.1 ng/mL与>0.1 ng/mL的糖尿病病人超声参数及血生化指标比较(±s)
2.4 GLPS与其他超声参数及血液检测指标的相关性及受试者工作特征(ROC)曲线分析 相关性分析显示,糖尿病病人GLPS与LVEF、FS、E/A均呈正相关(r值分别为0.61,0.45,0.39,P<0.05或P<0.001),与hs-cTnI呈负相关(r=-0.63,P<0.001),而与LVEDD、LVMI、SV、CO、NT-proBNP、CRP、MMP-2、TMP-1无相关性(P>0.05)。ROC曲线分析显示,GLPS绝对值<18.5%评价心肌损害的敏感度为90.0%,特异性为88.7%,曲线下面积为0.91。详见图2。
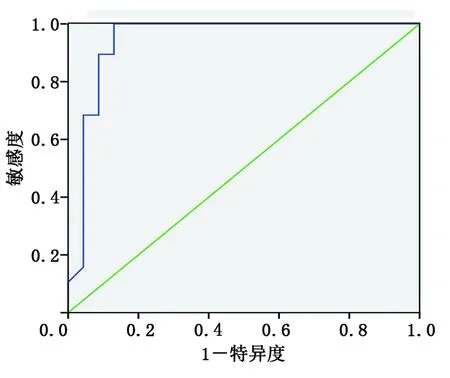
图2 GLPS预测糖尿病病人心肌损害的ROC曲线
2.5 重复性检验 2名同年资、经验较丰富的超声医生,随机选取10例糖尿病病人和10名正常对照者,所测的LPSS差异无统计学意义(P>0.05),且对同一检查者两次检测的LPSS差异亦无统计学意义(P>0.05)。
3 讨 论
DCM是糖尿病在没有其他危险因素(如冠心病、高血压或瓣膜病)的情况下存在心脏结构和功能异常,在疾病的早期阶段,病人常常并无明显临床症状,但晚期则会出现心律失常、心力衰竭甚至心源性休克等严重并发症,心脏损害早期多属可逆性病变,如果早期发现并及时治疗,大多数是可以较好地恢复,因此,DCM的早期发现和诊断非常重要[6]。尽管目前判定糖尿病病人心室舒张功能障碍并不具备糖尿病的特异性,但是,临床上对DCM早期特征的关注主要还是集中在舒张功能障碍,而对收缩功能关注甚少,这很大程度上是因为临床上发现DCM病人早期LVEF往往保持正常,传统的LVEF并不能敏感、准确地反映早期左室心肌收缩功能的降低[7],但是又没有更好方法或者途径来评判此时心肌收缩能力的改变,那么这些DCM早期的心肌生物力学能力真的并无受损吗?本研究选择42例在常规超声心动图检查并未发现心脏结构和LVEF异常的新近确诊(病程<1年)糖尿病病人进行观察,利用AFI评价其左室心肌力学特征,结果发现,与对照组相比,病例组hs-cTnI明显增高(P<0.05)。这是因为糖尿病病人血糖升高,一方面,因为胰岛素缺乏引起心肌细胞内糖、脂肪、蛋白质代谢异常,能量供应障碍;另一方面,可能由于心脏微血管病变导致心肌缺血、代谢和营养发生障碍,受损心肌的肌钙蛋白释放进入血液,从而使得病人血清hs-cTnI浓度增高[8]。当然,并非每例糖尿病的hs-cTnI都是异常的,这是因为hs-cTnI、CK-MB作为临床用来判定心肌损害的生化指标,总是会受到病人病程时间窗、心肌损害程度等的限制,尤其心肌损害程度的敏感度和特异性有时均差强人意[9],因此,本研究利用AFI早期评价糖尿病心肌早期损害。
NT-proBNP 是脑钠肽在脑钠肽前体蛋白酶的作用下裂解的产物,TIMP-2是基质金属蛋白酶调控性因子,能够通过结合基质金属蛋白酶-1(MMP-1),进而调控心肌细胞的纤维化,参与DCM的病情进展[10]。许士达等[11]研究显示,DCM病人血清MMP-1、脑钠肽、TIMP-2水平较单纯2型糖尿病病人升高更加明显,三者联合检测对于早期发现病人心肌损害有一定价值。但本研究结果显示,病例组与对照组LVMI、NT-proBNP、MMP-2、TIMP1比较差异均无统计学意义,这与许士达等[11]和梅玉红[12]的研究结果不同,可能是因为本研究的对象是新近确诊的糖尿病病人,所以心肌质量增加并不明显、心肌纤维化的程度也较轻[13]。
心室壁由心内膜、心肌层和心外膜3层构成,心肌层是构成心壁的主体,主要由心肌细胞组成,分为内、中、外3层,走行方向分别为浅层斜行、中层环形、深层纵行,心内膜下的心肌纤维主要为纵向排列,很多病变(如缺血)往往首先累及心内膜下心肌,导致心肌纵向应变的下降[14]。本研究结果显示,尽管两组超声指标LVEF、FS、LVEDD、SV比较差异均无统计学意义,但病例组E/A、部分左心室节段的LPSS以及GLPS的绝对值较正常组明显减小,糖尿病病人GLPS与LVEF、FS、E/A以及hs-cTnI有相关性,提示糖尿病病人存在舒张功能异常和心肌损害风险,且与左室心肌纵向应变下降密切相关。hs-cTnI升高有助于发现亚临床的心肌损伤[8,15],本研究中还参照文献[16]将血清hs-cTnI>0.1 ng/mL的糖尿病病人与hs-cTnI ≤0.1 ng/mL作比较,结果显示,与hs-cTnI ≤0.1 ng/mL的糖尿病病人比较,血清hs-cTnI>0.1 ng/mL的糖尿病病人GLPS的绝对值、E/A明显降低,证明糖尿病早期心肌损害加重与其左室心肌收缩期应变下降和舒张功能障碍加重相关,而且ROC曲线分析显示,GLPS评价心肌损害的敏感度、特异度较高。表明糖尿病早期虽然左室容积、质量及射血分数等并无明显异常改变,但是病人不仅左室舒张功能发生障碍,而且左室心肌收缩期力学特性也已经出现变化,大部分左室节段的心肌形变能力下降,并导致左室整体应变降低。DCM病人糖代谢功能障碍会引起心肌微血管发生广泛病变,心肌糖蛋白胶原纤维、三酰甘油及胆固醇的沉积可以引起心肌细胞肥大变性甚至不同程度的坏死纤维化,致使一定程度的心肌松弛性甚至顺应性减小,而且收缩能力下降,引起舒张和收缩功能降低[13,17]。可能由于疾病早期这些改变程度相对较轻、范围偏小等缘故,传统的超声心动图中LVEF、FS尚不能敏感反映出这些变化,但基于AFI的心肌应变特性反映出了糖尿病病人左室心肌收缩期的形变能力下降,而且指标重复性好,所以能够很好地揭示糖尿病病人左室心肌早期收缩能力的异常,如果与现有的指标联合应用,应该可以更好地评判糖尿病的左室心肌早期损害。
局限性:基于2D-STI的AFI检查,不仅对图像质量要求高,需要能够清晰辨识心肌尤其是心内膜,而且对图像采集的帧频要求也高,一些糖尿病病人常合并肥胖,图像质量差,尤其是心率加快时图像采集的准确性会不理想,这使得研究结果在临床的推广应用可能会受到一定程度的限制。
综上所述,糖尿病病人左室心肌生物力学改变有一定的特异性,超声自动功能成像能较敏感地观测病人左室心肌基于形变改变的心肌收缩能力变化,从而为临床DMC的早期诊断提供简便、可靠的新方法。

