BMI对早卵泡期超长方案多囊卵巢综合征患者辅助生殖结局的影响
钟皓月 应映芬 孙轶群 付养华 习海涛 赵军招
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是女性不孕的主要原因之一,对全世界6%~20%的育龄妇女的生育造成影响[1]。PCOS的临床症状主要为高雄激素血症和稀发排卵,部分患者还表现为代谢紊乱,如2型糖尿病、高血压和心血管疾病等[2-3]。由于代谢紊乱,PCOS患者肥胖发病率约为40%[3]。研究报道肥胖、胰岛素抵抗对采取辅助生育技术助孕的PCOS患者的生殖结局具有不利影响[4-6]。超促排卵是体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)技术的重要步骤。由于PCOS患者常伴多个小卵泡和内分泌水平异常,在促排卵时需要更加谨慎[7]。研究表明,早卵泡期超长方案比传统长方案更不易引起早发性黄体生成素(luteinizing hormone,LH)峰,同时能够显著提高子宫内膜容受性,提高妊娠率,现已成为许多生殖中心的主流方案[8]。然而,该方案对PCOS患者的治疗效果是否受BMI影响鲜有报道。因此,本研究聚焦于早卵泡期超长方案超促排卵的PCOS患者,比较不同BMI对于体外受精(in vitro fertilization,IVF)结果及胚胎移植后妊娠结局的影响,以期指导临床实践。
1 对象和方法
1.1 对象 选取2016年9月至2020年9月温州医科大学附属第二医院生殖医学中心收治的行IVF-ET的942例(976个周期)PCOS患者为研究对象,根据《中国成人超重与肥胖症预防控制指南》[9]将其分为低体重组(BMI<18.5 kg/m2组,79例81个周期)、正常体重组(18.5 kg/m2≤BMI<24 kg/m2,501例514个周期)、超重组(24 kg/m2≤BMI<28 kg/m2,269例282个周期)和肥胖组(BMI≥28 kg/m2,93例99个周期)4个亚组。另选取同期本院收治的1 258例(1 298个周期)男方因素或输卵管因素导致不孕的患者为对照,根据相同BMI标准归入各亚组,即低体重组185例192个周期、正常体重组811例833个周期、超重组206例215个周期、肥胖组56例58个周期。所有患者纳入标准:PCOS导致不孕/男方或输卵管因素导致不孕、行早卵泡期超长方案、20~40岁、移植1~2个第4天或第5天的新鲜囊胚。排除标准:宫腔粘连或盆腔粘连、子宫内膜异位症、子宫腺肌症、子宫畸形、卵巢储备功能低下、染色体异常、子宫肌瘤压迫子宫、反复种植失败、不良妊娠史。
1.2 方法
1.2.1 降调节 所有患者采取早卵泡期超长方案。于月经周期第3~5天肌肉注射长效醋酸曲普瑞林(德国辉凌制药有限公司,规格:3.75 mg/支)3.75 mg,注射后32~38 d测定生殖激素水平、子宫内膜厚度、卵泡数量及大小以确定垂体是否达到脱敏状态。当血清促卵泡生成素(follicle stimulating hormone,FSH)<5 U/L、LH<5 U/L、雌二醇(estradiol,E2)<50 pg/ml,B超监测无直径>10 mm卵泡、子宫内膜<5 mm,即垂体已脱敏,再使用促性腺激素(gonadotropins,Gn)开启超促排卵。
1.2.2 超促排卵 于促排卵第5天开始通过阴道超声监测卵泡生长情况,根据每例患者的年龄、激素水平、基础窦卵泡数(antral follicle count,AFC)及卵泡的生长情况等使用Gn 75~225 IU/d启动。Gn刺激第5天根据卵泡数量和大小、子宫内膜厚度及激素水平调整Gn的种类与剂量。促排卵后程,当出现3个优势卵泡直径≥17 mm,或至少2个优势卵泡直径≥18 mm时,于当日约21:00给予肌肉注射人绒毛膜促性腺激素(human chorionic gonadotrophin,hCG)(珠海丽珠集团丽珠制药厂,规格:2 000 IU/支)4 000~10 000 IU扳机。
1.2.3 取卵、移植与黄体支持 hCG注射34~36 h后取卵。根据男方精液情况,采用IVF或卵胞浆内单精子注射受精,培养4~5 d后行胚胎移植。自取卵日次日起开始黄体支持治疗。移植后12 d测定血清hCG水平初步判定是否妊娠。
1.2.4 随访 移植后10~12 d血hCG>25 U/L即诊断为生化妊娠。移植4周后经阴道超声检查见宫内孕囊或心管搏动者为临床妊娠[10-12]。宫内妊娠确定后随访至分娩后6周。妊娠于28周前终止判断为流产,满28周但不足37周分娩者为早产,达28周以上并至少分娩1名活婴者为活产。出生体重<2 500 g的新生儿为低出生体重儿,出生体重≥4 000 g为巨大儿。
1.2.5 胚胎评价标准 精卵结合后第1天早上在显微镜下观察到双原核(2PN)的受精卵为正常受精。第3天(D3)优胚的评估参考伊斯坦布尔共识的评分标准[13]。囊胚质量评估参考Gardner评分标准[14]。
1.2.6 观察指标 比较PCOS患者4个亚组及相同BMI下PCOS患者与非PCOS患者的一般情况,包括年龄、不孕原因、抗缪勒氏管激素(anti-Mullerian bormone,AMH)水平、基础内分泌水平和移植前子宫内膜厚度;实验室结局,包括获卵数、MII期卵母细胞数、受精率、D3优胚率、囊胚数和优质囊胚率;临床结局,包括胚胎种植率、妊娠率、活产率、妊娠期并发症发生率、流产率、早产率和胎儿出生体重。由于本中心于2018年开始大力推行单囊胚移植,双胎妊娠样本量较小,故只比较单胎妊娠结局。
1.3 统计学处理 采用SPSS 26.0和R 3.6.3统计软件。使用Kolmogorov-Smirnov检验确定样本是否符合正态分布。符合正态分布的计量资料以表示,方差齐时两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析;方差不齐时两组间比较采用Wilcoxon秩和检验,多组间比较采用Kruskal-Wallis H检验;不符合正态分布的计量资料以M(P25,P75)表示,两组间比较采用Wilcoxon秩和检验,多组间比较采用Kruskal-Wallis H检验。计数资料组间比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 不同BMI亚组PCOS患者一般情况比较 4组PCOS患者年龄、不孕原因、AMH水平、基础内分泌[基础卵泡刺激素(basal follicle stimulating hormone,bFSH)、基础黄体生成素(basic luteinizing hormone,bLH)、基础雌激素(basal estrogen,bE2)]、移植前子宫内膜厚度比较差异均无统计学意义(均P>0.05),见表1。
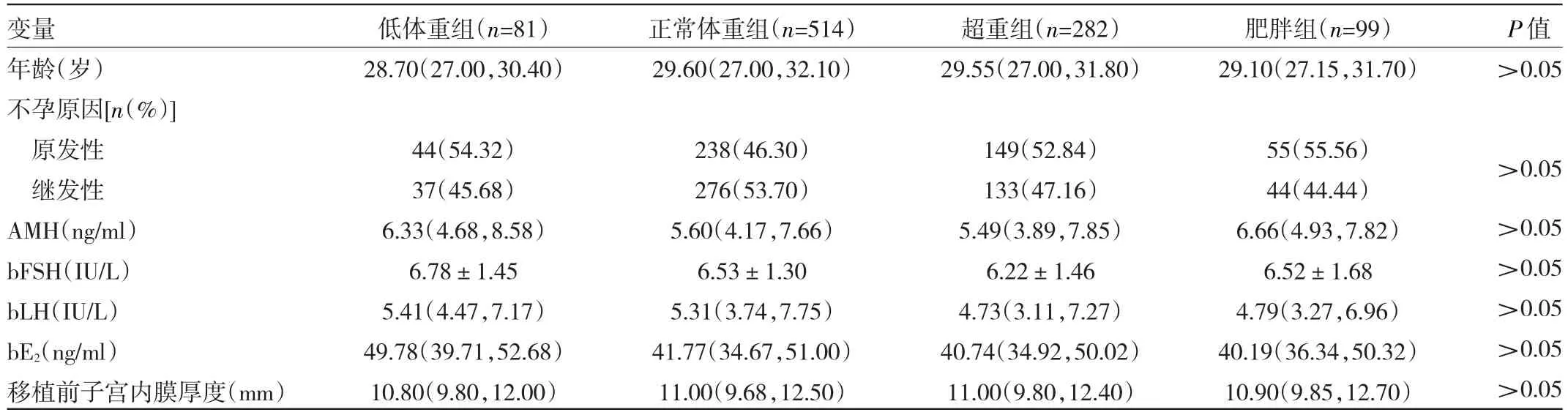
表1 不同BMI亚组PCOS患者一般情况比较
2.2 不同BMI亚组PCOS患者实验室及临床结局比较 随着BMI升高,获卵数、MⅡ期卵母细胞数、受精率和囊胚数出现明显梯度下降,优质囊胚率除肥胖组外也表现出梯度下降,超重儿出生率明显上升,差异均有统计学意义(均P<0.05),其余结果差异均无统计学意义(均P>0.05),见表2。

表2 不同BMI亚组PCOS患者实验室及临床结局比较
2.3 PCOS与非PCOS低体重组患者一般情况、实验室及临床结局比较 与非PCOS低体重组患者比较,PCOS低体重组患者获卵数、MⅡ期卵母细胞数和囊胚数均较高,差异均有统计学意义(均P<0.01);其余差异均无统计学意义(均P>0.05),见表3。
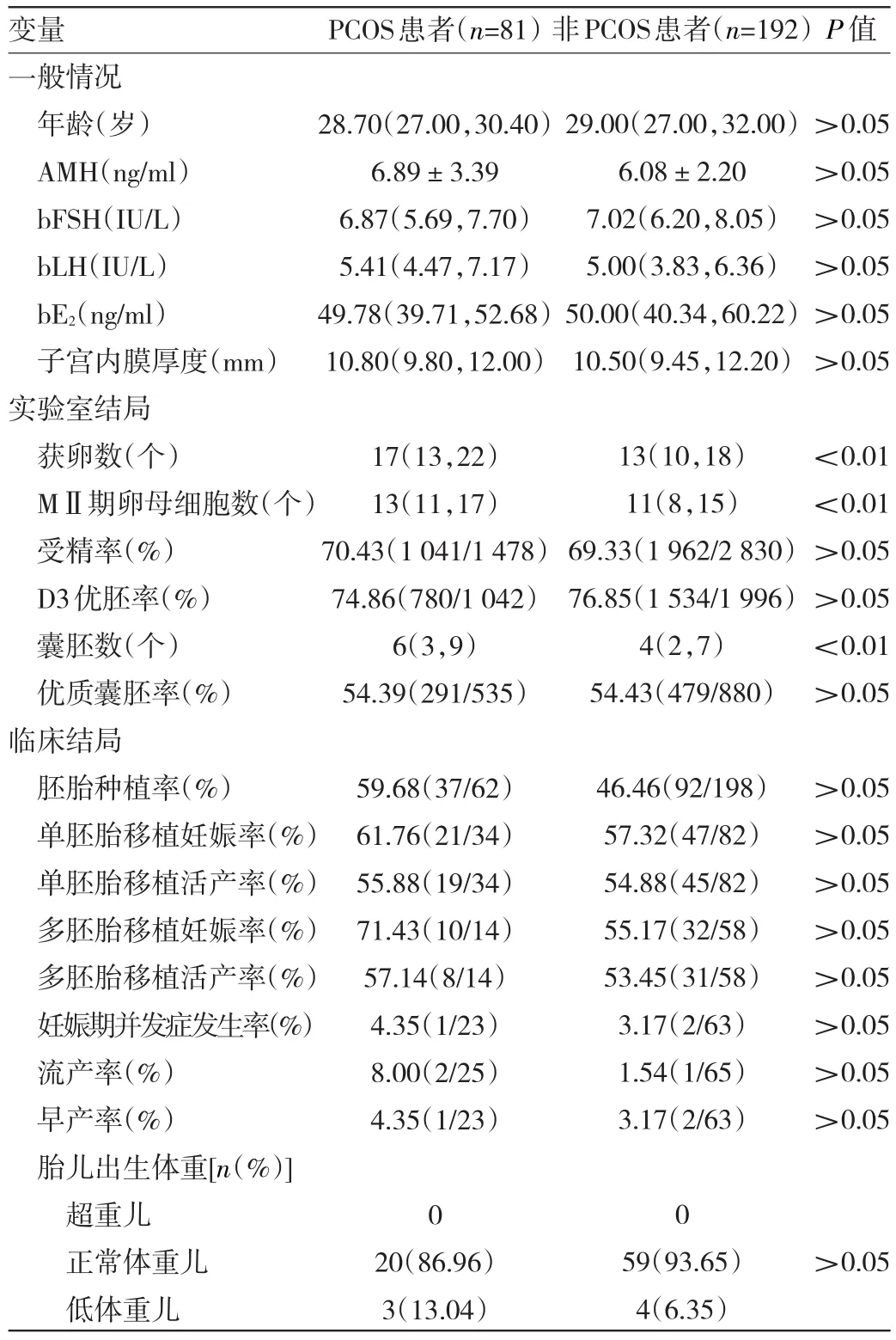
表3 PCOS与非PCOS低体重组患者一般情况、实验室及临床结局比较
2.4 PCOS与非PCOS正常体重组患者一般情况、实验室及临床结局比较 与非PCOS正常体重组患者比较,PCOS正常体重组患者bFSH、受精率、D3优胚率和优质囊胚率均较低,bLH、获卵数、MII期卵母细胞数和囊胚数均较高,差异均有统计学意义(均P<0.05);其余差异均无统计学意义(均P>0.05),见表4。
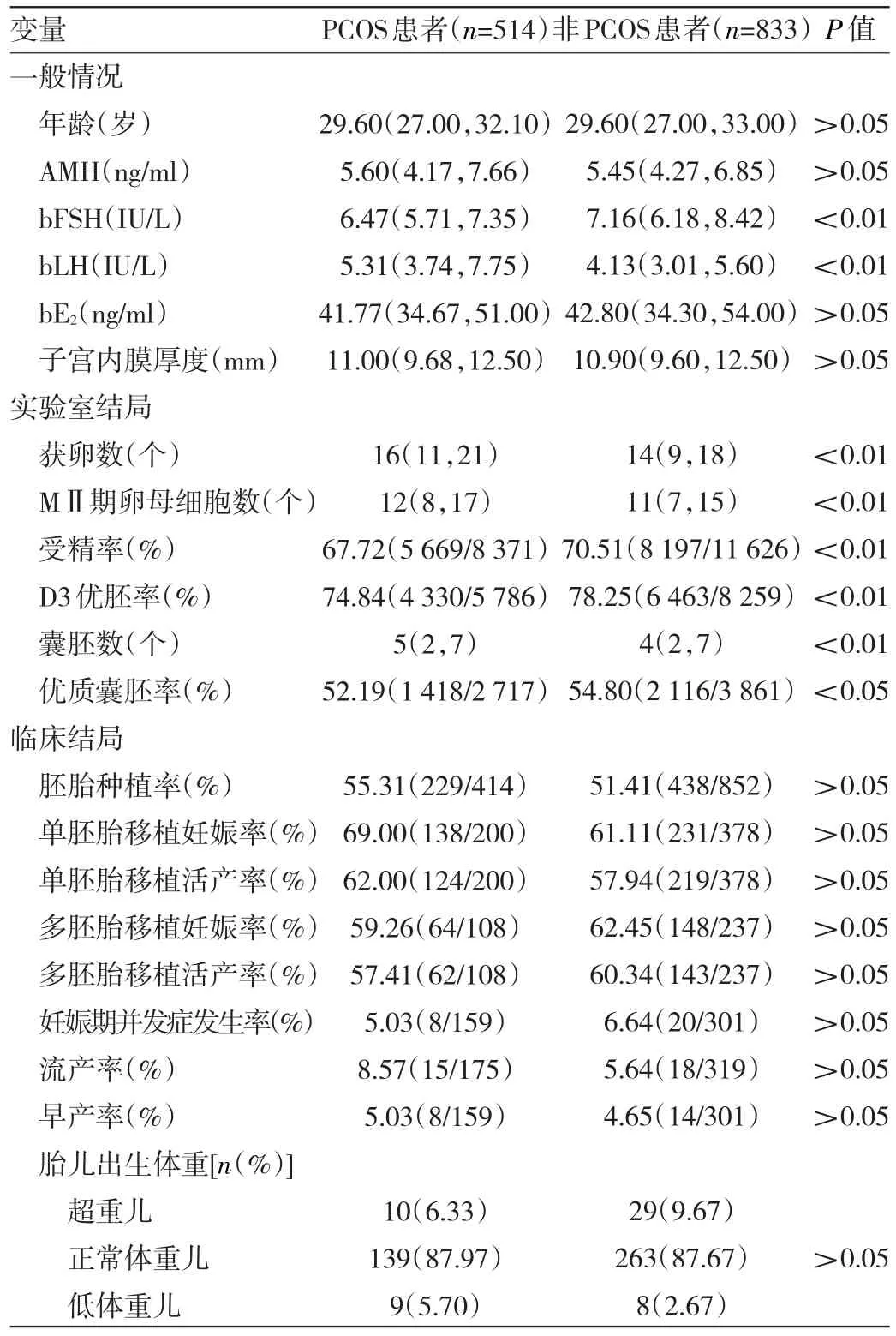
表4 PCOS与非PCOS正常体重组患者一般情况、实验室及临床结局比较
2.5 PCOS与非PCOS超重组患者一般情况、实验室及临床结局比较 与非PCOS超重组患者比较,PCOS超重组患者bFSH、D3优胚率和优质囊胚率均较低,bLH、获卵数、MⅡ期卵母细胞数和囊胚数均较高,差异均有统计学意义(均P<0.05);其余差异均无统计学意义(均P>0.05),见表5。
2.6 PCOS与非PCOS肥胖组患者一般情况、实验室及临床结局比较 与非PCOS肥胖组患者比较,PCOS肥胖组患者获卵数、MⅡ期卵母细胞数、D3优胚率和囊胚数均较高,差异均有统计学意义(均P<0.05);其余差异均无统计学意义(均P>0.05),见表6。
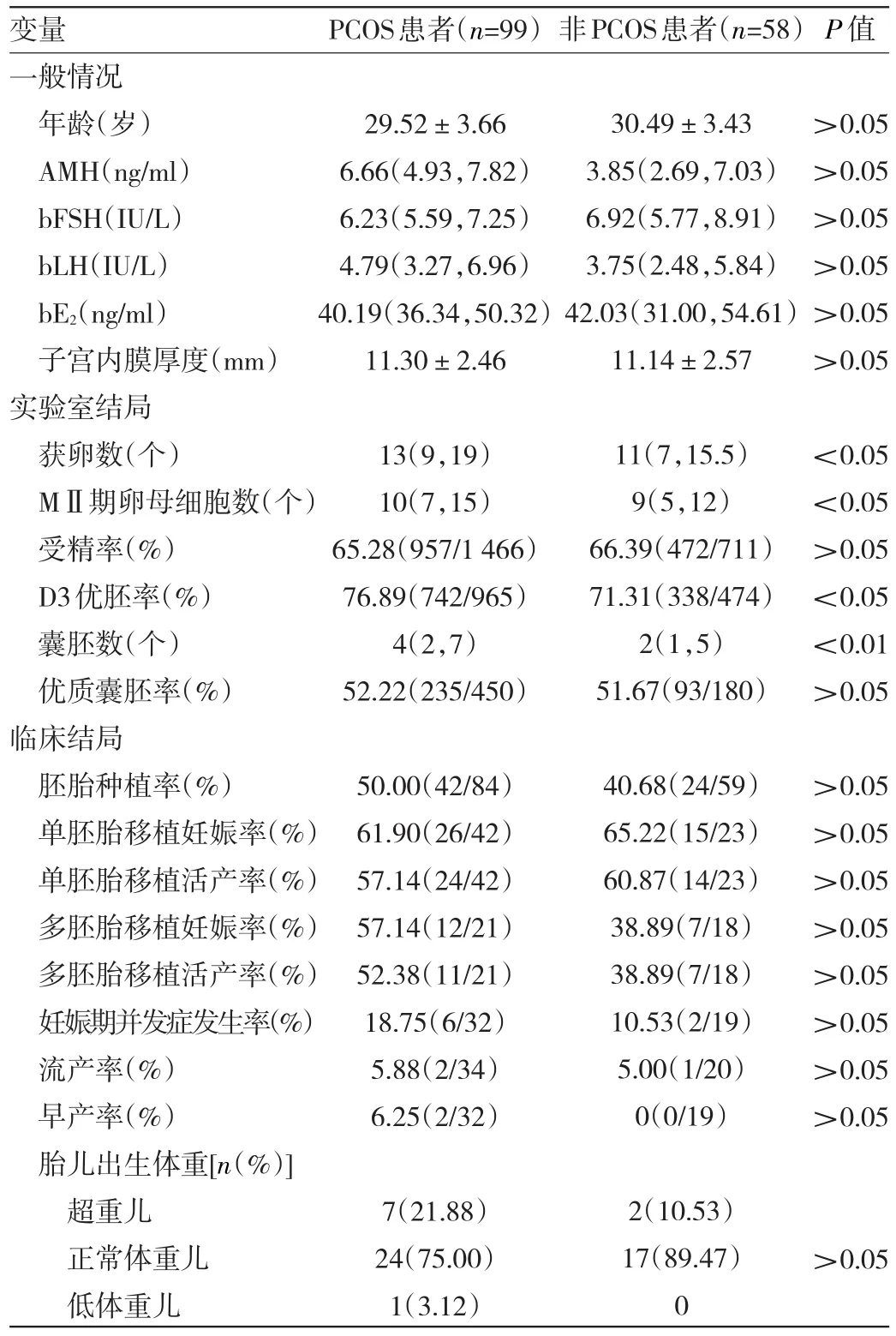
表6 PCOS与非PCOS肥胖组患者一般情况、实验室及临床结局比较
3 讨论
已有研究表明,BMI是影响辅助生殖结局的重要因素之一,肥胖会导致排卵率降低,其严重程度还与妊娠率呈负相关[15]。女性肥胖对体外受精后的活胎出生率有显著的负面影响[16]。基于3 079例行冷冻胚胎移植的PCOS患者的回顾性队列研究发现,BMI升高也与活产率呈负相关,高BMI女性的早期流产率更高,活产率更低[17]。另一项研究也证实高BMI(BMI≥24 kg/m2)和胰岛素抵抗与接受辅助生殖的PCOS患者自然流产的风险增加有关[18]。然而,本研究中,BMI升高对于使用早卵泡期超长方案的PCOS患者的妊娠率、流产率、早产率、活产率等妊娠结局的不良影响并未出现。虽然随着BMI升高,单胎妊娠PCOS患者中超重儿出生率出现明显升高,但与非PCOS对照组相比并无统计学差异。与之相对,PCOS患者组内获卵数、MⅡ期卵母细胞数、卵子受精率、囊胚数等与卵母细胞质量相关的实验室指标则随BMI升高出现明显梯度下降,优质囊胚率除肥胖组外也表现出随BMI升高而明显下降的趋势。这一结果解释了Luke等[19]的结论,即高BMI与临床妊娠失败率增加有关,但这种风险在使用自体卵母细胞时出现,可以使用供体卵母细胞降低。基于此,本研究更偏向于认为BMI升高对PCOS患者的影响主要在于卵巢,随着BMI升高,PCOS患者的获卵数与所获卵母细胞质量出现明显下降,这些质量较低的卵母细胞还表现出较低的受精率和优质囊胚率,这为PCOS患者辅助生殖治疗带来了一定的风险。
本次PCOS患者与非PCOS患者的研究结果进一步证实高BMI的危害。无论在哪个BMI亚组中,PCOS患者均表现出较非PCOS患者明显升高的获卵数、MⅡ期卵母细胞数和囊胚数,这与PCOS患者较正常妇女在月经卵泡期能募集更多卵泡有关。然而,除肥胖组外,随着BMI升高,PCOS其余3组基于对照组的获卵数、MⅡ期卵母细胞数和囊胚数优势逐渐减小,与非PCOS患者相近。与之相对,该3组虽然未出现明显临床结局的改变,但其D3优胚率和优质囊胚率却出现明显降低,且超重组优质囊胚率出现大幅下降。可能是由于获卵数大大高于普通人群,PCOS患者卵母细胞质量及优质囊胚率下降的风险被掩盖,从而在临床结局未表现出明显差异。事实上,早在2013年,Jungheim等[20]就在综述中提出高BMI影响体外受精结果的主要因素可能在于卵母细胞质量以及胚胎质量,而不是子宫内膜容受性,这一观点与本研究相符。令人意外的是,在肥胖组中,PCOS患者不仅表现出较高的获卵数、MⅡ期卵母细胞数、囊胚数,还表现出了更高的D3优胚率,据此推测,卵泡期超长方案对高 BMI(BMI≥28 kg/m2)PCOS 患者可能有更好的治疗效果。由于本研究肥胖组样本量较少,还需要更大样本的病例对照研究证实这一结果。
综上所述,本研究认为BMI升高对早卵泡期超长方案降调节的PCOS患者的主要影响为降低优质胚胎获得率,由于该影响会被PCOS获卵数多所掩盖,且在BMI≥28 kg/m2的患者中并未出现,因此并不影响临床结局,只能作为一个潜在的风险因素。目前,减重可以改善高雄激素血症、胰岛素抵抗、血脂异常、排卵障碍,提高生育能力已被许多研究所证实[21-23]。因此,本研究虽然仍建议育龄期PCOS患者常规控制体重,但在体重控制困难的情况下,特别是BMI已超过28 kg/m2时,可采用卵泡期超长方案保障妊娠结局。
注:PCOS为多囊卵巢综合征;AMH为抗缪勒氏管激素;bFSH为基础卵泡刺激素;bLH为基础黄体生成素;bE2为基础雌激素;D3为第3天

