精神分裂症患者CYP2D6*10基因多态性与血清利培酮浓度的量化关系研究
陈洁 宋明芬 闫盼 王姝琪 王晟东 王泽民 王玉文 施剑飞
精神分裂症是常见的重型精神病之一,在我国精神分裂症的终身患病率约为0.6%[1-3]。该病病程迁延,致残率高,易给患者、家庭和社会带来沉重的负担。利培酮是临床上广泛应用的非典型抗精神病药物之一,可有效改善患者的精神病性症状,但仍有部分患者治疗效果不理想。影响抗精神病药物疗效的因素众多,从药效动力学角度分析,主要因素首先是血液中的药物浓度。研究表明,利培酮主要经过肝脏中的细胞色素P450酶(cytochrome P450,CYP)2D6代谢分解为9-羟利培酮[4]。然而,CYP2D6代谢酶的功能具有很大的个体差异,这是因为编码酶的基因具有高度多态性,通过不同变异引起酶的功能改变[5]。其中CYP2D6*10是亚洲人群中最常见的突变位点[6]。已有研究表明,血清利培酮浓度在不同的CYP2D6*10基因型中差异显著[7],但是迄今为止未见两者间的量化关系报道。因此,本研究拟通过测定CYP2D6*10基因多态性,分析其对血清利培酮浓度的影响,初步建立不同CYP2D6*10基因型中血清利培酮浓度的量化模型并进行验证,为精神分裂症患者的精准用药提供依据。
1 对象和方法
1.1 对象 选取2019年5月至2022年5月杭州市第七人民医院收治住院的接受利培酮单一治疗的精神分裂症患者197例为研究对象。其中男123例,女74例;年龄20~58(40.36±15.18)岁;首次发病年龄14~51(26.21±9.59)岁;BMI(24.43±5.06)kg/m2;病程 11.00(5.00,20.50)年;吸烟36例;饮酒4例。纳入标准:(1)经2位临床精神科医师诊断、符合国际疾病分类第10版(ICD-10)中精神分裂症的标准;(2)年龄18~60岁;(3)精神分裂症急性发作期;(4)不接受任何物理治疗(如无抽搐电休克治疗、重复经颅磁刺激治疗等)。排除标准:(1)患严重脑、心、肝、肾、内分泌等躯体疾病者;(2)患其他类型精神疾病者;(3)精神活性物质滥用、成瘾者;(4)难治型精神分裂症;(5)合并用其他抗精神病药物者。本研究经杭州市第七人民医院医学伦理委员会审批通过,所有患者及家属均知情同意。
1.2 利培酮治疗方案 参照利培酮片(商品名:单克,规格:1 mg×30片,国药准字:H20050410,常州四药制药有限公司)说明书给予单药治疗,2次/d。起始剂量为1 mg/次,而后根据病情进行剂量调整,最大剂量不超过10 mg/d。
1.3 血清利培酮浓度检测 患者服用利培酮治疗4周后,于次日7:00服用晨药前抽取外周静脉血3 ml置于含分离胶和促凝剂的真空采血管中,由杭州佰辰医学检验所采用超高效液相色谱-串联质谱法进行血清利培酮浓度测定。色谱柱Waters XBridge C18,规格:100 mm×4.6 mm,3.5 μm;在35 ℃柱温下,进样10 μl进行测定。流动相乙腈-水(含0.1%甲酸)以流速1 ml/min进行梯度洗脱并完成质谱测定。临床上患者服用利培酮的剂量存在差异,而剂量影响血清利培酮浓度,因此,本研究将血清利培酮总活性产物浓度除以药物剂量(即每服用1 mg利培酮总活性产物血清药物浓度)作为基因型间血清利培酮浓度比较指标。
1.4 基因多态性测定 所有患者在血清利培酮浓度测定采血时,同时抽取外周静脉血2 ml于乙二胺四乙酸盐(EDTA)抗凝管中,-80℃冰箱保存备用。按照核酸提取纯化试剂盒(苏州旷远生物分子技术有限公司)说明书进行DNA提取及纯化;采用荧光PCR法检测患者CYP2D6*10基因型。仪器为美国应用生物系统(ABI)公司生产的Stepone Plus实时荧光PCR扩增仪。PCR扩增循环条件及荧光采集设置如下:50℃去污染2 min,95℃预变性3 min,以95℃20 s、62℃30 s的条件进行40个扩增循环,第11~40个循环结束时进行荧光信号采集;设置FAM和VIC双通道采集荧光信号,FAM检测通道选择CYP2D6*10 C等位基因,VIC检测通道选择CYP2D6*10 T等位基因。基因型分为CC型、CT型、TT型。
1.5 模型分组 采用随机数字表法将患者分为血清利培酮浓度预测模型的预测组99例和验证组98例,分别用于血清利培酮浓度预测模型构建和血清利培酮浓度预测模型的验证分析。
1.6 统计学处理 采用SPSS 25.0统计软件。符合正态分布的计量资料以表示,两组间比较采用两独立样本t检验;多组间比较采用单因素方差分析,两两比较采用LSD-t检验。不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用 Mann-Whitney U 检验;计数资料以率表示,组间比较采用χ2检验。采用逐步回归分析血清利培酮浓度的影响因素。采用曲线估计选取最佳拟合曲线得到预测血清利培酮浓度。采用Pearson相关分析预测血清利培酮浓度和实际血清利培酮浓度的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 CYP2D6*10各基因型患者每服用1 mg利培酮总活性产物血清药物浓度比较 本研究显示,CYP2D6*10各基因型患者每服用1 mg利培酮总活性产物血清药物浓度比较差异有统计学意义(P<0.01)。与CC型比较,CT型和TT型患者每服用1 mg利培酮总活性产物血清药物浓度均升高(均P<0.05);与CT型比较,TT型患者每服用1 mg利培酮总活性产物血清药物浓度明显升高(P<0.01),见表1。
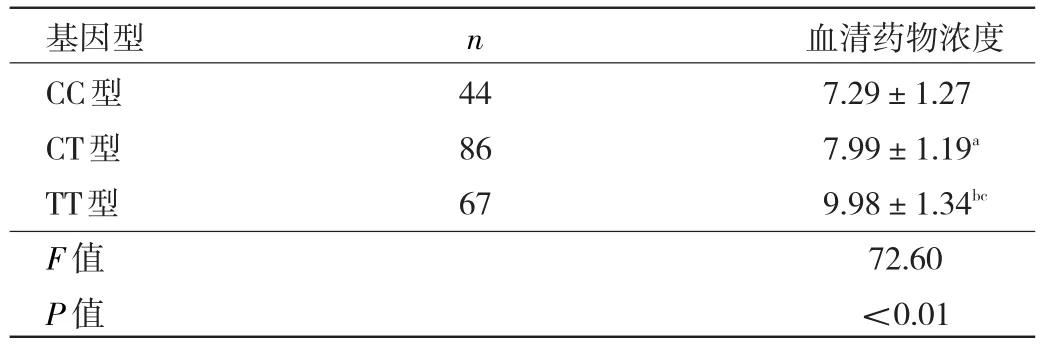
表1 CYP2D6*10各基因型患者每服用1 mg利培酮总活性产物血清药物浓度比较(μg·L-1·mg-1)
2.2 CYP2D6*10基因多态性与血清利培酮浓度量化关系分析
2.2.1 预测组和验证组一般资料比较 两组患者性别、年龄、病程、药物剂量及血清利培酮浓度比较差异均无统计学意义(均P>0.05),见表2。
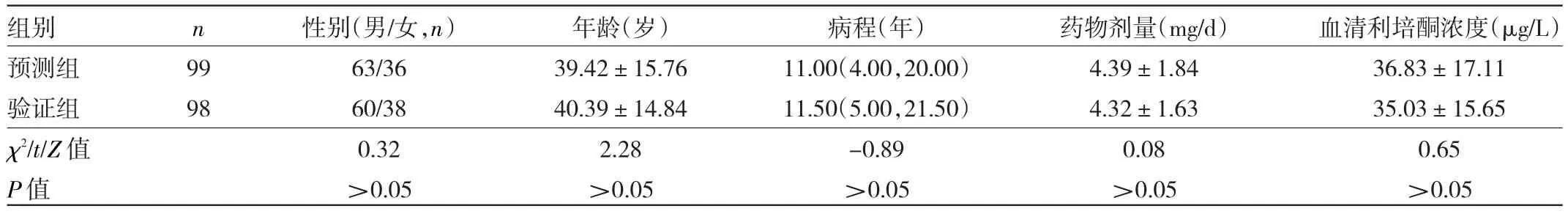
表2 预测组和验证组一般资料比较
2.2.2 血清利培酮浓度影响因素分析 血清利培酮浓度逐步回归分析结果提示,模型1中药物剂量与血清利培酮浓度显著相关(P<0.01);模型2中CYP2D6*10基因多态性与血清利培酮浓度显著相关(P<0.01),其他变量与血清利培酮浓度均无相关性(均P>0.05),见表3。

表3 血清利培酮浓度逐步回归模型结果
2.2.3 预测模型构建 结合影响因素分析结果,本研究根据CYP2D6*10基因多态性,建立药物剂量和血清利培酮浓度之间的曲线拟合函数。曲线拟合结果提示,药物剂量和血清利培酮浓度幂函数曲线拟合均最佳,拟合结果为r=0.84,P<0.01。具体公式如下,CYP2D6*10 CC型:血清利培酮浓度=6.63×药物剂量1.05;CYP2D6*10 CT型:血清利培酮浓度=9.92×药物剂量0.83;CYP2D6*10 TT型:血清利培酮浓度=10.87×药物剂量0.90。
2.2.4 预测模型验证 首先采用预测模型的幂函数公式对血清利培酮浓度进行计算,得出预测浓度。然后对预测血清利培酮浓度和实际血清利培酮浓度进行相关分析,提示预测血清利培酮浓度和实际血清利培酮浓度之间高度相关(r=0.81,P<0.01),见图1。
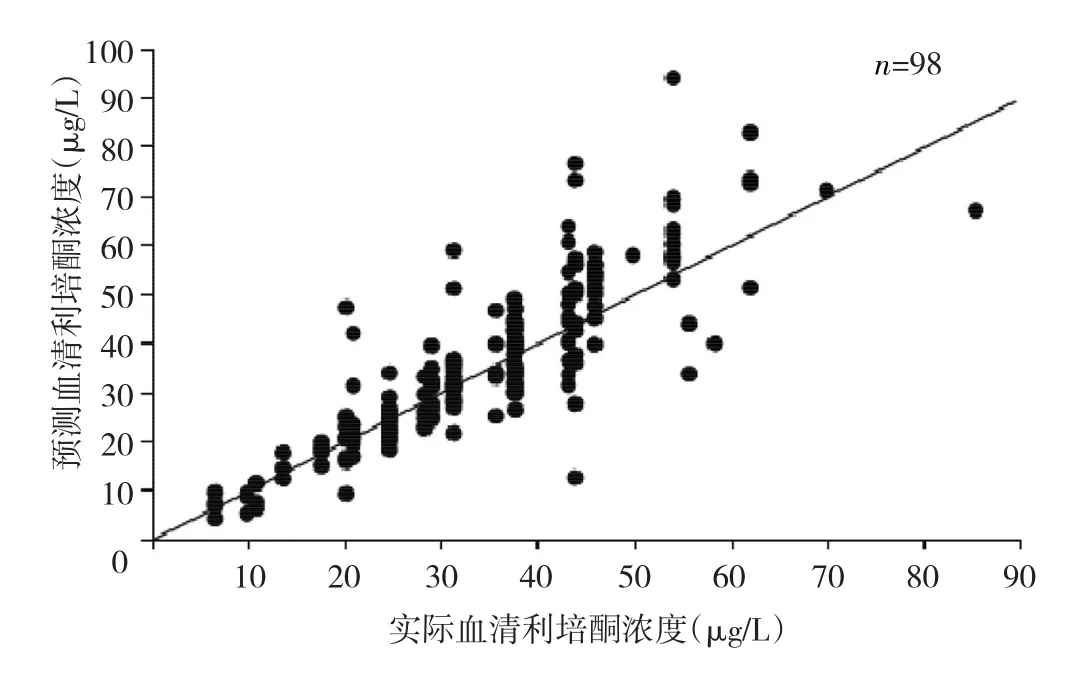
图1 血清利培酮浓度预测结果与实际结果比较
3 讨论
CYP2D6是利培酮代谢反应中最主要的酶,其基因位于人类22号染色体q13.1上,编码497个氨基酸,有100多个等位基因的变异[8-9]。这些变异包括单个碱基缺失或插入、碱基替换、大片段基因丢失等,可以导致酶活性的变化,从而影响药物代谢。根据CYP2D6基因型的不同所导致被翻译的酶活性的差异,可将患者分为慢代谢型、中等代谢型、快代谢型、超快代谢型[10],其中慢代谢型被认为是无酶活性,中等代谢型是酶活性降低,快代谢型是正常酶活性,超快代谢型则是酶活性升高。CYP2D6的基因多态性具有地域和种族差异,研究表明在亚洲人群中主要的突变等位基因是 CYP2D6*10(100C>T)[6,11]。根据突变形式,可将CYP2D6*10的基因型分为CC型、CT型、TT型3类。
本研究显示,除药物剂量外,CYP2D6*10是影响血清利培酮浓度的主要因素,血清利培酮浓度从低到高顺序依次为CC型、CT型、TT型,提示可能是CYP2D6*10基因突变引起代谢酶活性降低,从而使血清利培酮浓度升高。Jukic等[12]研究表明,与快代谢者相比,慢代谢者体内的活性利培酮可提升1.6倍(OR=1.568,95%CI:1.401~1.736)。Zhang等[13]研究表明,与快代谢者的活性利培酮浓度比较,中等代谢者高1.18倍(95%CI:1.11~1.25,P<0.01),慢代谢者高 1.44倍(95%CI:1.23~1.69,P<0.01)。本研究结果与目前的大部分报道一致[14-16]。理论上,慢代谢型患者因为清除速率慢,给予较小的药物剂量就可以达到一定疗效,而快代谢型患者清除速率快,需要高于正常的药物剂量才能达到治疗所需的血清药物浓度。以上报道虽然得出CYP2D6*10基因多态性是影响血清利培酮浓度的因素,而且可根据其基因型进行适当的利培酮药物剂量增减,但是增减的程度无具体数据支撑,很难用于临床实践。
本研究对血清利培酮浓度、药物剂量、CYP2D6*10基因多态性之间进行了量化分析,得出了不同CYP2D6*10基因型的血清利培酮浓度与利培酮药物剂量之间存在幂函数曲线拟合(r=0.84,P<0.01)。模型验证中,预测血清利培酮浓度和实际血清利培酮浓度之间高度相关(r=0.81,P<0.01)。指南及部分研究根据利培酮治疗精神分裂症的疗效以及不良反应,得出血清利培酮浓度的治疗窗为20~60 μg/L[17-18],利用本研究的量化模型,可以计算出适合每例患者的利培酮服药剂量范围。另外,本研究认为,拟采用利培酮进行治疗的患者,服药前进行CYP2D6*10基因型检测,可预先了解该患者对药物代谢的速度,初步判定在一定量利培酮服用下其血清浓度,避免血清利培酮浓度过高或者过低,引起严重的不良反应或者达不到药物起效的阈值。
综上所述,本研究揭示了不同CYP2D6*10基因型的血清利培酮浓度与利培酮剂量的量化关系,为精神分裂症患者利培酮的个体化治疗提供一定的指导。本研究尚有一些不足之处,如未探讨其他次要代谢酶基因位点、样本量偏少等,今后有待探索更多的基因多态性位点并扩大样本量进行深入研究。

