乐都紫皮大蒜4种病毒多重RT-PCR检测技术的建立
张 超,董怡衡,岳 苗,卫 唯,张 谦,王 乐,尹 卫,王煜伟,梁 健
(青海大学 省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁 810016)
大蒜(AlliumsativumL.)属百合科葱属植物,其主要生殖方式为无性繁殖,通常采用鳞茎繁殖。但无性繁殖会使病毒在大蒜营养器官中积累,并通过母体鳞茎垂直传染给子代,导致大蒜种性退化,产量下降。
大蒜病毒常呈复合性侵染出现,侵染后的鳞茎发育迟滞、品质变差,严重影响大蒜的经济价值。本课题组通过对青海乐都紫皮大蒜进行全长转录组测序发现,乐都紫皮大蒜被洋葱黄矮病毒(onion yellow dwarf virus,OYDV)、大蒜潜隐病毒(garlic latent virus,GLV)、大蒜D病毒(garlic virus D,GarVD)和大蒜X病毒(garlic virus X,GarVX)4种病毒复合侵染。目前,已报道的侵染葱属植物的病毒性病原主要有3大类,其中洋葱黄矮病毒属于第一大类马铃薯Y病毒属(Potyvirus),由Giddings和Henderson等于1916年在洋葱植株上发现,主要表现为植株矮化和叶片黄化[1-2],此后该病毒在世界范围内广泛传播[3]。大蒜潜隐病毒属于第二大类香石竹潜隐病毒属(Carlavirus),最早由van Dijk[4]在1993年发现,该病毒主要由蚜虫以非持久方式传播,其为单链正义RNA 病毒,基因组RNA包裹在长610~690 nm 的线状病毒粒子中,在荷兰、中国、德国和日本等都有报道[5-7];大蒜X病毒和大蒜D病毒属于第三大类青葱X病毒属(Allexivirus)。1995年Arshava等[8]确定了青葱X病毒属的成员,其中大蒜X病毒(GarVX)是一种单链正义RNA病毒,侵染范围很广,危害超过65种农作物和观赏植物[9-13];陈炯等[14]研究发现,大蒜X病毒与大蒜D病毒的序列相似性较高,且我国境内已鉴定的大蒜X病毒与大蒜D病毒均具有较高的相似性。
大蒜病毒的检测方法有多种,包括传统的指示植物法、酶联免疫吸附测定法(ELISA),以及现有的病毒血清学鉴定、电镜法和分子生物学方法等相关技术。在分子生物学方法中,聚合酶链式反应法因其灵敏度高、特异性强,被广泛应用于病毒的检测和鉴定[15-17]。在本研究所涉及的4种病毒中,洋葱黄矮病毒的检测多通过RT-PCR和ELISA方法进行[18];大蒜潜隐病毒检测则采用较为传统的指示植物法和DAS-ELISA法,但需使用RT-PCR进一步提高检测的特异性与灵敏度,避免假阳性[19];大蒜X病毒(GarVX)与大蒜D病毒(GarVD),可使用反转录环介导等温扩增技术( RT-LAMP) 进行检测。前期部分研究已针对大蒜病毒开展了多重检测体系的开发工作,如许蕊等[20]在甘肃‘成县迟蒜’上针对GLV、LYSV、OYDV 3种病毒所建立的多重检测方法;汪沛[21]在湖南长沙、茶陵感病大蒜上针对OYDV、 LYSV、SLV、Allexiviruses 4种病毒建立了检测方法。相较于单一RT-PCR,多重RT-PCR实现了一次反应多目标同时检测,可提高效率,降低检测成本。为此,本研究通过优化引物设计和反应条件,建立了一种可同时检测乐都紫皮大蒜OYDV、GLV、GarVD和GarVX 4种病毒的多重RT-PCR技术体系,以期为乐都紫皮大蒜病毒快速检测、脱毒效果判定等实际需求提供技术支持。
1 材料与方法
1.1 材 料
本研究以青海乐都紫皮大蒜,以及从重庆(CQ)、云南(YN)、安徽(AH)、新疆(XJ)、内蒙古(NMG)、张掖(ZY)、四川(SC)、山东(SD)、天津(TJ)、海南(HN)、辽宁(LN)和贵州(GZ)12个地区引入青海乐都种植的大蒜品种为试验材料。于生长盛期采集大蒜叶片,迅速置于液氮中速冻,带回实验室后转入-80 ℃冰箱保存备用。
1.2 乐都紫皮大蒜叶片总 RNA 提取
采用天根RNAprep 总RNA抽提试剂盒提取乐都紫皮大蒜叶片总RNA,吸取2 μL用于凝胶电泳,检测RNA完整性。测定浓度后分装备用。
1.3 RT-PCR检测
1.3.1 RT-PCR引物设计 根据NCBI中收录的OYDV病毒外壳蛋白基因序列[20],以及通过全长转录组测序获得的病毒(GLV、GarVD和GarVX)序列[22],利用Oligo 6.0 软件设计引物。GLV病毒有6条相关序列(2760、21764/1564、2396、2186、2817、2810),设计7对引物;GarVD有1条相关序列(3228),GarVX有1条相关序列(3916),各设计3对引物。以上序列提交至GenBank,序列号为:OM304365~OM304372,序列引物信息详见表1。
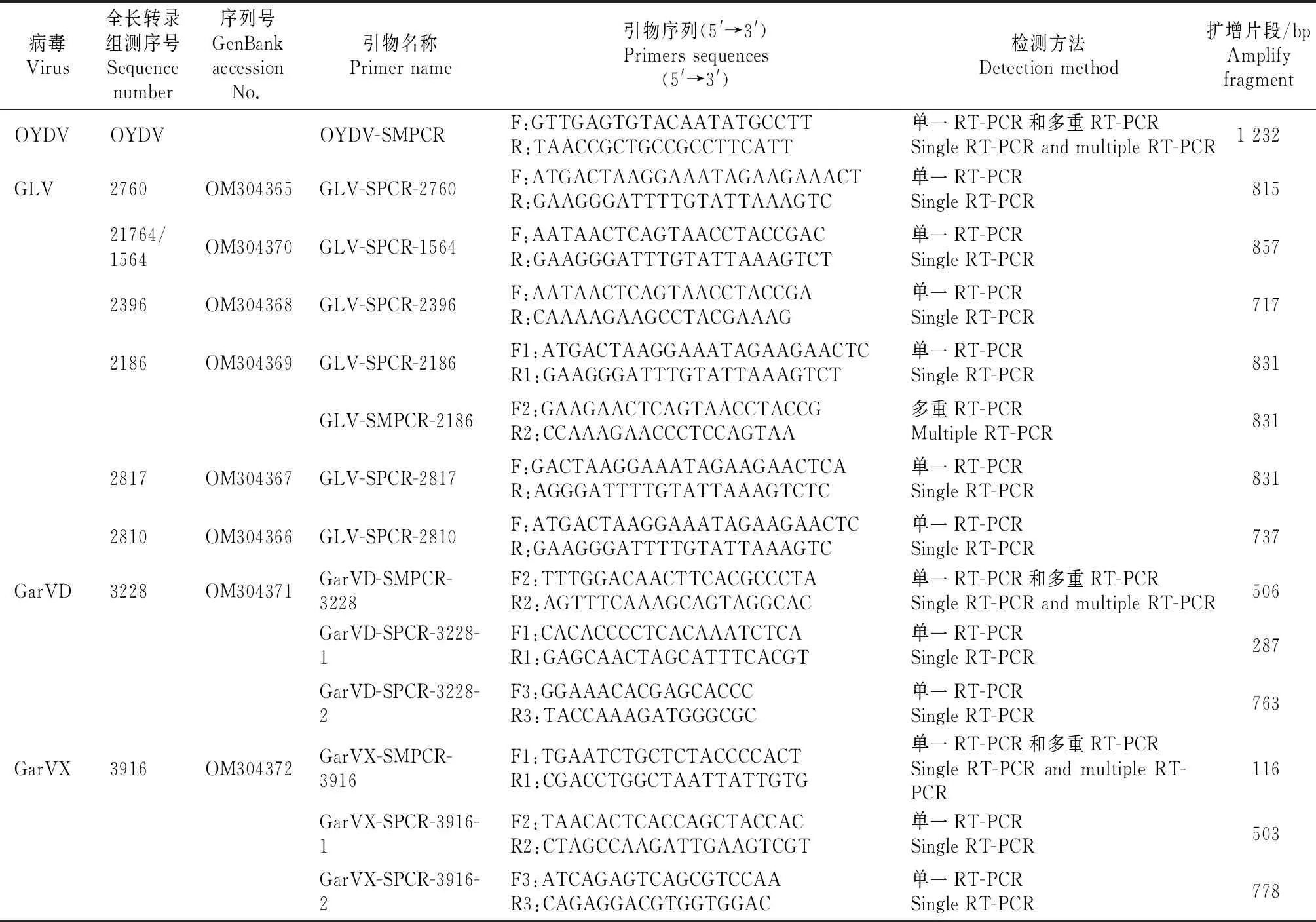
表1 本研究所用引物信息
1.3.2 单一RT-PCR反应体系及反应程序 单一RT-PCR反应体系:cDNA 2 μL,上下游引物各1 μL,EX-taq酶(TaKaRa公司)12.5 μL,ddH2O 8.5 μL,共25 μL。反应程序:95 ℃预变性 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。电泳检测PCR产物。
1.3.3 多重 RT-PCR反应条件的优化 多重RT-PCR体系先筛选引物,退火温度设置为54,55,57,59 ℃;cDNA模板体积设置为1.5,2.0,2.5,3.0 μL;先等量混合上下游8条引物,向PCR体系中分别加0.5,1.0 μL。根据以上参数优化反应条件。
1.3.4 多重RT-PCR反应体系及反应程序 将最优GLV引物、GarVD引物、GarVX引物及OYDV引物共4对多重RT-PCR引物,按体积比1∶1混合得到混合引物(表1)。多重RT-PCR反应体系:模板体积2.5 μL(分别为乐都紫皮大蒜cDNA和12个不同品种大蒜资源的cDNA),混合上下游引物各1 μL,EX-taq酶12.5 μL,ddH2O补充至25 μL。多重RT-PCR反应程序与单一RT-PCR基本相同,唯一不同的是延伸环节为72 ℃延伸90 s。电泳检测PCR产物。
单一RT-PCR和多重RT-PCR的扩增产物亚克隆至pMD20-T载体,挑选阳性克隆测序后进行序列分析。
1.3.5 多重RT-PCR的灵敏度测定 取1 μL乐都紫皮大蒜cDNA,按10倍稀释度逐级稀释成5个浓度梯度(10-1,10-2,10-3,10-4,10-5),每个浓度取1 μL cDNA为模板分别进行单一和多重RT-PCR扩增,电泳检测PCR产物,测定反应灵敏度。
2 结果与分析
2.1 乐都紫皮大蒜叶片总RNA的提取
提取的乐都紫皮大蒜叶片总RNA电泳后可见28S、18S、5.8S 3条清晰条带。经OD260/OD280检测,乐都紫皮大蒜叶片RNA的质量浓度为5 114.3 ng/μL,OD260/OD280为2.0,可用于后续试验。
2.2 乐都紫皮大蒜4种病毒的单一RT-PCR
以乐都紫皮大蒜cDNA为模板,用单一RT-PCR扩增OYDV、GLV、GarVD和GarVX病毒。OYDV引物扩增产生的目的条带单一明亮,条带大小为1 232 bp(图1),可作为后续多重PCR的引物。GLV病毒的电泳结果显示,条带均单一、明亮、清晰,条带大小为750~1 000 bp(图2)。从GLV的6条电泳结果中选取全长转录组测序号2186的引物进行后期的多重PCR。用GarVD和GarVX引物进行扩增(每个3对,共6条),GarVD的D-1为287 bp,D-2为506 bp,D-3为763 bp;GarVX的X-1为116 bp,X-2为503 bp,X-3为778 bp,条带单一明亮,均可作为后续多重PCR的备选引物(图3)。
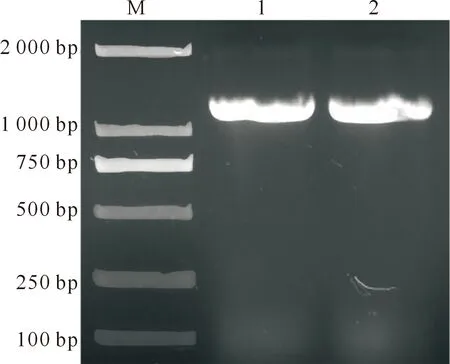
M.DNA Marker;1~2.OYDV病毒单一RT-PCR

M.DNA Marker;1.GLV 2760;2.GLV 21764/1564;3.GLV 2396;4.GLV 2186;5.GLV 2817;6.GLV 2810;7.GarVD 3228;8.GarVX 3916
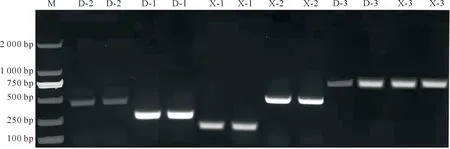
M.DNA Marker;D-2.GarVD-SMPCR-3228引物单一RT-PCR;D-1.GarVD-SPCR-3228-1引物单一RT-PCR;X-1.GarVX-SMPCR-3916引物单一RT-PCR;X-2.GarVX-SPCR-3916-1引物单一RT-PCR;D-3.GarVD-SPCR-3228-2引物单一RT-PCR;X-3.GarVX-SPCR-3916-2引物单一RT-PCR
2.3 乐都紫皮大蒜4种病毒的多重RT-PCR
用单一RT-PCR验证后,选取GLV病毒的GLV-SMPCR-2186引物,同时加入GarVD病毒的GarVD-SMPCR-3228引物、GarVX病毒的GarVX-SMPCR-3916引物和OYDV病毒的OYDV-SMPCR 引物进行4种病毒的多重PT-PCR,模板为乐都紫皮大蒜cDNA。条件优化结果显示:在同一体系下改变模板浓度与PCR的退火温度进行体系优化,在54~59 ℃中,55 ℃下条带最明显,故选定55 ℃为多重RT-PCR反应的退火温度(图4);cDNA模板使用量为1.5~3.0 μL进行优化时,差异不明显,经多次对比,选定2.5 μL为最优浓度(图5);引物浓度从0.5 μL至1.0 μL间最优的为1.0 μL(图6)。因此,最终确定多重RT-PCR的最佳反应条件为:退火温度55 ℃,模板用量2.5 μL,引物用量各1.0 μL。

M.DNA Marker

M.DNA Marker
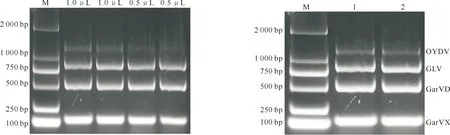
M.DNA Marker
在此条件下,在一个反应体系中稳定扩增获得了条带大小分别为1 232 bp(OYDV),831 bp(GLV),506 bp(GarVD)和116 bp(GarVX)的PCR产物,成功构建了乐都紫皮大蒜4种病毒的多重RT-PCR体系(图7)。
2.4 乐都紫皮大蒜4种病毒多重RT-PCR的灵敏度检测
对梯度稀释的乐都紫皮大蒜样品cDNA进行单一和多重RT-PCR的灵敏度检测。结果(图8)显示,单一PCR反应中,OYDV的检测限为10-2稀释梯度,GLV的检测限为10-4稀释梯度,GarVD的检测限为10-3稀释梯度,GarVX的检测限为10-1稀释梯度。多重RT-PCR反应中,OYDV、GLV、GarVD和GarVX的检测限分别为10-2,10-3,10-2,10-1稀释梯度,可见多重RT-PCR检测的灵敏度略低于单一RT-PCR。

M.DNA Marker;A、B、C、D分别是OYDV、GLV、GarVD和GarVX的单一PCR扩增;E是4种病毒的多重PCR扩增
2.5 12份大蒜种质资源的多重RT-PCR检测
为验证本试验所构建多重PCR检测方法的有效性,本研究选取从省外引进的12种大蒜资源进行了病毒多重PCR检测,结果见图9和图10。
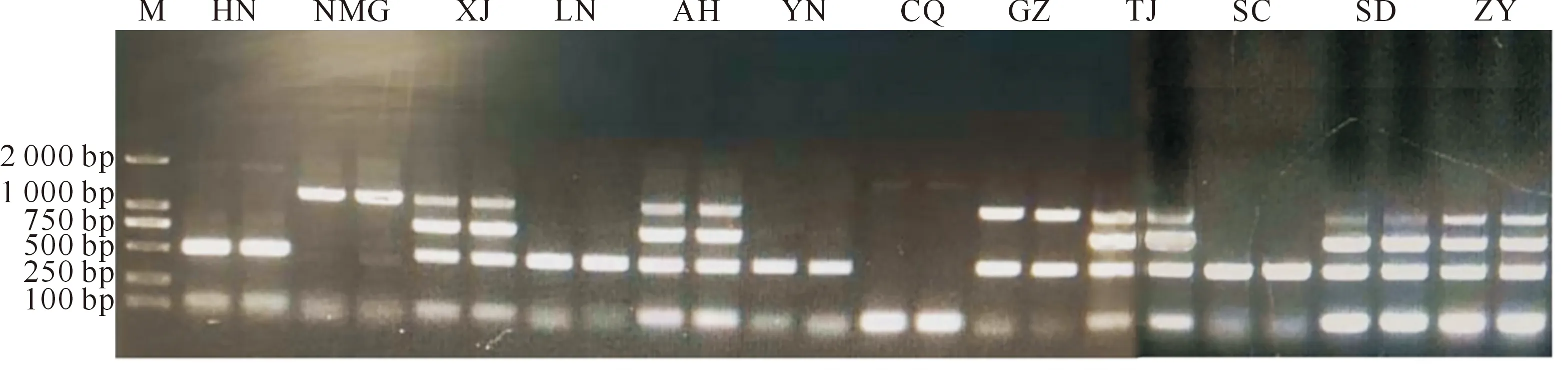
M.DNA Marker;HN.海南;NMG.内蒙古;XJ.新疆;LN.辽宁;AH.安徽;YN.云南;CQ.重庆;GZ.贵州;TJ.天津;SC.四川;SD.山东;ZY.张掖

M.DNA Marker;HN-O.海南OYDV病毒;HN-L.海南GLV病毒;CQ-D.重庆GarVD病毒;CQ-O.重庆OYDV病毒;CQ-L.重庆GLV病毒;SC-X.四川GarVX病毒;SC-L.四川GLV病毒;SC-O.四川OYDV病毒;NMG-L.内蒙古GLV病毒;NMG-X.内蒙古GarVX病毒;NMG-O.内蒙古OYDV病毒;GZ-L.贵州GLV病毒;GZ-X.贵州GarVX病毒;LN-L.辽宁GLV病毒;LN-O.辽宁OYDV病毒;LN-X.辽宁GarVX病毒;YN-L.云南GLV病毒;YN-O.云南OYDV病毒;YN-X.云南GarVX病毒
图9显示,XJ、AH、TJ、SD、ZY引种大蒜出现4条明显条带,表示以上5种资源同时存在OYDV、GLV、GarVD和GarVX 4种病毒侵染;HN、LN和YN大蒜出现2条明显条带,均是GarVX和GarVD病毒;GZ大蒜出现2条明显条带,分别是OYDV和GarVD病毒;NMG、CQ、SC大蒜仅出现1条明显条带,表示这3种引种大蒜只存在1种病毒侵染,其中NMG资源被OYDV病毒侵染,CQ资源被GarVX病毒侵染,SC资源被GarVD病毒侵染。
对于没有同时出现4种病毒的7种资源,再针对未出现条带的病毒进一步做单一RT-PCR检测。结果表明,除多重PCR结果外,显示NMG资源也可能存在GarVX病毒;其他资源中,在多重PCR中未检出的病毒在单一PCR中均未检测出来(图10)。对LN和YN 2种资源中是否存在GarVX病毒也进行了验证,确认这2种资源存在该病毒,证实了多重PCR的有效性和准确性。
3 讨 论
以鳞茎作为繁殖体的无性繁殖方式易导致种性退化,且退化问题的产生与病毒的代际传播密切相关,随着繁殖代数增加,病毒在鳞茎中不断累积,进而导致病害蔓延和种性弱化[23]。病毒引发的种性退化问题不仅对大蒜有影响,也对马铃薯[24]、百合[25]、山药[26]、红薯[27]等地下茎作物有重要影响。加之生产中存在“卖大留小”的不良留种习惯,使得种性好、抗性强的“种子”进入消费流通,而卖相差、病毒多的鳞茎被用于生产种植[28]。因此,大蒜种性退化是无性繁殖方式导致病毒积累和不良留种习惯综合作用的结果。
病毒对大蒜的危害严重,病毒感染可导致大蒜产量损失高达20%,严重时超过50%。葱属植物受病毒侵染的情况非常普遍,病毒侵染后引起大蒜产量和品质下降的问题是农业生产中的一个重要难题。大蒜为无性繁殖,常常由于鳞茎母体受到病毒感染,并能垂直传递到子代,因此一旦大蒜受到病毒感染便难以脱毒,最终导致毁种[29]。大蒜病毒因其多样性,故在不同地区侵染的程度也是不一致的,大蒜病毒侵染的复杂性及多样性在不同地区存在差异,侵染的病毒种类随地区和品种变化也表现出差异性。侵染甘肃大蒜的病毒主要为GLV和OYDV[20];侵染湖南大蒜的病毒主要为Allexiviruses、OYDV、LYSV、SLV 4种[30];侵染河南大蒜的病毒主要为LYSV[31]。从种类上看,GLV和OYDV是危害我国大蒜的主要病毒[32-35],而GarVX和GarVD的出现频次相对较低。本研究通过对乐都紫皮大蒜全长转录组测序中筛选得到的病毒序列进行分析,确认了侵染乐都紫皮大蒜的X病毒和D病毒。这2种病毒通常以复合形式侵染植株,具有较高的相似性和相同的寄主范围,常规方法难以区分[36-38],用多重RT-PCR方法有效解决了这一难题。本研究还发现,包括乐都紫皮大蒜在内的共13种大蒜资源中,GarVD侵染的频率最高,为85%;其次为OYDV和GarVX,频率为69%;GLV侵染频率最低,为46%;说明青葱X病毒属和OYDV对乐都紫皮大蒜的影响比GLV的侵染性更为广泛。
驯化栽培过程中,连作所造成的病毒累积影响了大蒜品质和产量,因此大蒜病毒的检测尤为重要。多重 RT-PCR能够在同一体系中同时特异性扩增多个片段,但加入体系的多对引物之间也会产生配对、竞争性扩增等问题[39],因此引物是影响多重RT-PCR检测体系建立最为重要的因素[40-45]。体系构建时,要充分考虑引物间的不同退火温度和引物间的作用,防止非特异性扩增和引物二聚体的出现。相较于单一RT-PCR,多重RT-PCR不管是在时间还是在准确性方面,都是最为有效、成本更低的技术选项[46]。目前常见的多重RT-PCR可同时检测2种或3种病毒[47-51]。本研究采用单一RT-PCR及多重RT-PCR对GLV、GarVX、GarVD和OYDV 4种病毒进行检测和验证,可进一步提高检测效能。
本研究根据乐都紫皮大蒜RNA全长转录组测序结果,得到病毒外壳蛋白序列并设计筛选了引物进行多重RT-PCR体系开发,通过灵敏度试验,确定了每种病毒的检测限。本试验建立的4种病毒多重RT-PCR体系,可准确、稳定、有效地进行病毒的单一和复合侵染检测,为大蒜病原鉴定、发病率统计、脱毒效果验证和检测提供技术支持。

