多发结节型脾脏窦岸细胞血管瘤的影像表现与病理对照分析
李莹, 杨文兵, 柯晓康
脾脏窦岸细胞血管瘤(littoral cell angioma,LCA)是一种罕见的脾脏原发性血管肿瘤,由于同时表达内皮细胞和组织细胞标记,被认为起源于脾脏红髓的窦岸细胞,故因此命名[1]。LCA患者通常无特异性临床症状,多由体检发现,表现为脾大、不明原因发热、贫血和血小板减少等,临床容易误诊。目前国内外报道LCA病例数较少,且多为个案报道。本文回顾性分析6例经病理证实的LCA患者的临床及影像学资料,并结合文献进行总结分析,以提高对该病的认识。
材料与方法
1.病例资料
回顾性分析2013年10月-2021年12月本院6例行上腹部CT和/或MRI检查并经手术病理证实的脾脏LCA患者的临床及影像资料(表1),6例患者中男2例,女4例,年龄40~64岁,中位年龄46.5岁。6例患者中3例因腹部不适入院检查,其中2例无明显诱因,1例表现为进食后腹部不适;2例因体检行腹部彩超发现;1例在胃神经内分泌瘤内镜粘膜下剥离术(Endoscopic submucosal dissection,ESD)后复查发现。

表1 6例LCA患者的临床资料
实验室检查:6例行肿瘤标志物检查均正常,1例泌乳素水平增高达25.53 ng/mL(正常值为4.79~23.3 ng/mL),4例红细胞及血红蛋白不同程度减少,另2例患者无脾亢进及贫血表现。
2.检查方法
6例患者均行CT平扫及增强扫描,其中2例进行了MRI检查,4例行超声检查。CT检查采用美国HD750 64层CT或Revolution CT扫描仪,管电压120 kV,管电流250 mAs,扫描层厚、层间距均为5 mm,重建层厚、层间距均为0.625 mm。CT增强扫描采用高压注射器经肘静脉以3 mL/s的流率团注对比剂60~80 mL,注射后30 s、60 s分别行动脉期、门静脉期增强扫描。MRI检查采用美国GE HD750 3.0T MR扫描仪,扫描上腹部序列:横轴面正反相位屏气的快速扰相梯度回波T1WI、脂肪抑制的快速自旋回波T2WI,MRI增强扫描经肘静脉以2 mL/s流速团注对比剂钆双胺,剂量为0.2 mL/kg,应用肝脏容积快速采集(liver acquisition with volume acceleration,LAVA)序列,分别于注射对比剂后20 s、60 s、80 s进行扫描。
结 果
1.CT及MRI表现
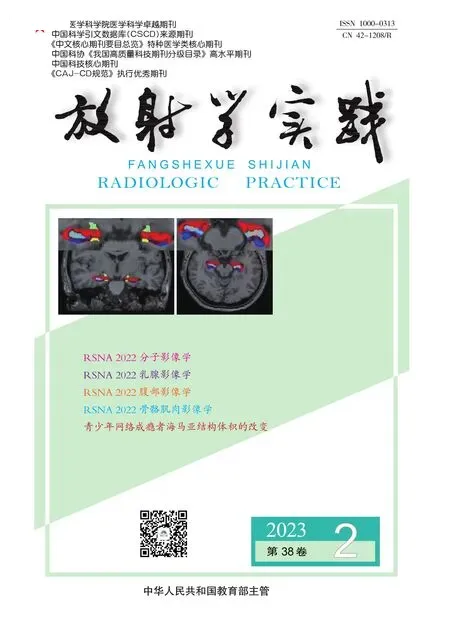
6例LCA中3例脾脏体积增大,另3例大小正常。本组6例患者均表现为脾脏内多发大小不等病灶,病灶大小0.6~3.2 cm,其中4例病灶在脾脏内呈弥漫性分布(病灶数目≥10)。CT平扫病灶呈等或稍低密度影,增强动脉期病灶呈斑点或斑片状强化,部分小病灶(直径小于2.0 cm)与周围脾脏实质的花斑状强化分界不清,静脉期脾脏实质呈均匀性强化,在平扫或动脉期显示欠清的病灶被凸显出来;对于直径大于2.0 cm的病灶,增强扫描时动脉期病灶中心可见线状或片状强化影,静脉期片状强化灶范围增大,由中心向周围扩展(图1),呈“花瓣样”改变。6例脾脏多发LCA患者中,其中2例行MRI平扫+增强扫描,结节边界清晰,病灶T1WI呈等、略低信号,T2WI抑脂序列呈高信号,局部似见小斑片状低信号,增强扫描病灶强化方式与CT相同,中心内见斑点或斑片状渐进性轻度强化,如“花瓣样”改变(图2a-2i)。
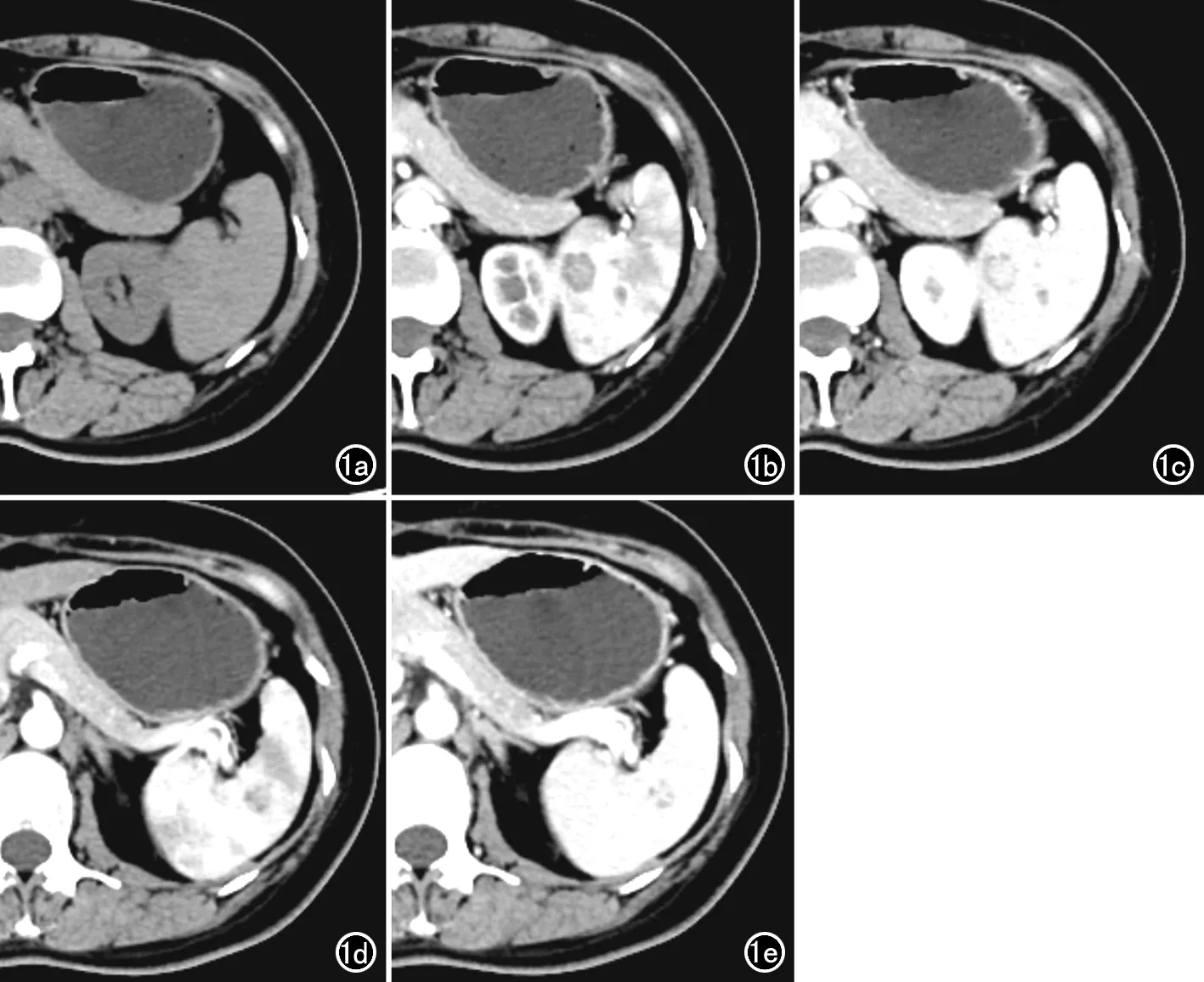
c) 增强扫描静脉期病灶强化由中心向周边扩展;d)动脉期另一个病灶中心可见斑点状强化;e)静脉期该病灶强化范围增大,向周边扩展,与周边正常的脾脏实质分界欠清。
本组6例患者术前均未考虑为LCA,其中有3例考虑为血管瘤,1例为脉管瘤,1例为淋巴瘤,还有1例伴有胃神经内分泌瘤病史患者考虑转移瘤。
2.病理及免疫组化
本组6例患者均行脾脏切除术。病灶散在于脾实质内,呈灰红色。镜下见结节病变位于红髓,与周围脾组织分界清晰,由大小不等的窦样腔隙构成,不规则的管腔呈乳头状突起,腔内可见红细胞(图2j),部分胞质内可见含铁血黄素颗粒。免疫组织化学显示肿瘤细胞同时表达内皮细胞(FVIII、CD31)和组织细胞(CD68/KP1 和溶菌酶)标记物。6例患者CD31(+)、CD68(+)(图2k、2l);4例Ki-67(5%+),2例Ki-67(5%~10%+);FVIII均未查;3例CD34(+),另3例呈阴性。本组术后病理均示脾脏窦岸细胞血管瘤。
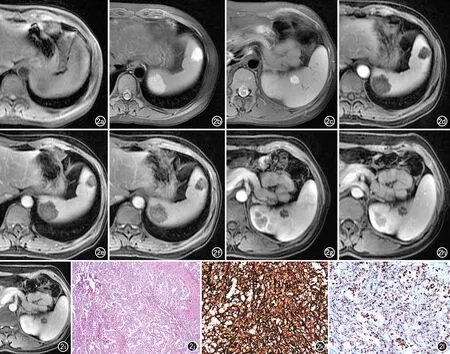
图2 LCA患者,女,40岁,于外院行胃神经内分泌瘤术后,脾脏体积增大。a) 病灶1、2在T1WI上呈等、稍低信号; b)在T2WI抑脂序列上呈高信号,局部似见小斑片状低信号;c)病灶3(同一患者另一病灶)在T2WI抑脂序列上也呈高信号伴小斑片状低信号;d) 增强扫描动脉期病灶1、2中心可见小斑片状强化;e) 门脉期示病灶1、2强化范围由中心向外扩展;f) 静脉期示病灶1、2强化范围进一步增大;g) 增强扫描动脉期病灶3中心可见斑点状强化;h) 门脉期示病灶3强化范围增大;i) 静脉期示病灶3强化范围变化不大,病灶边缘的尚未强化环形低密度影与正常脾脏分界清晰,犹如“花瓣样改变”;j) 镜下示肿瘤由互相吻合的血管性腔隙构成,腔内充满红细胞(×40,HE); k) 免疫组化结果显示:CD31(+); l) 免疫组化结果显示CD68(+)。
讨 论
1.LCA概述及临床特点
脾脏的窦岸细胞血管瘤最早于1991年Falk最先报道并命名,由于同时表达内皮细胞和组织细胞标记,被认为起源于脾脏红髓的窦岸细胞,故称之为窦岸细胞血管瘤[1]。 LCA是只发生于脾脏的良性肿瘤,目前病因不明,可能与肿瘤、慢性感染及免疫系统紊乱等刺激因素有关[2-4]。LCA发病年龄较广,多见于30~50岁,无明显性别差异[5],本组中位年龄46.50岁,与文献报道基本相符,但男女比例为2:4,可能与本组病例数较少有关。
LCA的临床症状无明显特异性,多数为偶然发现,部分患者因腹部不适就诊,本组3例无明显诱因间断性腹部不适就诊,2例因体检行腹部彩超发现,1例因胃神经内分泌瘤术后复查CT发现,与文献报道基本相符。LCA部分患者伴有脾功能亢进的表现,如血小板减少性紫癜及贫血,也有少数患者有低热、疲劳等症状[6]。本组病例中4例伴有不同程度贫血,其中1例伴有脾亢进表现。Tan等[7]认为LCA可同时与甲状腺及腹腔结(直)肠、肾脏、胰腺、血液系统、卵巢及睾丸等恶性肿瘤相伴发,本组1例伴有胃神经内分泌瘤,其余5例均未出现上述恶性肿瘤,但2例女性均伴发子宫肌瘤,其中1例同时伴有肝脏海绵状血管瘤,可能与这两种疾病在人群中发病率较高有关,同时LCA患者应详细检查或密切随访,排除其他脏器病变的可能。
2.LCA的病理学与影像学特点对照分析
病理诊断LCA标准包括以下两方面[8]:①形态学上表现为肿瘤病变由互相吻合的血管性腔隙构成,腔内充满红细胞,部分区域呈囊状扩张,常伴有乳头状突入腔内,表面衬覆单层内皮样细胞,一种与周边正常脾窦内皮相似,主要衬覆于细小血管腔隙表面,另一种呈鞋钉状的柱状细胞,主要衬覆于宽大血管腔隙表面,部分细胞内可见含铁血黄素颗粒;②免疫组化:肿瘤细胞同时表达内皮细胞(FVIII、CD31)和组织细胞(CD68/KP1和溶菌酶)标记物[9],呈双重分化。本组患者CD31和CD68均呈阳性,与文献报道相符。
脾脏LCA以多发为主,单发少见,由互相吻合的血管性腔隙构成,无包膜,因此多数病灶边界欠清,尤其是呈等或稍低密度的小病灶,单发病灶边界较清晰,笔者认为可能与单发病灶一般较大,密度与正常脾脏相差较大有关。值得一提的是大多文献报道多发结节型LCA强化方式是向心性强化[10],而本组多发结节型LCA中较大病灶(直径大于2.0 cm)强化由中心向周边进展,门脉期病灶边缘的尚未强化环形低密度影与正常脾脏分界清晰,犹如“花瓣样改变”,与黄国权等[11]的报道相符,笔者认为此种强化特点可能是多发结节型LCA特有的,但如果LCA病灶较小,脾脏早期花斑状强化掩盖了早期结节状强化影,显示欠清,由于本组病例数较少,尚需要进一步搜集病例证实。
本组2例多发结节型LCA患者均进行MRI平扫+增强检查,其强化特点与CT相似,在T1WI上呈等、略低信号,T2WI抑脂序列呈高信号,局部似见小斑片状低信号,因为病灶由脾脏血窦吻合血管腔构成,所以主要在T2WI呈高信号,其中值得注意的是病灶细胞有吞噬红细胞作用,可吞噬含铁血黄素,导致病灶内铁沉积,出现顺磁效应,使得在T2WI上呈片状低信号,即“雀斑征”改变,与文献报道相符[12,13]。因为LCA病灶中水分子运动明显受限,在DWI上呈高信号,而脾脏海绵状血管瘤与正常脾组织相比无扩散受限改变,故LCA与脾脏海绵状血管瘤在DWI上有差异[14]。
影像上LCA应与以下肿瘤进行鉴别:①脾血管瘤:相关文献报道脾血管瘤的强化方式类似于肝脏血管瘤[15],动脉早期呈外周结节状强化,逐渐向内充填,延迟期与周围正常脾脏组织相比呈高或等密度,DWI呈低信号。②脾脏血管淋巴管瘤(脉管瘤):很少见,为脾内多发大小不等的类圆形低密度灶,CT表现因血管和淋巴管构成比例不同而有所差异[16],血管为主的病灶强化显著,以淋巴管为主者呈轻度强化。③脾脏淋巴瘤:原发性脾脏淋巴瘤极少见,CT表现与病理类型密切相关,通常表现为一个孤立的乏血供肿块,原发性脾脏淋巴瘤可突破脾脏包膜并累及邻近器官;④转移性肿瘤:罕见且有原发肿瘤的病史,大多数有脾脏转移瘤的患者已有广泛转移,典型呈环形强化,“牛眼征”是其特征性表现。
3.LCA的诊断及处理
目前,借助影像学手段对LCA进行正确诊断比较困难,目前最佳的治疗方法是手术切除[17]。需要指出的是,少数脾脏LCA具有一定恶性潜能,分别为脾窦岸细胞血管肉瘤和窦岸细胞血管内皮瘤,后两者与LCA的主要区别在于肿瘤细胞有无异形性及核分裂象的多少[18]。Takayoshi等[19]报道了一位LCA患者切除肿瘤10年后出现肝转移,部分文献报道LCA患者还可伴发其他内脏恶性肿瘤,因此在影像诊断中易将其他脏器肿瘤作为原发灶,对脾脏LCA易误诊为转移而延误手术时间。同时,对于脾脏LCA病变应考虑多种可能并进行细致的全身检查,术后应进行密切随访。
综合本组病例及文献报道进行总结分析,笔者认为LCA是仅发生于脾脏的罕见良性肿瘤,临床表现多无特异性,多由体检发现,病灶可单发或多发,但以多发型常见,且多发型病灶体积较小。多发结节型LCA病灶(直径>2.0 cm)的CT或MRI增强扫描强化方式由内向外,出现“花瓣样”改变,可能为其特征性改变,较小病灶(直径<2.0 cm)强化方式显示欠清,T2WI上的“雀斑征”、 DWI高信号也是LCA的特征性表现。