基于OPG/RANKL/RANK信号通路探讨益肾健骨方防治绝经后骨质疏松的作用机制
叶子丰 戎宽 张信成 匡建军 万明明 许辉*
1.湖南中医药大学,湖南 长沙 410208
2.湖南省中医药研究院附属医院,湖南 长沙 410006
3.湖南省岳阳市中医医院,湖南 岳阳 414000
骨质疏松症(osteoporosis,OP)是由于骨小梁微结构发生退变,数量变少,厚度降低导致的骨密度与骨质量降低并骨折发生率升高的骨代谢疾病[1-3]。绝经后妇女由于雌激素水平逐渐降低,导致成骨细胞受到抑制,破骨细胞活跃,加速了骨溶解吸收打破原有的骨代谢平衡,诱发绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)[4-6]。现代研究证明,PMOP的发病与骨偶联及核因子-κB受体的活化因子RANK配体(RANKL)/骨保护蛋白轴的关系最为密切[7]。骨保护素(osteoprotegerin,OPG)作为可溶性分泌分泌性糖蛋白,具有抑制骨吸收的作用,RANK则是诱导破骨细胞分化成熟的重要细胞因子,在破骨细胞与前体细胞表面可与RANKL相结合强刺激破骨细胞的分化、成熟并且抑制破骨细胞的凋亡[8]。PMOP在传统医学中属于“骨痿”范畴,传统医家认为肾虚是其发病的根本病机[9]。现代研究也已证明肾虚在多个途径对骨代谢的发生产生影响[10-11],因此临床中治疗绝经后骨质疏松应以补肾为法。益肾健骨方为全国名老中医仇湘中教授经验方,既往临床试验证明该方在PMOP防治中疗效确切[12-13],但尚未明确其具体作用机制,OPG/RANKL信号通路是绝经后妇女发生发展骨质疏松的重要途径,为探究益肾健骨方是否调控OPG/RANKL信号通路抑制破骨细胞分化从而防治PMOP,本实验通过骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)与破骨细胞共培养,观察破骨细胞的形态;Wnt10b、β-catenin、OPG、RANKL mRNA及蛋白含量的表达水平,研究其对OPG/RANKL/RANK信号通路作用机制,为临床治疗PMOP提供新靶点与新思路。
1 材料与方法
1.1 材料
1.1.1实验动物:40只雌性未孕3月龄SD大鼠(SPF级),体重(220±20)g。由湖南省中医药研究院动物实验中心采购于湖南斯莱克景达实验动物有限公司(动物许可证号:SCXK(湘)2019-0004;营业执照号码:914301006735928721)。本次实验动物编号:1107272011006323。实验大鼠均饲养于湖南省中医药研究院动物房开放式动物饲养室,室温保持在20 ℃~25 ℃,湿度控制在50%~60%,明暗周期12 h/12 h,予标准营养颗粒进行饲料并自由饮水。
1.1.2药物:益肾健骨方,功效为补肝益肾,活血健骨,药物组成:生黄芪 15 g、活血藤 15 g、补骨脂 10 g、杜仲 10 g、丹参 15 g、熟地黄 25 g、川续断 10 g、当归 15 g、白芍 15 g、三七 6 g、海蛤壳 10 g。上述中药为湖南省中医药研究院附属医院院内制剂(生产批号:20200805;制剂批号为:湘药制字Z20080783)。阿仑膦酸钠片(北京万生药业有限责任公司,国字标准号:H20059029 成人用量每日1次,每次1粒;规格10 mg/粒)。
1.1.3试剂:DMEM/F12培养基培养基(Sigma,货号:D5796-500 ML);青霉素-链霉素溶液、胰酶细胞消化液(碧云天生物技术公司,批号分别为:C0222、C0205);胎牛血清(GIBICO公司,批号:04-001-1ACS);PBS缓冲液(Hyclone,批号:SH30 256.01);M-CSF(abcam,批号:ab269198);RANKL抑制剂(Peprotech,批号:400-30-2);OPG、RANKL试剂盒(武汉华美生物工程有限公司;批号:P05031576、P05031576);苏木素、伊红染液(上海威奥生物科技有限公司,批号:C200501、C200702)。
1.1.4主要仪器:流式细胞仪(FACSVE RSE,美国BD);酶标仪(山东恒美电子科技有限公司);BA210 T型显微镜(麦克奥迪实业集团有限公司);台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);ABI 7500实时荧光定量PCR仪(美国Thermo公司);DHP-500型电热恒温培养箱(北京市永光明医疗仪器有限公司);TS-1型摇床(上海浦矛工业科技有限公司);总蛋白测定试剂盒(中生北控生物科技股份有限公司,批号:121135);Transwell小室(Corning,美国)。
1.2 方法
1.2.1动物模型的制备:40只SD大鼠在适应性喂养1周后随机分为去卵巢组(n=30)与假手术组(n=10)。切除30只去卵巢组大鼠双侧卵巢,建立绝经后骨质疏松模型,其余10只假手术组大鼠做同样的切口,但仅切除少量脂肪。手术后大鼠均肌肉注射青霉素20×104U,1天1次,并予伤口换药,连续3 d,避免感染。术后8周后结合骨密度与观察大鼠行为学验证造模成骨。
1.2.2给药方法:8周验证造模成骨后。采用随机数字表法将30只去卵巢大鼠分为3组:实验组(10只)、模型组(10只)、阳性药物对照组(10只)。计算动物灌胃给药量,参照不同动物等效剂量折算系数,计算得出实验组大鼠益肾健骨方等效灌胃剂量为0.36 g/(200 g·d),即1.8 g/(kg·d),配置浓度为0.72 g/mL,1 mL/(200 g·d)。阳性对照组予阿仑膦酸钠灌胃,浓度为1.26 mg/mL,1 mL/(200 g·d)。假手术组与模型组均予同体积蒸馏水灌胃1 mL/(200 g·d)。连续给药3周,末次给药结束后,监测大鼠L4-L5、双侧股骨骨密度。
1.2.3实验大鼠BMSCs分离、培养及鉴定:(1)BMSCs分离、培养:①采用托颈法处死各组SD大鼠后保持低温环境,取SD大鼠双侧胫骨、股骨后清除表面软组织与筋膜使骨髓腔暴露。②使用培养基反复冲洗暴露的骨髓腔,收集冲洗液后离心并收集沉淀的细胞,将其接种与培养基皿内。③细胞增殖至90%融合时,以1∶3的比例融合并继续培养,待细胞再次增殖至90%融合时再进行传代培养。(2)BMSCs的鉴定:①骨髓BMSCc细胞消化后,取P3代BMSCs离心处理并收集细胞。②制作细胞悬液,加入0.3 μL CD44-PE抗体与 0.5 μL CD45-FITC抗体并设置不染抗体管,放置于37 ℃避光环境中孵育30 min;1 000 r/min,37 ℃,离心5 min,无菌液冲洗两遍后,制成500 μL单细胞混悬液。③采用流式细胞仪检测CD44、CD45表达情况。采用倒置相差显微镜观测其细胞形态与生长趋势。
1.2.4建立实验大鼠BMSCs与破骨细胞共培养体系:采用分离骨髓单核细胞的方法获得破骨细胞前体细胞。使用水合氯醛麻醉2周龄大鼠,摘取其体内的胫骨与股骨后处死,暴露其骨髓腔后,使用MEMα反复冲洗收集洗液,保留细胞沉淀;之后加入大鼠淋巴细胞分离液,并在其上加已经使用的4 mL MEMα重悬细胞沉淀,离心后吸取处于中间的白膜层细胞,使用PBS稀释,再次离心保留其细胞沉淀,使用破骨细胞诱导培养基重选细胞沉淀,将其接种于共培养小室的下室,并使用破骨细胞培养剂进行培养。最后将75%~85%细胞融合的间充质干细胞制备为细胞悬液,培养与Transwell上室。下室隔日换液,于第9天时使用大鼠破骨细胞进行培养,之后每3 d换药1次;上室则使用BMSCs培养液同时换液。完全培养剂观察破骨细胞形态。BMSCs与破骨细胞培养完成后再进行共培养,分为:实验+OC组、模型+OC组、阳性对照+OC组、假手术+OC组。
1.2.5观察指标与方法:(1)破骨细胞观察。在共培养3、7、12、16 d后倒置于相差显微镜下,观察其中的下室细胞形态。在共培养第12天对下室细胞进行TRAP染色(依据TRAP染色试剂盒说明进行染色并观察拍照)。(2)RT-PCR法检测共培养体系Wnt10b、β-catenin、RANKL、OPG mRNA表达。细胞共培养2周,收集BMSCs,提取出总RNA,通过核酸分析仪检测各样本含量中的RNA浓度(g/L)与A260/280值。依据反转录试剂盒说明书,提取1 μg总RNA反转录成cDNA,按照要求,反转录条件为:37 ℃ 15 min,85 ℃ 5 s,4 ℃。之后将1 μL cDNA作为模板扩增Wnt10b、β-catenin、RANKL、OPG和β-actin。扩增需要条件为:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。将β-actin作为内参照基因,计算各目基因的2-ΔΔCt。最终比较并分析各目基因mRNA的表达水平。引物序列见表1。(3)Western blot法检测共培养体系中Wnt10b、β-catenin、RANKL、OPG蛋白表达。细胞共培养2周,收集BMSCs,提取出各组总蛋白,使用BCA法测定出蛋白浓度之后,按每孔30 μg上样,SDS-PAGE凝胶电泳;使用湿转转膜,在室温中封闭1 h后;一抗孵育(Wnt10b,1∶1 000;β-catenin,1∶1 000;RANKL,1∶1 000;OPG,1∶1000;β-actin,1∶2 000),放置于4 ℃环境中孵育过夜;第二天分别使用抗小鼠抗体或羊抗兔室温孵育1 h;最后参照ECL化学发光试剂盒中说明书步骤凝胶成像仪下显影并拍照。
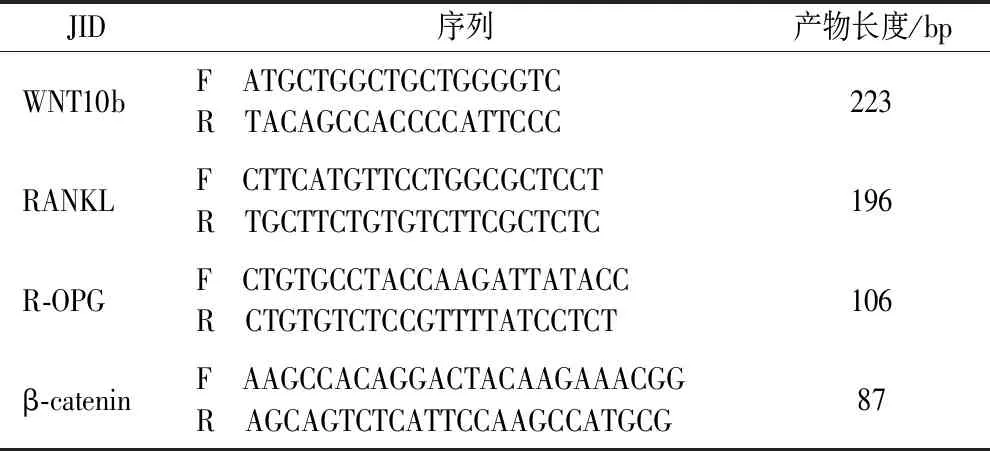
表1 引物序列Table 1 Primer sequences
1.3 统计学分析
2 结果
2.1 SD大鼠L4-L5、双侧股骨骨密度检测结果
与假手术组比较,其余三组骨密度结果明显减少,与模型组比较,实验组、阳性对照组L4-L5骨密度、双侧股骨骨密度明显升高(P<0.05);实验组与阳性对照组比较,L4-L5骨密度、双侧股骨骨密度比较无明显改变(P>0.05),见表2。
表2 各组大鼠骨密度结果Table 2 Bone mineral density results of each group g/cm2)
2.2 各组破骨细胞鉴定、形态观察及计数
采用TRAP染色鉴定破骨细胞是否形成,如图1,染色成红色,则为破骨细胞,显微镜下提示,当培养时间越长,细胞逐渐融合,可观察到伪足,多核细胞,并且在培养一周后出现极值。各组比较,模型+OC组最早出现多核细胞且数量最多,凋亡时间越晚;其次是阳性对照组+OC组,再者为实验+OC组,最后为假手术+OC组。见表3,图2、3。
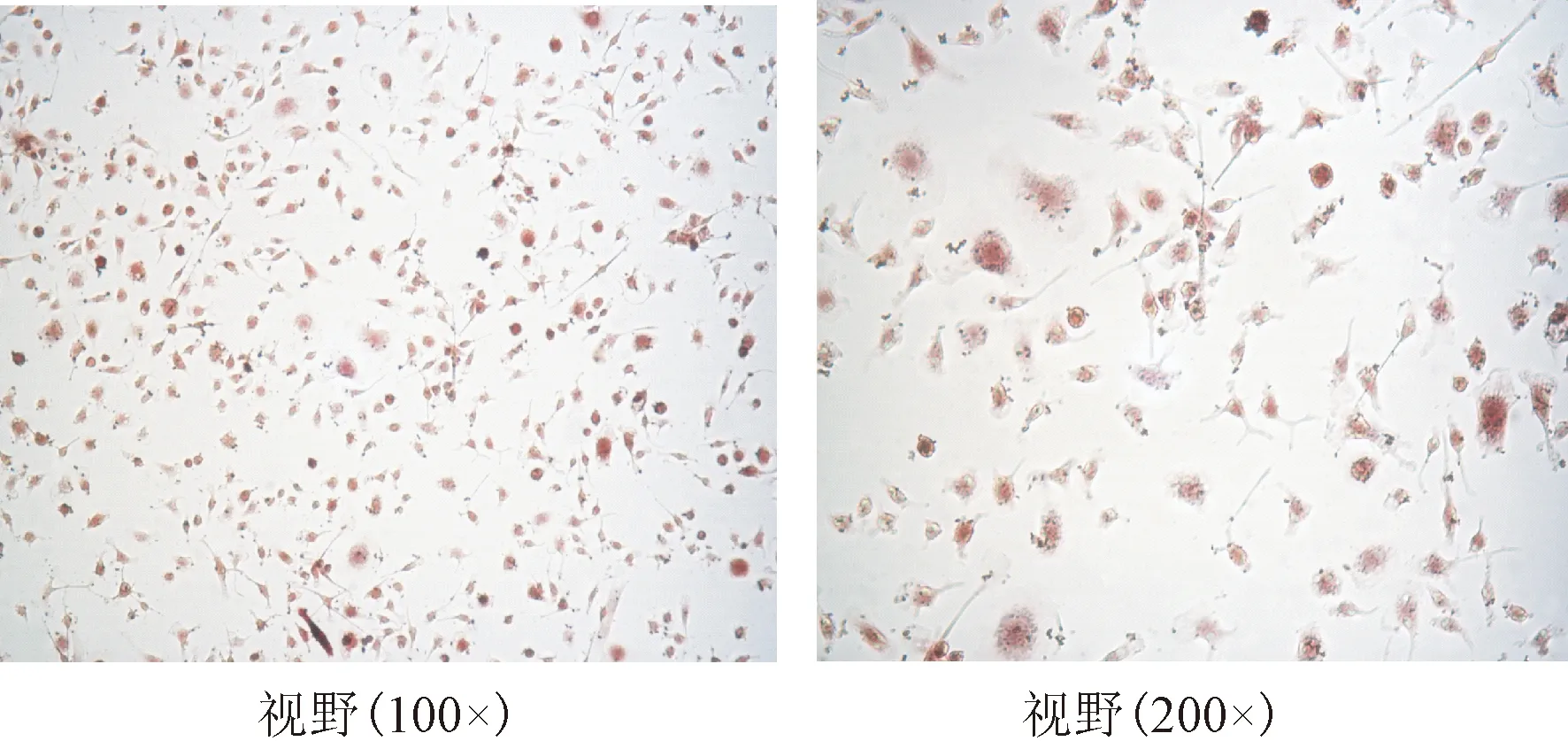
图1 Trap染色结果Fig.1 The Trap staining results

图2 各组破骨细胞形态A:模型组,B:假手术组,C:实验组,D:阳性对照组Fig.2 Osteoclast morphologyA: Model group, B: Sham operation group, C: Experimental group, D: Positive control group
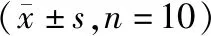
表3 破骨细胞计数Table 3 Osteoclast counting
2.3 各组共培养体系中Wnt10b、β-catenin、RANKL、OPG mRNA表达情况

3 各组破骨细胞数目A:模型组,B:假手术组,C:实验组,D:阳性对照组Fig.3 Osteoclast numberA: Model group, B: Sham operation group, C: Experimental group, D: Positive control group
与假手术+OC组相比,模型+OC组Wnt10、
β-catenin、OPG mRNA表达显著降低,RANKL mRNA表达显著升高,差异有统计学意义(P<0.05);与模型+OC组相比,阳性对照+OC组、实验+OC组Wnt10、β-catenin、OPG mRNA表达水平均升高,RANKL mRNA表达降低,差异有统计学意义(P<0.05);提示经两组药物治疗后,破骨细胞增殖分化受到抑制。阳性对照+OC组与实验+OC组间比较差异无统计学意义(P>0.05)。见图4。

图4 各组Wnt10b/β-catenin、OPG/RANKL mRNA的表达情况Fig.4 Expressions of Wnt10b/β-Catenin and OPG/RANKL mRNA in each group注:与模型+OC组比较,#P<0.05;与阳性对照+OC组比较,*P<0.05;与实验+OC组比较,&P>0.05;与假手术+OC组比较,^P<0.05。
2.4 各组共培养体系中Wnt10b/β-catenin、OPG/RANKL蛋白的表达情况
与假手术+OC组相比,模型+OC组Wnt10、β-catenin、OPG蛋白表达显著降低,RANKL蛋白表达显著升高,差异有统计学意义(P<0.05);与模型+OC组相比,阳性对照+OC组、实验+OC组Wnt10、β-catenin、OPG蛋白表达水平均升高,RANKL蛋白表达降低,差异有统计学意义(P<0.05);提示经两组药物治疗后,破骨细胞增殖分化受到抑制。阳性对照+OC组与实验+OC组间比较差异无统计学意义(P>0.05)。见图5、6。

图5 各组Wnt10b/β-catenin、OPG/RANKL蛋白表达Fig.5 Expressions of Wnt10b /β-Catenin and OPG / RANKL proteins in each group注:与模型+OC组比较,#P<0.05;与阳性对照+OC组比较,*P<0.05;与实验+OC组比较,&P>0.05;与假手术+OC组比较,^P<0.05。

图6 各组Wnt10b、β-catenin、RANKL、OPG蛋白电泳图Fig.6 Wnt10b, β-catenin, RANKL, and OPG L protein electrophoresis
3 讨论
我国是人口老龄化大国,随着老龄化的逐年攀升,骨质疏松的发病率也逐年上涨,其中又以绝经后骨质疏松最为常见,祖国医学认为PMOP属骨痿范畴,并认为其为本虚标实之证,本虚多涉及肾、脾、肝;标识则为血瘀。益肾健骨方为全国名老中医仇湘中教授抗骨痿经验方。方中杜仲、熟地黄为君,杜仲入肝肾经,具有补肝肾,强筋骨的作用,熟地黄,性微温,能填精益髓,养血滋阴。杜仲、熟地共用,共起阴阳同补,填精益髓之效。补骨脂温肾助阳,续断补益肝肾为臣药,黄芪、丹参益气补血,血为气之帅,气血生化有源则气血通畅,脉道流利共为臣药;活血藤活血通络、海蛤壳软坚散结;当归活血补血、白芍柔肝养血均为佐药;三七散瘀止痛,为佐使,共凑补益肝肾,活血健骨的作用。
在正常的生理周期中,骨代谢周期中的骨吸收与骨形成保持动态的平衡,若出现某种因素使原本处于正常动态平衡的骨代谢被打破,则出现骨吸收大于骨形成的病理状态,造成骨量的流失[14-15]。近年来国内外研究提示OPG/RANKL信号轴是绝经后妇女发生、发展骨质疏松的重要路径之一,若OPG/RANKL信号调控因子表达正常,则骨代谢保持平衡。OPG是具有抑制骨吸收,增加骨皮质、骨松质面积、密度和骨强度的重要细胞因子,并且可竞争性地与RANKL结合调节骨代谢信号通路达到抑制骨吸收,维持骨代谢动态平衡的作用[16]。RANKL是激活破骨细胞的重要细胞因子,当与破骨细胞表面的RANK相结合会促进破骨细胞的分化与凋亡。Wnt信号通路在调节骨稳态过程中发挥重要作用[16]。其中β-cetenin在细胞发育阶段的骨稳态即产生影响;Wnt10b可促进成骨细胞的分化而维持骨稳态,是骨形成的内缘调节剂[17-18]。现代研究证明,Wnt信号通路不仅可促进BMSCs细胞的分化发育,并且还可促进成骨细胞的分化和增殖,通过上调OPG/RANKL的比例影响破骨细胞的功能[19]。权祯等[20]研究认为可从“肝主筋,肾主骨”理论阐述OPG/RANKL信号通路,提出肝肾同补则可强化筋骨力学,稳定其机械性能,从而增加OPG/RANKL信号通路的内缘稳定性,产生骨保护作用;宋昕等[21]研究发现OPG/RANKL信号通路与肠道菌群密切相关,当肠道菌群失调时,OPG/RANKL信号通路将被激活,使PMOP患者骨代谢出现异常,炎性指标升高;张峻玮等[22]通过骨碎补对BMSCs与破骨细胞共培养系统的实验得出结论骨碎补可调节BMSCs细胞中的OPG、RANKL表达激活OPG/RANKL信号通路抑制破骨细胞分化与成熟,证明BMSCs与OPG/RANKL信号通路密切相关。本实验通过BMSCs细胞与破骨细胞共培养的方式探讨益肾健骨方防治PMOP的作用机制,目前大多数学者认为,细胞共培养是更为合适的细胞培养方式,可最大程度地模拟细胞生长时的微环境,进而更好地评价细胞的生物学行为[23],当BMSCs在无或低浓度破骨细胞诱导因子情况下,BMSCs与破骨细胞前体细胞的共培养可加速破骨细胞的形成[24]。本实验结果证明,益肾健骨方可通过调节BMSCs抑制破骨细胞的形成,同时通过升高OPG、Wnt10b、β-catenin蛋白及mRNA,降低RANKL蛋白及mRNA的表达,激活OPG/RANKL与Wnt/β-catenin信号通路,预防破骨细胞的分化与成熟,影响骨代谢从而防治PMOP。
综上所述,益肾健骨方可抑制破骨细胞的形成,提升骨质量,调节骨吸收与骨形成的动态平衡从而防治PMOP,其作用机制可能与干预了Wnt信号通路与OPG/RANKL系统密切相关,但实验过程中的OPG、RANKL在发生变化时是否由其他机制协同作用尚未明确,其中具体的分子机制也尚未完全明确,有待进一步深入研究。

