电化学二氧化碳还原制甲酸催化剂的研究进展
李喆,李泽洋,杨宇森,卫敏
(北京化工大学化学学院,化工资源有效利用国家重点实验室,北京 100029)
从近年的能源消耗情况来看,自工业革命以来,化石能源在整个能源利用体系中占有较大使用比例。由于人们对于像煤、石油、天然气等传统碳基化石能源的过度依赖,大气中二氧化碳过度累积,浓度持续上升。美国国家海洋和大气管理局(NOAA)莫纳罗亚大气基线观测站于2022 年5 月测得CO2浓度达到420.99μL/L的历史峰值,比工业化前(280μL/L[1])增加50%以上。据能源与气候智库(ECIU)统计,全球已有130多个国家及地区提出“碳中和”或“零碳”目标。如何降低大气中二氧化碳含量成为人类亟需解决的重大挑战之一。总体来说,主要通过以下四种途径:①提高能源效率;②使用非碳或低碳能源;③碳捕获和地质固存(CCS)[2];④碳捕获和利用(CCU)[3]。一般来说,二氧化碳固存一般包括四种选择,即地质、海洋、矿化和工业用途,但考虑到经济性、环境影响、社会接受度、商业挑战[3]等问题以及存在固存监测等技术难题,CCS 仍存在较大的发展障碍。近年来,随着可再生电力(如潮汐能、风能和太阳能等清洁能源)主导地位不断提升(26%),价格持续下跌(0.06 美元/千瓦时)[4],以及电化学反应条件本身具有温和性(一般在常温常压下便可以驱动反应进行),反应过程具有可控性(通过改变相关参数便可设置),且系统模块化易于扩展等优势,为电化学二氧化碳还原反应(CO2RR)和人工完成碳循环,实现可持续的碳中和能源转换提供了发展基础。使用可再生电力驱动反应进行,将二氧化碳还原为增值含碳化合物,不仅可以解决二氧化碳过度排放的问题,还可以实现间歇性电能直接转化为化学能,对实现碳平衡和优化能耗结构具有重要意义。
在众多可能产物中,甲酸(HCOOH)具有参与反应转移电子数量少(仅为2电子)、反应路径简单等特点。由于其在商业化合成工业(医药、橡胶等)和燃料电池等领域中的广泛应用,且适合进行规模化生产,其需求量逐年急剧上升(图1)。在理想条件下,甲酸的生产最高值为0.43美元/千瓦时[5],与一氧化碳相似,但比甲醇和甲烷高很多[6]。同时,甲酸也是极具发展空间和应用前景的储氢介质,其氢质量分数为4.4%,密度可达1.22g/cm3,容积容量达到53gH2/L,相当于1.77kW·h/L 的能量密度,超过了商用70MPa氢压罐[7]。作为基本的C1化工原料之一,甲酸可作为多种官能团的选择转化中间体,使用甲酸作为有效氢源,有机氢供体催化转移加氢(CTH)[8],进行特定官能团的催化还原,比如不饱和基团的氢化:羰基化合物氢化为醇[9−10]、亚胺[11]或硝基[12]为胺、炔烃为烯烃[13]、烯烃为烷烃[14]等。

图1 二氧化碳电化学还原示意图
近年来,各种电催化剂被用于CO2RR 的广泛研究,在HCOOH生产中活性、能源效率、长期稳定性等性能提升方面取得了显著进展。本文从CO2RR的基本电化学反应原理和评估标准开始,总结介绍了电化学还原CO2制备HCOOH 的典型金属基催化剂及其设计调控的常见策略,并简要概括电化学相关的原位表征手段。基于上述讨论,提出进一步发展二氧化碳电还原为甲酸的机遇与挑战。
1 电化学还原二氧化碳反应
对于CO2本身来说,由于CO2分子中存在离域大π 键,碳氧键间的距离变短(116.3pm),表现出了一定的C≡O 特征,结构相对来说更加稳定。相比于C—H(411kJ/mol)、C—C(336kJ/mol)和C—O(327kJ/mol),C= = O活化具有较高的能量势垒(750kJ/mol)[6],分子反应动力学缓慢。从氧化还原角度来看,CO2的第一电离能为13.79eV(表1),属于较弱的电子给予体,较强的电子接受体。此外,二氧化碳本身在水环境中溶解度有一定限制,25℃时约为33mmol/L(1atm 1atm=101.325kPa)[15],且除了氢化反应(HER)的竞争会降低碳基产物的选择性和反应能量效率外,由于该反应是一个复杂的质子耦合电子转移(PCET)过程,包括多种反应途径。根据催化剂和实际实验条件的差异,CO2中的碳作为最高氧化状态,可以获得数量不等的电子和质子,在不同反应路径中,其反应能垒的差异性导致出现相互竞争,进而形成不同的碳基产物和产品分布。同时,因为产品之间的热力学氧化还原电位接近,也增加了对特定产物选择性的困难程度。部分产物的热力学电化学半反应及其对应电位如图2 所示[16](常温常压,pH=7 的水溶液,Vvs.RHE)。

图2 部分产物的热力学电化学半反应及其对应电位(常温常压,pH=7的水溶液,V vs. RHE)

表1 CO2物理化学性质[6,15]
基于目前对二氧化碳还原至甲酸过程的认识,通常认为甲酸的生成与关键中间体*OCHO 的形成密切相关。CO2在催化剂表面进行吸附活化,形成自由基CO2*中间体;或是一步质子耦合电子,质子(H+)和电子(e-)同时转移到吸附物种,形成*OCHO 或*COOH 中间体(其中*表示与催化剂结合的原子)。这两种中间体的形成,取决于自由基CO2*与电极表面金属位点进行配位时是通过氧原子还是碳原子。结合前人理论计算结果与实验验证得知,由于催化剂表面性质的差异性,结合原子不同,对应被质子化的原子也就不同,进而出现不同的CO2优先吸附构型。其中,*OCHO 中间体是通过氧原子与催化剂表面结合,碳原子发生质子化形成,进而得到甲酸盐,如图3所示。此外,由于加氢步骤是利用表面氢(*H)或溶解质子(H+),最近一研究表明,通过表面氢进行氢化更为有利,因为相比O—H 键而言,C—H 键的极性更小[17−18]。若碳原子首先与催化剂表面结合,则氧原子发生质子化形成*COOH中间体,再通过C—O键的断裂,最终在催化剂表面释放CO[19]。

图3 CO2还原至甲酸反应途径示意图
根据相关技术经济分析(TEA)显示,在经济竞争力上,最具吸引力的目标产品包括CO、HCOOH、C2H4和C2H5OH;而反应的关键性能目标需要达到法拉第效率(90%)、电池电压(<1.8V)、电流密度(>300mA/cm2)和稳定性(>80000h)[17]。
(1)法拉第效率(FE) 反映CO2RR 特定产物的选择性,指用于形成所需产品的电荷百分比。在一定程度上也反映分离难度,分离要求的复杂程度会大幅提高成本。
(2)电流密度(j) 作为衡量电极单位面积的电化学反应速率或是催化活性的指标[16],分为总电流密度(jtotal)和局部电流密度(jPartial)。其中总电流密度一般根据电化学表面积(ECSA)、电极的几何面积或催化剂实际质量负载量进行归一化[20],对于工业应用来说,需要满足CO2RR 生产率的同时,减少整体电解槽的大小,最大限度减少资金投入,提高净现值。而局部电流密度则对应于某个产物的催化活性,jPartial=jtotal×FE。
(3)起始工作电位和过电位 由于二氧化碳相对惰性,且CO2RR 涉及多个电子转移,过高电位将消耗更多的能源消耗,导致转换效率下降。因此如何在较低的过电位下克服能量势垒激活二氧化碳并推动其后的还原,是当前研究的重点。
(4)能量效率(EE) 反映电能向化学能转化的效率,由产品中所存储的能量与外加应用的总电能作比值可得。高能效意味着生产所需产品时仅小部分能量损失,总电力需求得以降低。Kibria等[17]得出,可以通过将FE 提高到90%的同时将电池电压降低到1.8V 以下来优化CO2RR 电池系统的EE,以减少总功率需求。
(5)稳定性 反映电极催化剂的耐用性,更好的稳定性将减少维护成本和运营期间的停机时间,更有利于CO2RR 后续大规模的工业化和商业化推广。但由于受到本身性质和工作条件的影响,目前大多数工作仅具备短期耐久性,甚至不到100h[21],还远远没有达到80000h的要求。
(6)环境影响与成本 成本包括资本成本和运营成本。资本成本来自二氧化碳电解槽硬件,而运营成本来自电力使用、二氧化碳原料和产品分离成本等。理想的CO2RR 电催化剂应同时具备绿色和经济的特点。
2 电化学还原二氧化碳制备甲酸的主要金属基催化剂
结合上文所提到的CO2RR 选择性生产HCOOH的反应机制可知,需要全面考虑电催化剂表面*COOH、*OCHO、*CO 和*H 中间体的产生和吸附。为获得具有高HCOOH选择性的催化剂,催化剂表面上应具有形成*OCHO 较低的能量势垒,和形成*COOH 和*H 更高的能量势垒。而P 区元素(Bi、Sn、In、Pd 等)由于良好的亲氧性,有利于CO2分子中的O 优先吸附,更趋向于在碳原子上进行质子化,进而主要的还原产物为HCOOH/HCOO-,近年来取得广泛进展。各种研究通过纳米结构工程,双金属系统和氧化改性等对催化剂进行调整,通过影响电子结构调节反应物物种吸附、活化和解吸,进而对反应路径与产物的选择性和活性进行关联,促进催化剂的工业化应用。本节将具体回顾Bi、Sn、In催化剂方面的相关进展,并简要介绍了Pd 等贵金属元素,帮助读者了解主要金属基电催化剂的发展现状。
2.1 Bi
1995 年,Komatsu 等[22]首次将Bi 开发用于离子液体中的CO2RR催化剂,主要产物是CO。自2016年起,研究发现在水溶液中,Bi 基催化剂在选择性生产HCOO−中具有巨大潜力,快速发展成为研究最广泛的材料之一。近年来,常通过结构工程,在纳米尺度下对催化剂形态进行调整,比如一维材料(如纳米线[23]、纳米管[24])、二维材料(如纳米片[25−26])以及三维材料(如纳米颗粒[27]、纳米树突[28])等多种形态特征的催化剂[图4(a)、(b)],各异的形态提供更多的活性位点,如边缘、台阶、角落等位置[29],以此来优化CO2分子的活化行为,降低后续产生*OCHO 关键中间体的能垒,进而提升反应性能。Yang 等[30]合成的富含大量氧空位的Bi2S3−Bi2O3@rGO 纳米花状催化剂,生成甲酸酯的法拉第效率为90.1%(-0.9Vvs.RHE),稳定性为20h。纳米花状极大提高了比表面积,有利于暴露更多晶体平面。而像是纳米树突存在多个分支的边缘结构,含有丰富的不饱和位点,可以改善催化剂中催化位点的内在活性。Koh 等[28]采用循环电沉积方法,先将Bi 薄膜预先沉积在铜箔衬底上,再在Bi 薄膜上制备分层的Bi 树突电极,法拉第效率约为89%(-0.74Vvs.RHE)。除了对于结构的设计,还可以通过制造缺陷、晶界和位错等方式获得更多活性位点。Chen等[31]提供了一种利用原电池沉积的新方法[图4(c)],所合成的富含晶界的Bi 纳米树突对甲酸酯生产速率高达557.2μmol/(h·cm2)(-0.94Vvs.SHE)。该工作通过促进低角度晶界的更多暴露,导致发生晶格应变,进而有利于CO2吸附和中间体的形成。另外,催化剂的电化学结构重建,可能会产生与初始催化剂不同的实际活性位点,原位形成新的活性表/界面,也作为构建二氧化碳电还原高效催化剂的一种有效思路。Yuan 等[32]通过Bi(OH)3NS 在水溶液中发生原位重构,由于羟基物种在Bi(OH)3到Bi 的相变过程中的损失,形成了具有大量不饱和配位凹坑的铋纳米片[图4(d)]。通过对电子结构和对中间体的吸附强度的调节,凹坑边缘产生的不饱和配位点作为实际的活性位点,从而提高催化性能。与完整的Bi NS 相比,重建Bi NS的电流密度增加了2.6 倍,HCOO-生产的法拉第效率可达95.3%(-1.14Vvs.RHE)。

图4 多种Bi基催化剂的调控设计[28,30−32]
目前,大多数的电解系统都是采用碱性或中性电解质,在CO2RR 和HER 期间,H+的消耗会在催化剂表面附近创造一个局部碱性环境,OH-和CO2之间难以不发生碳酸盐/碳酸氢盐的形成和电解质的酸化。这不仅会增加整个电池的电阻,还会阻塞气体扩散通道[33−35],导致碳效率和电解稳定性降低。相比之下,酸性介质环境则可以对碳酸盐的形成起到抑制作用[36]。根据Bondue等[37]研究指出,若满足CO2RR 的CO/OH-形成速度,可以补偿质子向电极表面的质量转移,达到对质子在酸性介质中的还原进行抑制的目的。另外,在电化学活性位点附近增加钾阳离子(K+),可以加速二氧化碳的活化,进而酸性介质中实现高效的CO2RR[38]。Qiao 等[39]将K+引入电解质中来设计Bi 催化剂表面的局部微环境(图5),利用K+减少质子覆盖以抑制竞争HER和降低酸中二氧化碳还原的能量势垒,并通过与氧原子的局部相互作用来稳定*OCHO 中间体,最终促进在强酸性介质(pH≤1)中高效二氧化碳转化为HCOOH,法拉达效率可达92.2%(-1.23Vvs.RHE),电流密度为-237.1mA/cm2。同时,酸性二氧化碳电解可以直接产生HCOOH,而不是甲酸盐,还可以节省产品成本。
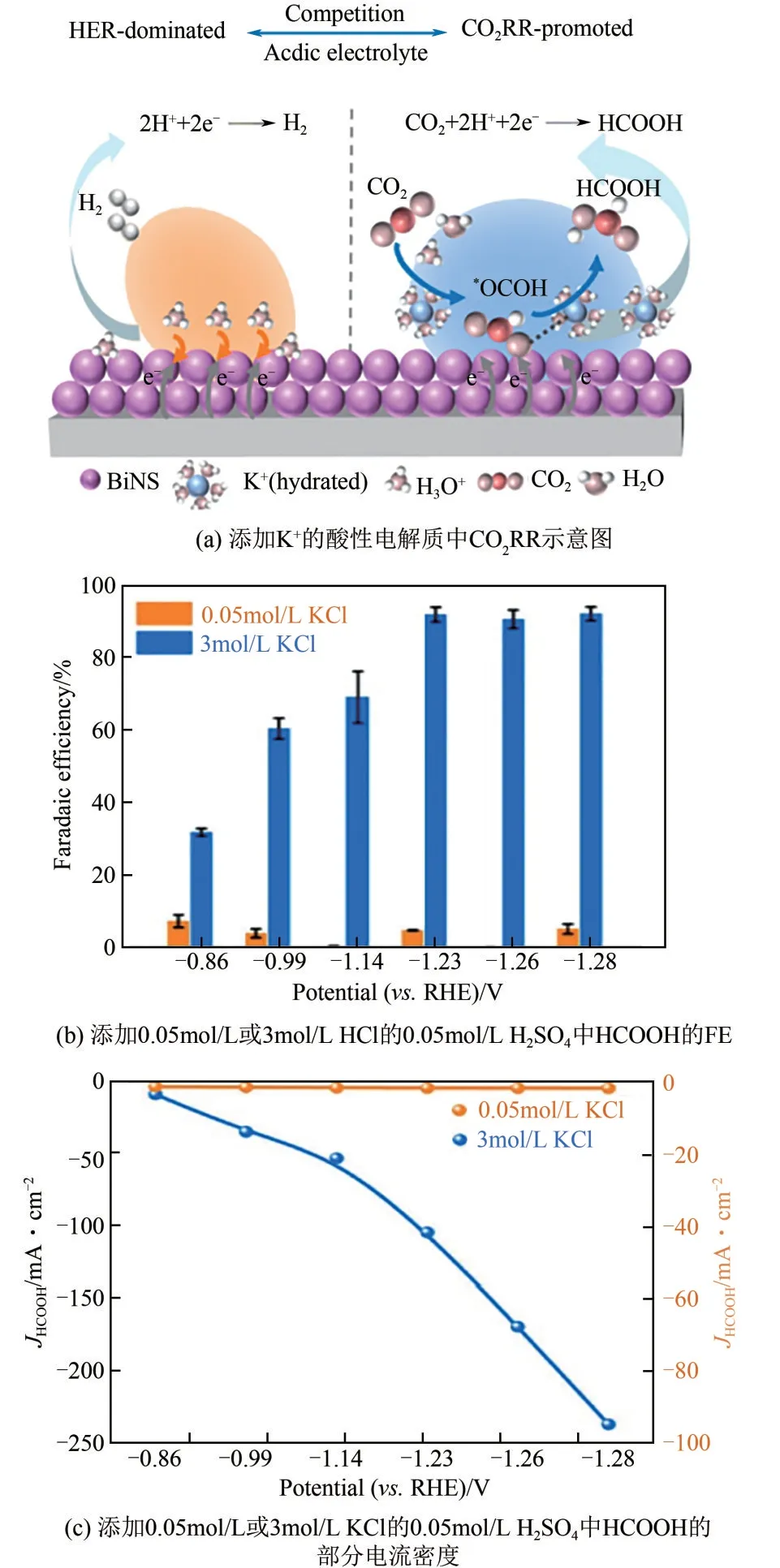
图5 酸性电解质中的的CO2RR示意图及其性能[39]
2.2 Sn
Sn 不仅具有环境良性,而且在自然界中存储量丰富,相对地壳丰度较高,中国和印度尼西亚的总产量约占全球初级产量的67%[40],有利于大规模工业化和产业化的转化应用。根据Jaramillo 等[40]以*OCHO 结合能作为HCOO-部分电流密度的描述符时,具有明显火山形趋势[图6(a)、(b)]可以发现,Sn 出现火山顶部附近,具有近乎最佳的*OCHO 结合能生产HCOO-,对甲酸的活性更高;与以*COOH 作为描述符的火山图曲线[图6(c)]进行对比可得,氧结合中间体和Sn 表面的相互作用,与碳结合中间体相比来说更加强烈,即与生成一氧化碳相比,Sn对甲酸的选择性也更高[41]。

图6 分别使用*COOH、*OCHO结合能作为描述符绘制火山型曲线(−0.9V vs. RHE)[41]
Broekmann 等[42]通过对SnO2在CO2RR 期间的氧化态变化的探究,有力证明其氧化物可以用作一种高效的催化剂。当在极高的负电位下SnO2还原为金属Sn 后,甲酸酯的生产效率显著降低。鉴于表面氧化层可能发挥的独特作用,许多研究工作致力于开发各种不同相貌以及含缺陷结构的SnOx纳米材料及其复合结构。Nguyen−Phan 等[43]展示了用于将CO2转化为甲酸盐的三维(3D)中空纳米球电催化剂[图7(a)],与SnO2纳米颗粒相比,纳米球催化剂具有更高的性能,这可归因于其初始结构提供了更高的电化学表面积,并防止了CO2还原过程中广泛的纳米晶体生长,持续电流密度可达500mA/cm2。但是要注意的是,在电化学过程中,部分锡的氧化物将不可避免地还原为金属锡,从而形成金属氧化物和金属界面[44]。在这些界面上,锡的不同价态(Sn0、Sn2+和Sn4+)可能同时存在,对于不同的表面锡价态或金属氧化物/金属复合界面,目前其具体影响机制研究难度较大。Chen 和Kanan[45]评估了SnOx层对二氧化碳还原效率的影响,研究发现SnOx/Sn 界面可以在一定程度上抑制析氢反应。相比于有原生SnOx层的Sn电极催化剂,电沉积Sn0和SnOx之后的催化剂性能表现更好,催化剂的分电流密度和还原效率提高了8 倍,法拉达效率提高了4 倍。对于锡基催化剂,通过适当的结构设计将其表面锡原子保持在正氧化状态,是提高其催化活性和选择性的有效策略。如图7(b),An等[46]结合DFT计算研究了不同表面氧化物物种对催化性能的影响,二价Sn2+对HCOOH的选择性高于Sn4+和Sn0,Sn4+的存在可以有效地减小二氧化碳还原的过电位,催化过程实际上是由复杂的表面氧化物物种协同控制。另外,将其他元素掺入金属氧化物的晶体晶格也是提高电催化剂电化学性能的一种有效方法。Ko等[47]报道F掺杂SnO2(FTO)电催化剂,甲酸最大法拉第效率可达95%,最高部分电流密度达到330mA/cm2。此外,在100mA/cm2电流密度下,可保持90%以上的FE 连续工作7 天。根据DFT 计算,氟掺杂不仅增强了HCOO−和FTO 表面之间的相互作用,还改变了二氧化碳的电子结构以促进电子转移。

图7 Sn基金属氧化物催化剂及不同价态的影响[43,46−47]
此外,因其独特的表面结构、局部环境和高导电性、良好的热稳定性等特性[48],金属硫化物被作为优化性能的有效方法。Zheng 等[49]基于原子层沉积策略,将硫原子引入Sn 表面后还原合成Sn(S)催化剂。Sn(S)/Au最大法拉达效率为93%(-0.75Vvs.RHE),在运行40h 后FE 变化在2%以内。硫原子的引入会导致表面晶格变形,从而产生不协调的活性Sn 位点。另外,Chen 等[50]通过表面化学改性调控SnS2纳米片电子结构,将氧引入SnS2纳米片(SnS2-xOx)表面,实现了Sn活性位点的暴露和最优的Sn电子态,从而增强了CO2的吸附和活化,提高催化性能。具有表面氧改性的SnS2纳米片对C+产品法拉第效率可达91.6%(-0.90Vvs. RHE),其中包括83.2%的甲酸盐和16.5%的CO/H2合成气(比例为1∶1)。另外,元素掺杂也是设计实现二氧化碳电还原的高效催化剂的策略。不仅有助于带结构和电荷再分配,还有助于调整活性位点的价态[41],从而提高电催化活性。Zhang 等[51]开发的Ni 掺杂的原子薄SnS2纳米片,缺陷数量的增加暴露了更多活性位点,从而促进二氧化碳的激活。与原始的SnS2纳米片相比,当Ni 掺杂量为5%(5%Ni−SnS2)时,碳质产品的最大法拉第效率为93%,催化剂性能显著提高。
2.3 In
与Sn 和Bi 类似,In 也是具有低毒性和环境良性,对人类健康和环境几乎没有危害。但就价格而言,由于在地壳中的分布较少和分散,In的价格相对高于Sn和Bi[52],大概是Sn和Bi的10倍。In在环境条件下,其表面会形成一层天然氧化层,经研究表明,在还原反应过程中,这个氧化层可能会部分保持,并通过增强稳定CO2和反应中间体之间的吸附促进反应进行[53]。Bocarsly 等[54]在使用前立即蚀刻得到对照铟电极,对本身存在天然氧化层的In电极进行测试,发现甲酸酯的选择性明显提高到80%以上,并且可以在-1.5~-1.8V(vs.SCE)保持一个较长时间的稳定性。基于目前研究来看,In基催化剂出色的CO2RR 性能主要归功于金属位点的氧化状态[55]。因此,为在二氧化碳还原过程中有效维持氧化态,夏宝玉教授团队[56]提出了一种碳包覆限域的氧化铟催化剂(In2O3@C),通过碳层的保护及其良好的导电性,避免在反应过程中铟基催化剂被还原为金属态[图8(a)]。结合理论计算,该作者指出碳层和原位生成的氧空位与氧化铟纳米颗粒之间存在紧密的电子协同作用,在调节催化剂电子结构的同时也优化了对关键反应中间体的吸附能力,进而进一步改善了本征催化活性。
而金属有机框架(MOF)由于具有设计合成简单以及具有高孔隙度、大比表面积和可调谐化学结构[57]等优势,成为近几年最有前景的材料之一。除了直接充当催化剂或启动剂外,MOF 还经常作为催化剂前体。最近,如图8(b),Xia等[58]开发的氨基功能化铟有机框架催化剂(MIL−68(In)−NH2),其中固定化的氨基通过加强二氧化碳的吸收和激活稳定了活性中间体,有助于增强催化二氧化碳转化为甲酸盐,在-1.1V(vs.RHE)时表现出94.4%的高法拉达效率和108mA/cm2的偏电流密度。另外,由于单原子催化剂原子利用率高,活性中心相对均一,Chen 等[59]以金属有机骨架ZIF−8 为碳源和氮源,通过原位封装及热解法得到了具有Inδ+−N4原子界面结构的In 单原子催化剂(In−SAs/NC),催化剂活性显著提高。

图8 两种In基催化剂设计思路[56,58]
2.4 Pb、Sb等
Pb、Sb、Hg、Cd、Tl 等金属元素尽管具有较大的活性,但因其内在毒性和环境不友好性,严重限制了其实际的大规模应用,因此并未得到太多关注。Pb 可以在负电位较低的情况下选择性生成甲酸酯的FE>90%[60],甚至接近理论平衡电势。然而,容易出现CO 中毒现象,会导致电流密度衰减和运行周期降低[61]。李彦光教授团队[62]通过引入金属银与钯进行合金化,制备钯银(Pd−Ag)合金纳米线,利用电子效应作用来调控钯的电子结构,有效降低了Pd 的d 带中心,从而削弱CO 与Pd 位点的结合,增强催化剂的抗毒化能力,在较宽的电位区间(0~-0.3Vvs.RHE)甲酸盐选择性均大于90%。
而Sb在元素周期表中与Sn和Bi相邻,相比于Bi 来说,价格更加低廉,地壳丰度也高出几个数量级,但其基本机制仍不清楚[63]。An 等[64]将3D 散装材料转变成二维(2D)形式用于增强活性边缘位点的暴露,促进高催化活性。结合DFT 理论计算,该作者分别考虑了Sb 的五个典型方面和六个不同的层厚度。其中,基底平面和边缘Sb 位点对*OCHO都表现出优于*COOH和*H的吸附,而在占主导地位的Sb(001)面(双层)具有最高的催化活性,与实验数据相符。此外,还可以通过应变工程提高Sb 双层的CO2RR 性能,压缩应变可以诱导费米水平附近电子状态的增加,并促进Sb p轨道的离域化,从而改善*OCHO在Sb位点上的吸附[65]。
3 原位表征手段
识别确定催化剂的活性位点或物种及其在反应过程中的动态演变,是合理设计对CO2RR 中有价值的产品表现出高活性和高选择性的催化剂的先决条件[66−67]。在实验条件下,实时检测反应中间体和催化产物是了解反应机理和进一步优化催化性能的关键。再结合DFT 理论计算,得到关于反应中间体吸附强度与吸附构型等的证据,即可印证对于催化机理和催化路径的推测。然而,由于催化剂通常随着反应的进行而变化,传统的表征技术无法捕捉催化剂表面反应中间体的短暂演变,这使得很难通过传统的表征技术来监测演变。因此,可以利用原位表征技术进行捕获和监测,以识别催化剂的动态演化并实时检测反应过程的中间物种变化状态,有利于对催化反应反应机制、材料结构和表面位点等产生更深入了解。本文主要介绍原位光谱技术(红外光谱、拉曼光谱)和原位X射线表征技术(XRD、XPS、XAS)这大两类表征手段。
3.1 原位红外
红外光谱学通过与红外线的相互作用分析表面吸收物种分子振动。然而,由于水的强烈红外信号的强烈干扰,红外光谱学在电化学反应中的直接应用受到限制。为解决该问题,衰减全反射红外光谱(ATR−IR)得以开发,从分子水平在线监测电极表面中间体的吸脱附行为、电极自身结构的演化和电极表面微环境等[68]。目前已被广泛用于研究Sn、In、Bi等催化剂在实际工作条件下的表面化学。
(1)可以对催化反应关键中间体进行实时检测,精确监测动态行为,进一步解释催化机制。Wei 等[69]通过对吸附在Cu 纳米颗粒表面[涂有50nm厚的聚苯胺薄膜(PANI)]的中间体*CO 表面覆盖度的检测,来探究C2+碳氢化合物FE 提升的原因。中间体*CO 的吸收峰在Cu−PANI 电极表面更强,表明*CO 的表面覆盖度更高。即由于CO 中间体的覆盖范围和相互作用的改善,促进了*CO−*CO 偶联形成多碳产物。Sui 等[70]通过原位漫反射傅里叶变换红外光谱(DRIFTS),以确定制备催化剂上的CO2气体动态吸附过程。吸附平衡的峰值强度更高和时间更短,则表明物理吸附能力更好,确保有足够的CO2反应物可以快速到达电催化剂表面。
(2)也可以用于电极表面新物种的探测,来研究其反应过程中优先的反应途径及演化过程。DFT理论计算表明在Cu 催化剂表面C2+产物会通过CO中间体二聚从而形成C—C 键,但是直接的光谱证据很难捕捉到,Kim等[71]对电沉积制备的ED−Cu和通过喷涂电化学还原Cu(OH)2制备的P−Cu采用衰减全反射-表面增强红外光谱(ATR−SEIRAS),实时监测触发C1和C2通路中间体的动力学行为(图9)。在P−Cu表面直接观测到CO中间体独有的二聚形成OCCO(1562cm-1)中间体路径,而不是经过*CHO(1760cm-1)中间体,且CO 二聚化与CO 吸附(约5s)同时发生,而质子耦合还原形成*CHO 的动力学还原则较慢(约30s)。说明C—C 耦合完全通过CO二聚与*OCCO进行,没有*CHO的参与。
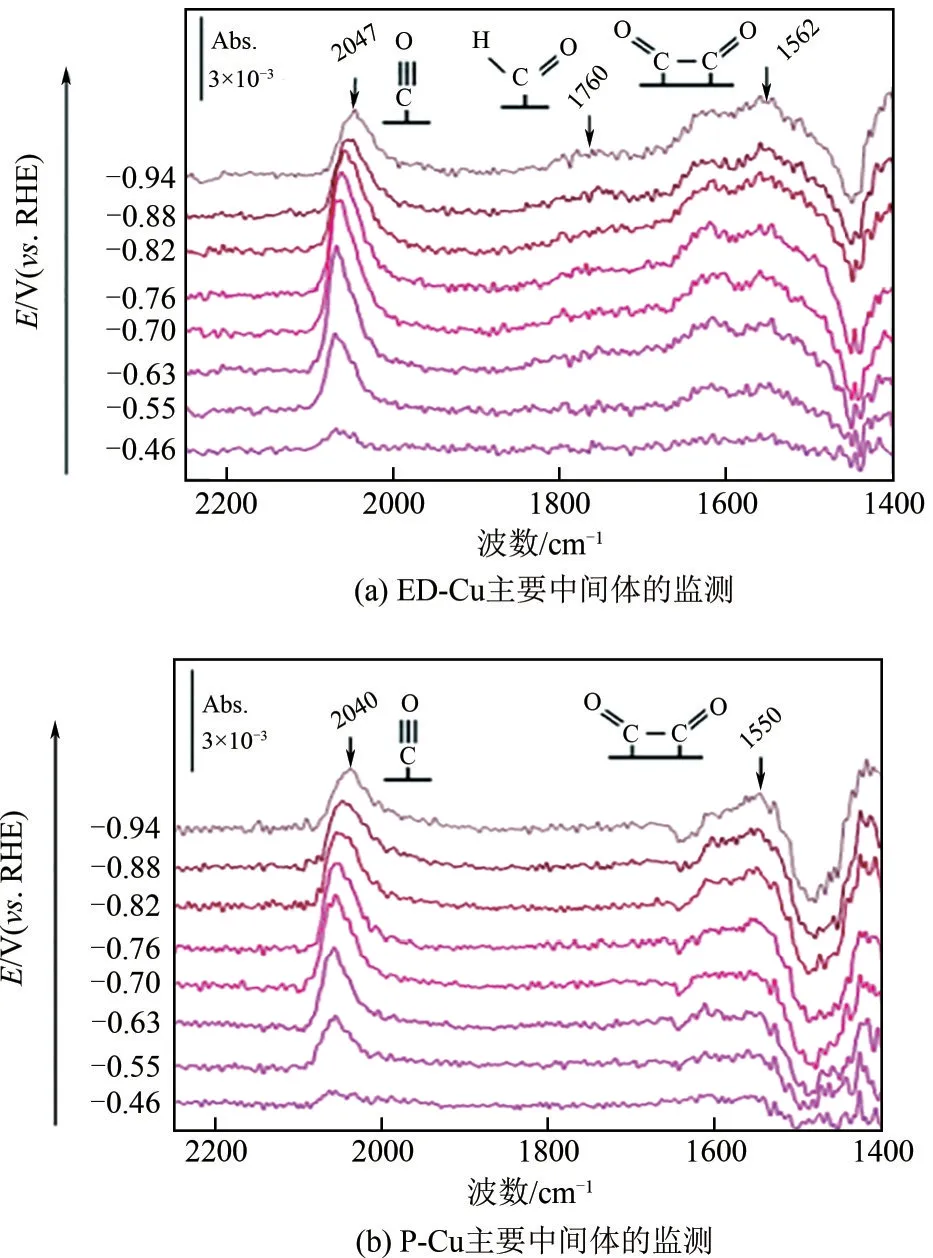
图9 饱和0.1mol/L KHCO3 D2O中,ED−Cu和P−Cu的原位ATR–SEIRAS分析[71]
(3)还可以探究反应环境的影响,比如对电极表面pH 的分析,可以根据电极表面上吸附的HCO3-和CO32-的比例来确定电极表面pH 的大小[72],或是探究电解液中阴阳离子等的影响。Shao等[69]利用同位素标记和ATR−SEIRAS观察铜催化剂表面吸附的CO,证明CO2是由碳酸氢根离子通过溶解平衡提供,从而驱动CO2RR,在电极表面形成了线性吸附CO和桥式吸附CO。电解液阳离子的性质会影响CO2电还原的法拉第效率和选择性,但是Banerjee等[73]结合原位红外探测十六烷基三甲基溴化铵(CTAB)和不同尺寸碱金属阳离子对界面水的红外吸收和C—H峰发现,带正电荷的三甲基铵表面活性剂分子有效取代了碱金属阳离子并且抑制了析氢反应,也就是存在CTAB时,催化活性和选择性与碱金属阳离子尺寸(如Li+、Na+、K+)无关。
3.2 原位拉曼光谱
拉曼光谱表征分子的电子云极化率的改变,在谱图上可以与红外光谱进行补充说明。在复杂的外部反应条件下,原位拉曼光谱通过快速追踪表面吸收物种的结构演变过程,对催化剂的表面重建进行表征,协助揭示真正的活性相。对于研究CO2RR体系的构效关系以及进一步指导高性能催化剂设计合成具有重要意义,但也存在着空间分辨率较低和对催化剂表面演变的较小敏感性的限制[74]。如图10所示,Wang等[75]采用原位拉曼光谱技术,分别在开路电位和应用电位(-1.01Vvs.RHE)下实时检测Bi/Bi2O3预催化剂在反应过程中的表面重构。Bi2O3纳米颗粒转变为嵌入Bi 纳米晶的Bi2O3纳米片,明确Bi/Bi2O3纳米片作为真实的反应活性相参与反应。He 等[76]通过原位拉曼光谱对含有H2O2电解质时的Cu 进行探测,观察其表面物种的动态演化过程,发现通过CO2与H2O2在铜表面发生共电解,形成了一种拉曼非活跃氧化铜物种(Cuδ+−RI)。稳定的含氧催化结构的引入成功提高了Cu 基催化剂的选择性,且使电催化CO2还原生成CH4的速率提高200倍。

图10 Bi2O3 NPs电化学转换过程的原位拉曼光谱[75]
另外,原位拉曼光谱还可以用于对反应过程中的中间物种关键中间体的探究。Zhao等[77]通过电化学处理策略合成了具有核心壳结构的Sn 掺杂Bi/BiOx纳米线[Bi/Bi(Sn)OxNWs],通过原位拉曼光谱来观察表面的动态演变,结合DFT理论计算可得,将Sn原子引入BiOx物种可以促进Bi(Sn)Ox表面*OCHO中间体的稳定,并抑制竞争性H2/CO的生产。
3.3 原位X射线表征技术(XRD、XPS、XAS)
原位X射线衍射(XRD)技术可以实时检测催化剂的晶体相,以进一步分析催化剂的稳定性和相变,为设计高效催化剂提供技术支持,但有一定的限制,只能用于分析晶体样本[67]。与XRD 技术不同,原位X射线光电子光谱(XPS)技术可根据化学位移,用于识别特定元素[78],分析该元素的价态组成和变化。但是由于检测深度有限,原位XPS技术只能检测表面附近的元素,很难发现催化剂的内部结构变化[67]。除传统的X 射线分析外,近年来,基于同步辐射X射线的原位表征技术得到了迅速发展。以亚原子分辨率的原位XAS技术为例,包括X射线吸收近边缘结构(XANES)光谱和扩展X 射线吸收精细结构(EXAFS)光谱。X射线吸收光谱(XAS)可以提供有关价电子分布的信息,通常对较轻的元素(如碳)不敏感,但可以通过监测催化剂状态和协调的微小变化来间接检测到吸附物种。即使在极小和复杂的催化剂上,也能够探测特定原子的结构信息[66]。如图11 所示,Ko 等[47]采用原位Sn k−edge XANES光谱比较SnO2和F掺杂SnO2(FTO),发现SnO2表现出强烈的电解质诱导能量位移,并显示出很大一部分金属Sn。相比之下,FTO 的光谱在还原电位上只显示很小的能量变化,氧化态变化非常小。说明SnO2的表面被转换为金属Sn,但FTO表面的氧化状态在高阴极过电位下保持,增强FTO 了的稳定性,有助于提高电流密度和耐用性。而Choi 等[79]将XPS 和XANES 相结合,明确了增强活性和稳定CO/甲酸盐(HCOO-)选择性的关键是Snδ+/Sn物种的高度粗糙表面。

图11 SnO2和F掺杂SnO2(FTO)的原位Sn k−edge XANES光谱及线性分析[47]
4 结语与展望
目前来看,使用可再生能源通过电催化二氧化碳将其转化为甲酸盐的反应,可以同时解决间歇性可再生能源的储存需求和减少温室气体排放这两个难点,具有广阔的发展前景。本文对用于甲酸生产的CO2RR 主要金属基电催化剂材料进行了简要的概述,包括Sn、Bi、In、Pb、Hg、Cd、Tl 等。由于Pb、Hg、Cd、Tl 剧毒且对环境有害,而In 的成本又相对较高,最理想的催化剂选择为Sn 或Bi。而对于如何合理地设计催化剂结构、探究新的反应机理和电极表面微环境等,原位表征手段起到重要作用。本文主要介绍了原位红外光谱和原位拉曼光谱,简要描述了原位X射线表征技术(XRD、XPS、XAS)。另外,站在当前进展的现状上,未来的研究还存在以下几个方面的机遇与挑战。
(1)除了电催化剂材料本身的设计,由于电化学系统的复杂性,仅靠高性能的电还原二氧化碳催化剂并不足以满足前文提到过的商业化要求,CO2RR的发展还依托于电解质、电解器的结构设计等。目前大多数CO2RR 反应是在液态电解质中进行的,电解质的局部pH[80−81]和阴阳离子浓度(尤其是碱金属[82])等均与反应有着复杂的关系。关于电解器的设计,H型电解池和流动型电解池这两种较为成型,流动电解池存在气体扩散层体系,具有更丰富的三相界面。CO2可以直接扩散到催化剂-电解质−CO2三相边界进行反应,不受电解质溶解度的限制,从而大大提高反应性能。MEA 膜电极电解池[83−85]近年来也被认为是非常有发展前景的能量转换和存储系统之一。不同类型的膜[86](质子交换膜、阴离子交换膜和双极膜)以及反应物和产品的输送过程,也都影响着CO2RR 的整体性能和进一步的规模化转换。
(2)阴阳极电催化耦合。设计阴极和阳极电合成单一化学品的电催化系统,同时实现CO2RR 和高效、高附加值的有机氧化反应。华东师范大学施剑林院士等[87]利用非贵金属催化剂,通过耦合阴极CO2RR 和阳极甲醇氧化反应(MOR),实现了低电压条件下在同一电化学反应器中同时从阳极和阴极产生相同的化学品甲酸。该工作中阴极和阳极所采用的催化剂是不同的,而近日天津理工大学鲁统部教授等[88]报道了一种分层双功能Cu−Sn合金电催化剂,可以同时用作CO2RR 和MOR 的阴极和阳极,并达到创纪录的高甲酸盐产率3313μmol/(h·cm2)。
(3)与其他催化方式相结合。为了规避二氧化碳电还原的产物局限性,可考虑通过级联方式CO2先电还原为某产物,再使用碳酸酐酶和甲酸脱氢酶、甲醛脱氢酶和乙醇脱氢酶[89]等酶催化剂进一步反应,得到更复杂的高附加值产品。这类生物催化技术开发的关键挑战在于电极和酶连接的要求很高,以及电极和酶之间形成界面[90]。或者是基于电化学法和生物法的微生物电合成系统(MES)[91−92],利用电活性微生物作为催化剂,将CO2转化为挥发性脂肪酸、醇类等更高附加值化学品[93]。电子科技大学夏川团队[94]将电催化与生物酶催化耦合,开辟了电化学结合活细胞催化制备葡萄糖等粮食产物的新策略,先由水和二氧化碳到乙酸,再通过经工程改造的酵母微生物催化合成葡萄糖和游离的脂肪酸等,有效提高碳的附加值。
(4)理论计算及机器学习。可计算包括态密度、差分电荷密度、CO2RR 反应过程[95−98]等内容,用于反映电化学催化剂的电子结构性质、电子转移情况、催化过程中的能量变化等。密度泛函理论(DFT)计算用于研究电催化剂的结构、性能和反应机制,成为筛选新型电催化剂和研究过程机制的主要工具[99]。另外,近年来机器学习(ML)也在快速发展,与传统DFT 方法相比,ML 与DFT 方法相结合后,运算速度大幅度提升,在探索稳定新材料方面快30 倍,在预测和评估单个原子催化性能方面快130000 倍[100],大大降低了DFT 计算成本。将实验与理论进行信息交互,使其相结合,协同发挥各自的功能,有利于推动高性能电催化剂的合理设计。

