抗SARS-CoV-2相关线性表位抗体诱发小鼠神经炎性反应
许津铭,洪语萱,韦 晖,许 琪*
1.中国医学科学院基础医学研究所 北京协和医学院基础学院 国家医学分子生物学重点实验室,北京 100005;2.北京市第一六六中学,北京 100006
由新型冠状病毒SARS-CoV-2引发的COVID-19疫情已导致全球近5亿人感染,因病死亡人数高达580万[1](最新COVID-19感染数据的参考网址:https://covid19.who.int/)。研究显示,COVID-19患者广泛存在中枢神经系统(central nervous system, CNS)相关的并发症或后遗症。据统计,超过1/3的COVID-19患者会出现程度不一的神经精神症状,包括头疼、味觉与嗅觉丧失、幻觉甚至癫痫发作等。值得注意的是,这些症状往往并不随患者的康复而消失,迁延周期较长,表明SARS-CoV-2感染会造成较难修复的CNS损伤[2]。由SARS-CoV-2引发的人体免疫系统过度激活,导致B淋巴细胞介导的体液免疫稳态失衡是造成患者CNS损伤的重要基础[3]。其中,SARS-CoV-2的刺突蛋白(S蛋白)是介导病毒侵入人体细胞的关键分子,亦是当前各国疫苗研发的主要靶点。针对S蛋白最新的抗原图谱研究显示,COVID-19患者体内存在大量针对S蛋白不同线性多肽表位的IgG抗体,但这些抗体大多数不具备针对SARS-CoV-2的病毒中和能力[4]。血清学检测显示,S蛋白的线性表位IgG抗体滴度与COVID-19患者的病情严重程度正相关,部分抗体在患者群体中的响应率较高(>50%),且能以较高滴度存留较长时间(>60 d)[4]。这些长期存在的“无效”抗体可能参与了包括CNS损伤在内的COVID-19相关并发症或后遗症的病理过程。
基于此,本研究选取已报道的一个S蛋白线性表位S2-78(1 148-FKEELDKYFKNH-1 159)作为研究对象。该线性表位的血清IgG抗体在COVID-19患者中的总体响应率达69.3%,抗体滴度是健康对照的129倍,居所有已报道线性表位第1位。通过构建针对S2-78的免疫小鼠模型,观察其行为学和病理学改变,以探讨SARS-CoV-2非中和抗体造成CNS损伤的可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:8周龄SPF级C57BL/6J,并雄鼠8只,购买于斯贝福(北京)生物技术有限公司在中国医学科学院动物中心饲养。饲养标准为4只/笼,温度区间为20~24 ℃,湿度区间为50%~70%,光照时间为8:00~20:00,自由饮水摄食。
1.1.2 主要药品与试剂:血蓝蛋白偶联的S2-78多肽(keyhole limpet hemocyanin-S2-78,KLH-S2-78)(KLH-FKEELDKYFKNH,上海生工生物工程公司);兔抗鼠离子化钙结合适配分子(ionized calcium-binding adapter molecule 1,IBA1)多克隆抗体、辣根过氧化物酶标记的驴抗鼠二抗(Abcam公司);AlexaFluor®594荧光基团标记的驴抗山羊二抗(Thermo Fisher公司);DMB显色剂(北京索莱宝科技公司);蔗糖、奎宁、盐酸胱氨酸、牛血清白蛋白、吐温20和磷酸盐缓冲液(Sigma-Aldrich公司)。
1.2 方法
1.2.1 小鼠免疫注射:按照50 μg/只的剂量使用KLH-S2-78免疫4只8周龄C57BL/6J小鼠作为实验组(KLH-S2-78,KS);按照50 μg/只的剂量使用KLH免疫4只8周龄C57BL/6J小鼠作为实验对照组(KLH-Vehicle,KV);无任何处理的2只8周龄C57BL/6J小鼠作为阴性对照组(Negative control,NC)。共免疫4次,前3次免疫间隔一周,第3次与第4次免疫间隔两周(图1A)。
1.2.2 前脉冲抑制(prepulse inhibition, PPI):在25 min的测试过程中,实验动物接受惊反射刺激(120 dB的白噪声)、前脉冲刺激(70、75、80、85 dB的白噪声)、前脉冲联合惊反射刺激(70 dB、75 dB、80 dB、85 dB的前脉冲刺激及间隔100 ms的120 dB惊反射刺激)、恒定背景噪声(65 dB的白噪声)共4种模式的处理。实验开始后,给予每只动物5 min适应时间,之后每种类型的模式以假随机的顺序出现8次。每个模式间的间隔为15~25 s。每次测试后喷洒30%乙醇去除气味并清理残留物。
1.2.3 双瓶偏好实验:用50 mL离心管制成测试饮(糖/苦)水用瓶,每管盛有25 mL 1.5%蔗糖溶液(m/v)或25 mL奎宁溶液(1.5 mmol/L)。实验总时间为4 d,测试前预适应48 h,双瓶饮水。为了防止实验鼠饮(糖/苦)水位置偏好,在预适应和正式检测的24 h时间点都进行糖水和苦水的位置交换。在预适应48 h后,禁水24 h,记录恢复饮水后2 h内实验鼠双瓶偏好的实验结果。通过前后称取水瓶重量计算糖水、苦水以及液体总消耗量和糖水偏好百分比:糖水偏好百分比=糖水消耗(g)/(糖水消耗+苦水消耗)×100%
1.2.4 旷场实验:将小鼠放入旷场正中心,进行自发运动和焦虑样行为测试,记录小鼠10 min的行动轨迹,每次测试后喷洒30%乙醇去除气味并清理残留物。用Anymaze软件分析小鼠旷场实验结果。
1.2.5 食物小球埋藏实验:将干净的垫料均匀地铺在笼盒里(约3 cm厚),再将实验用巧克力埋藏在垫料下约0.5 cm处使巧克力完全不可见。禁食24 h后将小鼠放在笼盒的正中央,按下计时器开始计时。当小鼠找到巧克力并且开始吃的时候按下计时器停止计时,这段时间则是小鼠寻找巧克力的时间,记录此数据用于统计分析。若小鼠在300 s内都没有找到巧克力,则停止计时,并记为300 s。
1.2.6 ELISA抗体效价水平检测:每孔加入10 μg/L多肽溶液100 μL用于包被,漂洗3次后每孔加入200 μL盐酸胱氨酸溶液用于封闭剩余的马来酰胺基,漂洗3次后40 ℃烘干3 h封口避光保存。使用PBS稀释待测血清样本或质检血清样本后,加入96孔板,每孔加入100 μL,并于37 ℃孵育2 h;漂洗3次后,加入HRP标记的兔抗鼠IgG抗体(1∶40 000),每孔100 μL,4 ℃孵育1 h;漂洗3次后每孔加入50 μL显色剂室温避光显色10 min,每孔加入25 μL终止液后,用酶标仪检测A450吸光值(A)。 结果判定:待测孔A450/阴性孔≥2.1则为阳性孔,阳性孔血清的最大稀释度即为待测样品的滴度。
1.2.7 组织免疫荧光染色:牺牲小鼠后将脑组织制成2 μm的石蜡切片,在经过脱蜡和抗原修复处理后,用5% BSA室温封闭20 min;加入兔抗小鼠IBA1(1∶1 000)4 ℃孵育过夜;PBS漂洗3次后滴加二抗溶液(1∶1 000),室温避光孵育1 h。PBS漂洗3次后滴加DAPI染色8 min,用防荧光淬灭剂封片,使用正置显微镜观察荧光结果。使用Image J对脑组织中的相关细胞进行组织学定量分析。
2 结果
2.1 KLH-S2-78多肽免疫小鼠产生高滴度anti-S2-78 IgG抗体
经总计9周的环境适应、免疫建模和行为学表型检测后牺牲小鼠,并留存外周血和大脑组织(图1A)。ELISA检测显示,在1∶100滴度下,阴性对照组(NC)小鼠及实验对照组(KLH-vehicle,KV)小鼠外周血血清中的anti-S2-78 IgG抗体信号均低于检出判读阈值(A450<0.2)。实验组(KLH-S2-78,KS)小鼠外周血中检出高滴度anti-S2-78 IgG抗体(最高滴度为25 600,A450=0.305 5),显著高于NC组和KV组(P<0 .0001)(图1B)。

A.experimental workflow; B.serum anti-S2-78 IgG titers
2.2 KLH-S2-78多肽免疫小鼠出现精神病样行为学改变
在惊吓反射实验中,KS小鼠的前脉冲抑制率(PPI%)较KV小鼠降低,在70-80 dB的预脉冲强度下均具有显著性差异(P<0 .05)(图2A)。
在糖水偏好实验中,KS小鼠和KV小鼠的糖水摄取率差异无统计学意义(图2B)。在食物小球埋藏实验中,KS小鼠的进食潜伏期较KV小鼠显著性增加[F(3,2)=9.04,P=0.027](图2C)。
在开放旷场实验中,KS小鼠进入旷场中央区域的次数及停留时间均显著低于KV小鼠(中央进入次数:F(3,2)= 2.71,P=0.004 7;中央停留时间:F(3,2)=2.81,P=0.040)。KS小鼠在旷场中总运动距离较KV小鼠有一定下降,但差异无统计学意义(图2D)。
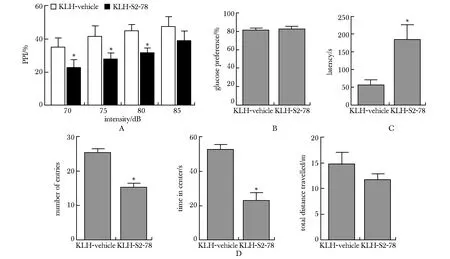
A.startle reflex test; B.two-bottle choice test; C.buried food pellet test; D.open field test; *P<0.05, **P<0.01 compared with KLH-vehicle group
2.3 KLH-S2-78多肽免疫小鼠大脑中小胶质细胞激活增加
脑组织免疫荧光染色显示,在KS小鼠前额叶皮质(prefrontal cortex,PFC)和海马体(hippocam-pus,Hipp)中,单位面积(mm2)下Iba1+小胶质细胞数量较KV小鼠显著性增多[PFC:F(3,2)=5.90,P=0.003;Hipp:F(3,2)= 1.94,P=0.027](图3)。
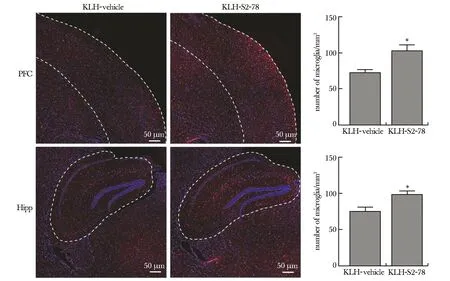
PFC.prefrontal cortex; Hipp.hippocam-pus; *P<0.05 compared with KLH-vehicle group
3 讨论
现有研究证据显示,COVID-19患者体液免疫的病理性改变是导致患者不良预后的重要基础。SARS-CoV-2感染后导致的系统性炎性反应会在急性期诱发呼吸窘迫综合征,而且患者在康复后仍长期处于免疫应激状态,这可能也是S蛋白线性表位抗体在患者体内长期驻留的原因之一。本研究证实,S2-78线性多肽免疫小鼠后确实能够导致外周血anti-S2-78 IgG抗体水平升高,模型小鼠表现出了感觉运动门控缺陷、嗅觉功能受损和自发活动能力受损的精神病样行为学表型,同时大脑前额叶皮质和海马体中小胶质细胞数量显著增加,处于中枢炎性反应应激状态。但在糖水偏好实验中,KLH-S2-78组小鼠和KLH组小鼠的糖水摄取率未见差异,表明S2-78多肽的免疫应激并不影响小鼠的味觉感受,同时也表明实验小鼠无抑郁相关的情绪类表型。
目前对于SARS-CoV-2相关非中和性“无效”抗体的可能生物学功能尚无定论,但推测,其可能通过交叉反应识别与其线性表位同源性较高的内源性蛋白,诱发自身免疫炎性反应[5]。相关的临床研究也支持了这一推论。血清学检测发现COVID-19患者体内针对包括细胞因子、趋化因子、补体和细胞表面分子等主要类别免疫调控蛋白的自身抗体水平显著上升,至少10%的危重症患者出现高滴度的I型干扰素通路自身抗体[5]。这些自身抗体能够通过抑制部分免疫信号通路受体、改变外周免疫细胞的组成从而干扰机体的免疫调控机制和病毒防御机制。
S2-78线性表位的同源性比对显示,其与高等动物的FSTL1蛋白高度相似,与人源FSTL1的序列同源性达89%,与小鼠的同源性达87.5%。这种序列上的高度一致性提示anti-S2-78 IgG抗体可能会识别并拮抗内源性的FSTL1蛋白。FSTL1是一个激活素结合蛋白,可通过激活NF-κB炎性信号通路导致关节炎性反应的发生,其蛋白产物被认为是风湿性关节炎的自身免疫抗原,也是该疾病免疫疗法研发的重要靶点[6]。此外,表达谱数据显示,FSTL1基因在大脑中广泛表达[7]。除寡突胶质细胞外,FSTL1在神经元、星形胶质细胞和小胶质细胞中均有较高的表达丰度。因此,本研究推测,COVID-19患者中升高的anti-S2-78 IgG抗体有可能通过识别大脑中的FSTL1蛋白,从而激活了相应的自身免疫炎性反应通路,导致中枢神经系统的损伤。
本研究具有一定的局限性。首先,外周中升高的anti-S2-78 IgG是否穿越血脑屏障影响中枢及其具体路径有待进一步探索。有临床研究表明Lambert-Eaton肌无力综合征患者外周血清中有针对GRP78的抗体,该抗体可诱导ICAM-1上调、claudin-5表达下调,从而引起血脑屏障通透性增加[8]。部分COVID-19患者会因为免疫系统过度活跃从而触发“炎性因子风暴”,导致正常情况下保护大脑的血脑屏障遭到破坏[9]。因此,COVID-19患者可能由于血脑屏障开放,导致包括anti-S2-78 IgG在内的有害物质进入中枢,进而损伤神经系统,这需要进一步的研究。其次,尽管有研究证实线性多肽表位的识别抗体能够与同源性较高的线性表位发生交叉识别反应[10],但anti-S2-78 IgG是否与人FSTL1蛋白发生直接相互作用仍需进一步证实。

