IL-35对sCD40L刺激后的人脐静脉血管内皮细胞黏附功能的影响
郭巍巍,赵萍萍,于露露,李 明*
南京医科大学康达学院附属滨海县人民医院 1.介入与血管外科; 2.检验科,江苏 盐城 224500
深静脉血栓形成(deep vein thrombosis,DVT)是指血液在深静脉腔内异常凝结,常引起远端静脉高压、肢体肿胀甚至肺栓塞等[1],其发病机制复杂,但血管内皮细胞活化后高表达的黏附分子如细胞间黏附分子(intercellular cell adhesion molecule-1, ICAM-1)、血管细胞间黏附分子(vascular cell adhesion molecule-1, VCAM-1)、P-选择素(P-selectin)、血管性血友病因子(von Willebrand Factor, vWF)等介导炎性细胞和血小板与血管内皮细胞的黏附,是DVT形成的重要因素[2]。可溶性CD40配体(soluble CD40 ligand, sCD40L)是CD40L的可溶性形式,是血小板激活的标志物,可活化血管内皮细胞[3]。白细胞介素-35(interleukin-35, IL-35)是一种新发现的免疫抑制因子,可抑制Th17细胞增殖和血管内皮细胞活化[4],但其对sCD40L刺激后血管内皮细胞黏附功能的影响缺乏报道。本次研究通过检测DVT患者外周血清IL-35、sCD40L、VCAM-1、ICAM-1、P-选择素和vWF的表达,并通过体外细胞模型探讨IL-35对sCD40L刺激后血管内皮细胞黏附功能的影响及其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 病例:选取2020年1月至2020年12月于滨海县人民医院介入与血管外科诊治的下肢深静脉血栓急性期患者30例作为实验组(DVT组),诊断标准符合第3版《深静脉血栓形成的诊断和治疗指南》[5],排除标准:非急性期深静脉血栓患者、合并自身免疫性疾病、血管畸形者、接受过治疗的深静脉血栓患者等。同时选取30例健康体检者作为对照组(HC组),两组年龄和性别差异无统计学意义。本次研究经滨海县人民医院伦理委员会批准(2020/01),所有受试者知情同意并签署知情同意书。
1.1.2 细胞及试剂:人脐静脉血管内皮细胞系(HUVECs)及细胞完全培养基(湖北武汉丰晖生物技术有限公司);细胞因子IL-35(Sigma-Aldrich公司);可溶性CD40配体(sCD40L)(PeproTech公司);IL-35、sCD40L、VCAM-1、ICAM-1、P-选择素和vWF ELISA试剂盒、羊抗鼠、羊抗兔二抗(南京翼飞雪生物技术有限公司);抗VCAM-1、ICAM-1、P-选择素、vWF、NF-κB p65、pNF-κB p65抗体(Abcam公司);DioC(6)荧光染料(亚科因生物技术有限公司);钙黄绿素试剂盒(日本同仁生物技术有限公司)。
1.2 方法
1.2.1 标本的采集:患者均于刚入院未曾用药治疗前采集标本,所有受试者采集外周静脉血2 mL置于肝素抗凝管,1 500 r/min离心10 min后,收集血清置于-80 ℃保存备用。
1.2.2 ELISA检测血清中IL-35、sCD40L及细胞培养上清液中内皮细胞黏附相关因子的浓度:使用ELISA试剂盒检测血清中IL-35、sCD40L及细胞培养上清液中VCAM-1、ICAM-1、P-选择素和vWF的浓度,按试剂盒说明书操作,实验重复3次,取均值。
1.2.3 细胞的培养及分组: 将HUVECs接种至含有10%胎牛血清及细胞生长因子的DMEM完全培养基中,置于37 ℃ CO2培养箱中培养,待其增殖至80%汇合时进行传代。将HUVECs以1×105个/mL接种于6孔板,每孔2 mL。实验分为对照组(加入磷酸盐缓冲液)、sCD40L组(加入25 μg/mL sCD40L)和IL-35组(加入20 ng/mL IL-35和25 μg/mL sCD40L),置于37 ℃ CO2培养箱中,24 h后收集细胞及其培养上清液。
1.2.4 Western blot检测细胞黏附相关蛋白质的表达:使用RIPA裂解液收集蛋白,通过10% SDS-PAGE进行分离,并转移至PVDF膜上,使用5%脱脂牛奶封闭2 h后,TBST摇床上清洗3次,每次10 min,加入抗VCAM-1、ICAM-1、P-选择素、vWF、NF-κB p65抗体、pNF-κB p65、GAPDH抗体于4 ℃过夜,TBST摇床上清洗3次,每次10 min,加入二抗室温孵育1 h后,TBST摇床清洗3次,每次10 min,加入发光显影液后使用Bio-Rad凝胶成像仪显影拍照。
1.2.5 免疫荧光法检测血小板对血管内皮细胞的黏附:使用血小板分离试剂盒分离全血中的血小板,加入终浓度为2 μmol/L DioC(6)染色液标记血小板,室温30 min后离心弃上清,PBS重悬,使其浓度为1×109个/mL,将其与刺激后的HUVECs共培养,2 h后吸弃上清,使用PBS洗除未黏附的血小板后加入适量的Hank’s液,使用荧光显微镜拍照,最后加入细胞裂解液,使用荧光分光光度计测定荧光强度。
1.2.6 免疫荧光法检测外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)对血管内皮细胞的黏附:采集健康人外周静脉血5 mL置于肝素钠抗凝管,采用聚蔗糖密度梯度离心法分离PBMCs,用PBS将其重悬,加入5 μmoL/L的钙黄绿素标记PBMCs,置于37 ℃孵育1 h后,离心弃上清,PBS重悬使其为2×105/mL,将其与刺激后的HUVECs共培养30 min后,吸弃上清及未黏附的PBMCs,PBS洗涤2次,加入1 mL的Hank’s液,荧光显微镜下拍照,最后加入细胞裂解液,使用荧光分光光度计测定荧光强度。
1.3 统计学分析

2 结果
2.1 2组外周血清IL-35、sCD40L、VCAM-1、ICAM-1、P-选择素和vWF浓度的比较
与对照组相比,DVT组IL-35浓度显著下降(P<0.05),sCD40L、VCAM-1、ICAM-1、P-选择素和vWF浓度显著升高(P<0.05)(表1)。
表1 两组外周血清IL-35、sCD40L、VCAM-1、ICAM-1、P-选择素和vWF浓度比较
2.2 3组HUVECs培养上清中VCAM-1、ICAM-1、P-选择素和vWF水平的比较
与对照组比较,sCD40L组细胞培养上清VCAM-1、ICAM-1、P-选择素和vWF水平显著升高(P<0.05);与sCD40L组比较,IL-35组VCAM-1、ICAM-1、P-选择素和vWF水平显著降低(P<0.05)(表2)。
表2 3组细胞培养上清中VCAM-1、ICAM-1、P-选择素和vWF水平比较
2.3 3组HUVECs中VCAM-1、ICAM-1、P-选择素和vWF蛋白表达的比较
与对照组比较,sCD40L组HUVECs中VCAM-1、ICAM-1、P-选择素和vWF蛋白表达显著升高(P<0.05);与sCD40L组比较,IL-35组HUVECs中VCAM-1、 ICAM-1、P-选择素和vWF蛋白表达显著降低(P<0.05)(图1)。
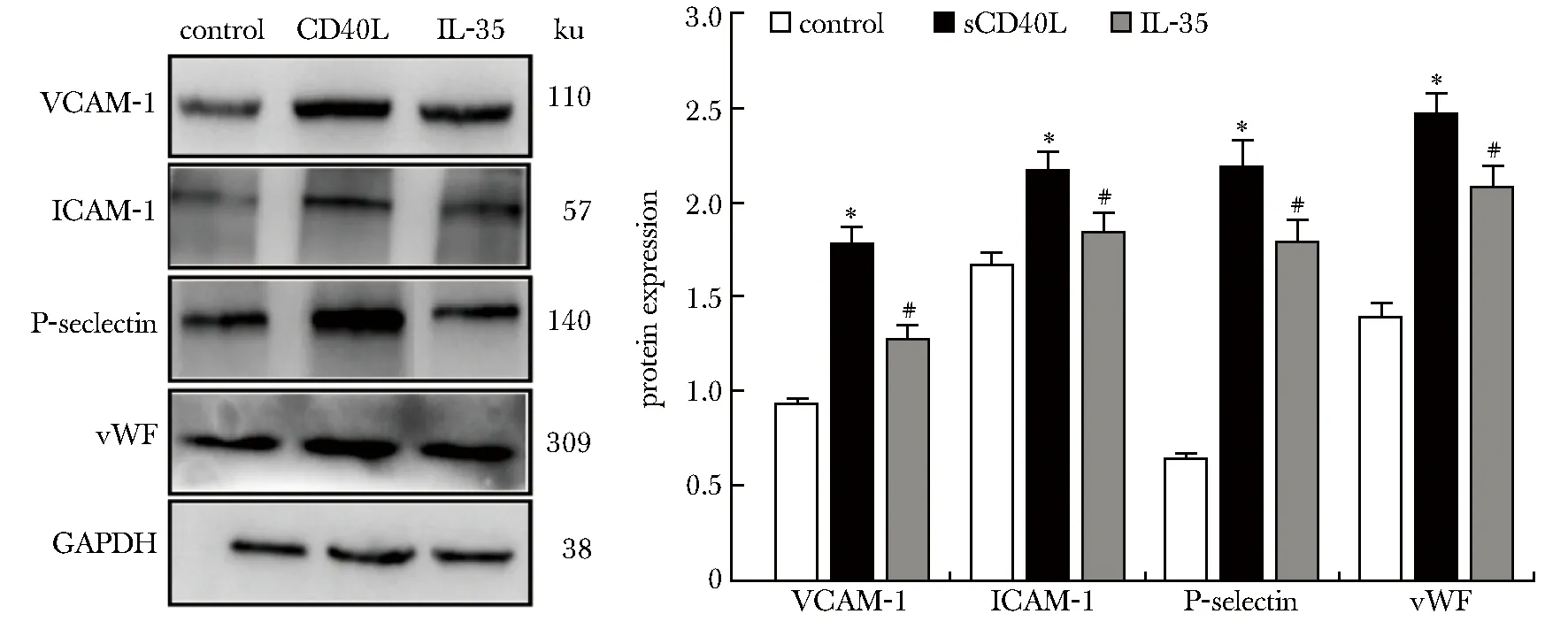
*P<0.05 compared with control group;#P<0.05 compared with sCD40L group
2.4 3组HUVECs黏附血小板荧光强度比较
可溶性CD40配体(sCD40L)组荧光强度为(446±115),显著高于对照组(221±101)(P<0.05);IL-35组荧光强度为(373±132),显著低于sCD40L组(446±115)(P<0.05)(图2)。
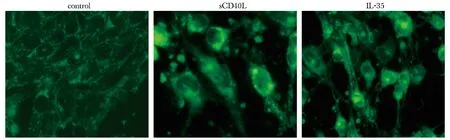
图2 3组HUVECs黏附血小板的荧光图
2.5 3组HUVECs黏附外周血单个核细胞荧光强度比较
可溶性CD40配体(sCD40L)组荧光强度为(202±87),显著高于对照组(76±13)(P<0.05);IL-35组荧光强度为(134±75),显著低于sCD40L组(202±87)(P<0.05)(图3)。
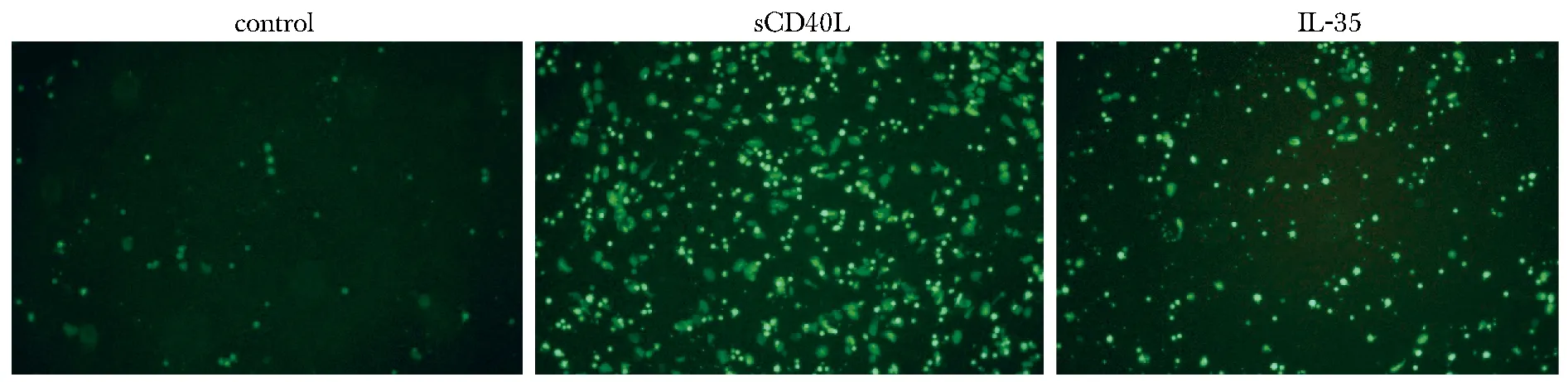
图3 3组HUVECs黏附PBMCs的荧光图
2.6 3组HUVECs中NF-κBp65及pNF-κBp65蛋白表达的比较
与对照组比较,sCD40L组HUVECs pNF-κB p65/NF-κB p65吸光度比值显著升高(P<0.05);与sCD40L组比较,IL-35组HUVECs pNF-κBp65/NF-κB p65吸光度比值显著降低(P<0.05)(图4)。
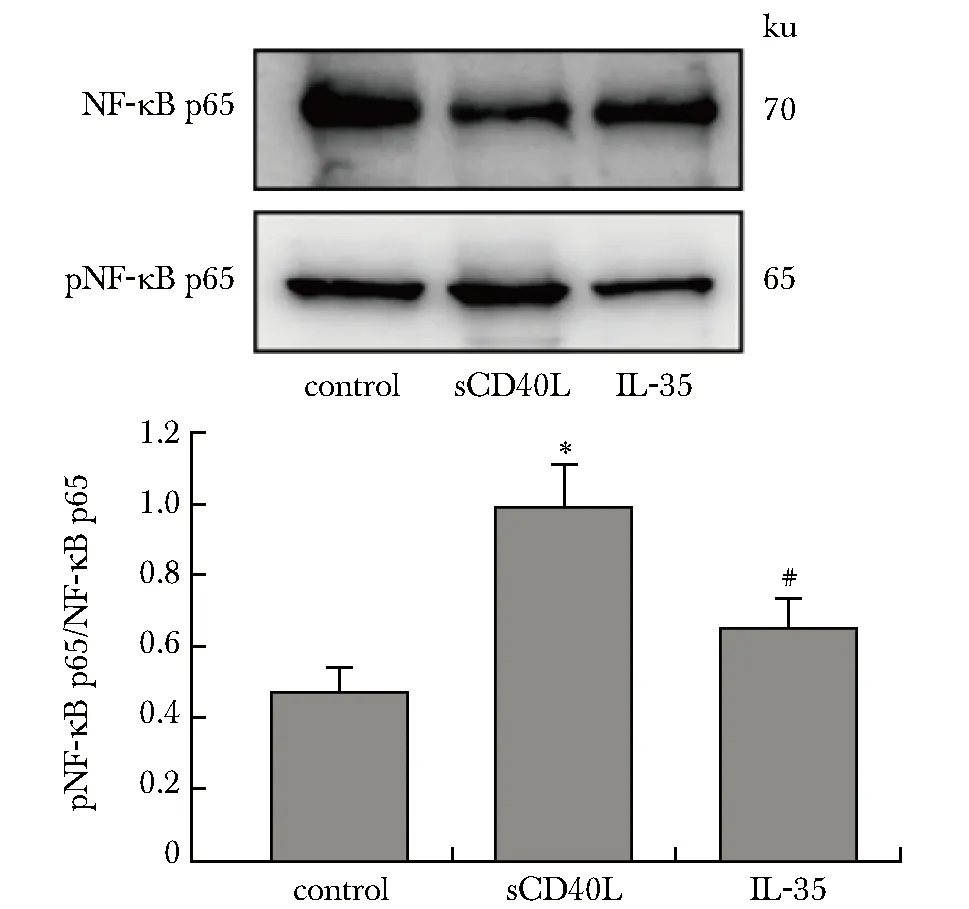
*P<0.05 compared with control group;#P<0.05 compared with sCD40L group
3 讨论
深静脉血栓形成是动态变化过程,主要与血流停滞、内皮细胞活化、血液细胞募集等相关,其中内皮细胞的活化是DVT形成的中心环节。在静息状态下,完整的内皮细胞主要是抗血栓形成,但在病理条件下,血管内皮细胞被激活,释放趋化因子、黏附因子等促进血小板、白细胞等黏附于血管内皮细胞,导致血管内皮细胞损伤,暴露血管内皮细胞基底膜,为凝血系统激活提供了“表面”,促进血栓的形成和生长[6]。其中,VACM-1、ICAM-1、P-选择素主要介导单个核细胞与内皮细胞黏附,血管性血友病因子(vWF)暴露于活化的内皮细胞表面与血小板受体GPIba结合,将血小板招募至受损的血管内皮细胞下,是连接血小板和内皮下组分的分子桥梁[7]。
可溶性CD40配体(sCD40L)是一种促炎性细胞因子,主要通过活化的血小板释放入血液循环,与内皮细胞CD40受体结合后活化血管内皮细胞,促使血管内皮细胞分泌趋化因子、黏附分子等,在炎性反应和血栓中发挥作用[8]。本次研究结果显示DVT患者外周血清IL-35浓度显著降低,sCD40L、VCAM-1、ICAM-1、P-选择素和vWF的浓度显著升高,与报道的相似[9]。体外实验结果表明sCD40L刺激后血管内皮细胞分泌黏附分子VCAM-1、ICAM-1、P-选择素和vWF显著升高,促进外周血单个核细胞和血小板与血管内皮细胞的黏附,报道表面sCD40L促进血小板与内皮细胞之间的黏附作用[10]。
IL-35是一种有效的免疫抑制因子,主要由iTr35细胞和Treg细胞产生,通过抑制炎性反应调节免疫功能,在炎性疾病、肿瘤、自身免疫性疾病及血栓性疾病中发挥着重要的作用。研究表明,IL-35能够抑制T细胞分泌IFN-γ、IL-17、IL-12等促炎性细胞因子,促进Treg细胞分泌IL-10等抑炎性细胞因子[11],本研究结果表明DVT患者外周静脉血清IL-35水平低于对照组,体外实验表明IL-35能够抑制sCD40L诱导血管内皮细胞分泌黏附因子,抑制血小板和单个核细胞与内皮细胞的黏附。报道表明IL-35能够抑制溶血磷脂酰胆碱诱导的血管内皮细胞活化[12]。
此外本研究还检测了血管内皮细胞NF-κB蛋白的表达。结果显示IL-35显著降低sCD40L诱导的血管内皮细胞pNF-κBp65蛋白表达。NF-κB通路是sCD40L激活过程中最具特征的信号通路,参与机体的应激反应和炎性反应,能调控大鼠血栓的形成,主要机制是NF-κB活化后启动多种炎性介质如黏附分子、趋化因子等的释放,形成炎性反应的级联反应,诱发血栓形成[13]。有研究表明,IL-35可通过NF-κB信号途径抑制巨噬细胞炎性因子的分泌[14],还可通过抑制内皮细胞NF-κB信号通路上游调节分子线粒体活性氧的产生,减轻脂质溶血磷脂酰胆碱诱导的内皮细胞活化[15]。
综上所述,深静脉血栓患者外周静脉血IL-35浓度显著下降,sCD40L、VCAM-1、ICAM-1、P-选择素和vWF浓度显著升高,体外实验表明IL-35对sCD40L刺激后血管内皮细胞的黏附功能具有抑制作用,其机制可能是通过NF-κB信号通路。本次实验为体外研究,但其在体内的作用机制仍需要进一步研究。

