Herkinorin预处理减轻缺血性卒中模型大鼠脑损伤
宋婉晴,李俊发,崔 旭*
1.首都医科大学附属北京同仁医院 麻醉科,北京 100730;2.首都医科大学 神经生物学系,北京 100069
脑缺血/低氧损伤是缺血性卒中常见的病理生理过程,发病率、致死致残率高, 目前临床上仍缺乏有效的治疗方法[1]。缺血/低氧预处理(ischemic-hypoxia preconditioning,I/HPC)是指在短时间内给予机体亚致死性缺血/低氧刺激后,可显著提高机体对继发严重缺血/低氧事件耐受性的方法。
I/HPC可以用药物预处理促进内源性物质释放或作用于信号通路来模拟。Herkinorin作为半合成阿片受体激动剂,可通过调节短暂性大脑中动脉阻塞(transient middle cerebral artery occlusion,tMCAO)致缺血性卒中小鼠脑皮层半影区内蛋白激酶C(protein kinase C,PKC)膜转位水平,来发挥脑保护作用[2-3]。早期研究显示,Herkinorin通过抑制NF-κB/NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)通路,减轻氧-糖剥夺(oxygen-glucose deprivation,OGD)神经元缺血损伤[4]。本研究拟在大鼠tMCAO模型上,进一步探讨Herkinorin对NLRP3的调节作用及其可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级SD大鼠,体质量 200~220 g,雌雄各半 [南京大学动物模式中心提供,动物合格证号:SCXK(苏)2015-0001]。
1.1.2 实验试剂:Herkinorin、TTC染液(Sigma-Aldrich公司);蛋白抽提试剂盒(Sangon公司);PVDF膜(0.45 μm,Millipore公司);TUNEL染色试剂盒、细胞凋亡试剂盒(南京凯基生物科技发展有限公司);GAPDH抗体、IL-1β抗体、NLRP3抗体、p-p65抗体和p65抗体(Abcam公司);β-抑制蛋白2(β-arrestin2)抗体、IκBα抗体、phos-IκBα抗体、Na-K ATPase抗体和caspase-1抗体(CST公司)。
1.2 方法
1.2.1 大鼠的分组及处理:采用随机数字表法,将大鼠分为假手术组(sham)、模型组(tMCAO)、Herkinorin组(Herkinorin),每组6只。模型(tMCAO)组及Herkinorin组大鼠进行造模处理-左侧大脑中动脉阻塞2 h后再灌注24 h。Herkinorin组大鼠造模前腹腔给药Herkinorin(10 mg/kg)1周,每天1次,缺血过程中给药1次,sham组及tMCAO组给予等体积1% DMSO。再灌注24 h后,对所有大鼠进行神经功能评分、TTC染色、TUNEL染色、Western blot检测和免疫共沉淀(co-immunoprecipitation,Co-IP)。
1.2.2 神经功能评分:评分标准:0分-神经功能正常;1分-轻度神经功能缺损:提尾时,动物的左前肢屈曲;2分-中度神经功能缺损:将动物置于光滑平面上行走,行走时向左侧转圈;3分-中度神经缺损:静止状态下,向左侧倾斜;4分-意识减退,肢体无自发活动;5分-对刺激无应答或死亡。
1.2.3 TTC染色检测脑梗死百分比及脑水肿率:取大鼠全脑视交叉及其前后各2 mm处的脑组织,置于含有2% TTC的磷酸缓冲溶液中,37 ℃避光温孵10 min后取出脑片,用数码相机拍照,通过Image pro-plus 6.0计算梗死百分比如下:梗死百分比(%)=苍白区质量/(苍白区质量+非苍白区质量)×100%。将染色后的脑组织置于105 ℃烘箱烘干,24 h后称重(干重)。脑水肿率计算公式如下:脑组织含水量(%)=(1-脑组织干重/脑组织湿重)×100%;脑水肿率(%)=[各组脑组织含水量(%)-sham组脑组织含水量(%)]/sham组脑组织含水量(%)×100%。
1.2.4 TUNEL染色检测细胞凋亡:取缺血半影区脑组织制成石蜡切片,置于电热恒温干燥箱中,60 ℃烘烤3 h,用TUNEL试剂盒检测细胞凋亡,按照说明书标记后用苏木精复染,用相差显微镜随机选择一个视野使用400×倍视野下拍照,细胞凋亡率(%)=TUNEL阳性细胞数/总细胞数×100%。
1.2.5 Western blot检测蛋白质表达: 取缺血半影区脑组织,制备全细胞蛋白质样品、定量、电泳和转膜后,分别加入一抗和二抗,用ECL发光显色。将PVDF膜放入数码凝胶图像分析仪进行曝光,所得图片采用Image J 件进行扫描。以GAPDH为内参蛋白,计算IκBα、p65、p-p65、pro-IL-1β、IL-1β、pro-caspase1、caspase1 p20、NLRP3的表达水平。
1.2.6 免疫共沉淀(co-immunoprecipitation,Co-IP)检测IκBα与β-arrestin2结合:取缺血半影区脑组织,Co-IP检测IκBα与β-arrestin2结合水平。
1.3 统计学分析
2 结果
2.1 Herkinorin预处理改善缺血性卒中鼠神经功能评分
与sham组相比, tMCAO组大鼠神经功能评分显著增加(P<0.01);而与tMCAO组相比,Herkinorin组大鼠神经功能评分明显下降(P<0.01)(图1D)。
2.2 Herkinorin预处理降低缺血性卒中鼠脑梗死百分比和脑水肿率
与sham组相比,tMCAO组大鼠脑梗死百分比与脑水肿率增加(P<0.01);与tMCAO组相比,Herkinorin组大鼠脑梗死百分比与脑水肿率下降(P<0.01)(图1A~C)。
2.3 Herkinorin预处理降低缺血性卒中鼠脑细胞凋亡水平
与sham组相比,tMCAO组大鼠脑组织缺血半影区中的细胞凋亡水平增加(P<0.01);与tMCAO组相比,Herkinorin组大鼠脑组织缺血半影区中的细胞凋亡水平下降(P<0.01)(图1E~F)。
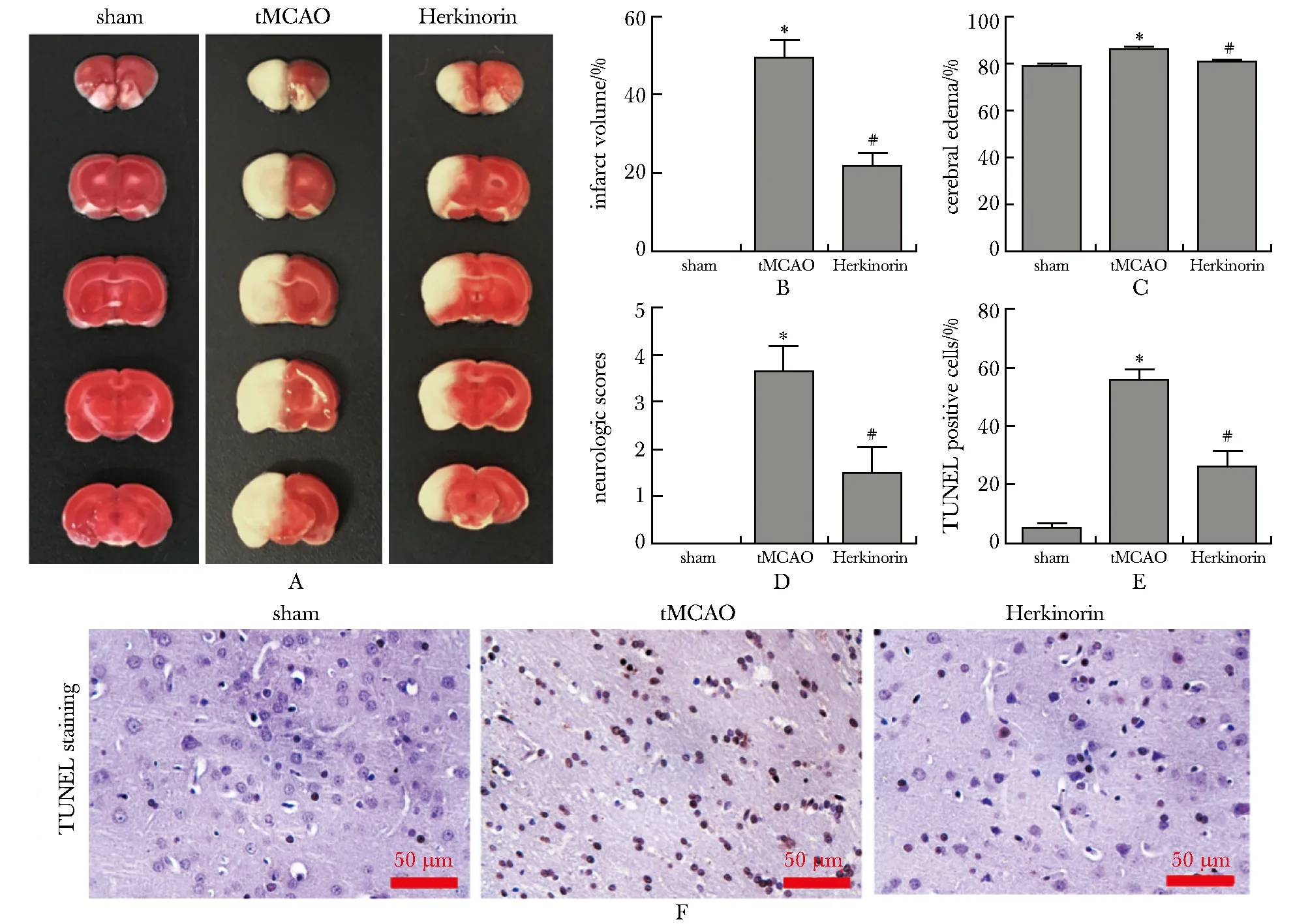
A.TTC staining; B.brain infarct area percentage; C.cerebral edema rate; D neurological scores; E, F.TUNEL staining; *P<0.05 compared with sham group;#P<0.05 compared with tMCAO group
2.4 Herkinorin预处理对缺血性卒中鼠脑半影区内IκBα、p65、p-p65、pro-IL-1β、IL-1β、pro-caspase1、caspase1 p20和NLRP3蛋白水平的影响
与sham组相比,tMCAO组大鼠脑组织缺血半影区内IκBα和p65蛋白水平下降(P<0.01,图2A~C);p-p65(图2A,D)、IL-1β(图2A,E~F)、caspase1 p20(图2A,G~H)和NLRP3(图2A,I)蛋白水平增加(P<0.01)。与tMCAO组相比,Herkinorin组大鼠脑组织缺血半影区内IκBα和p65蛋白水平增加(P<0.01,图2A~C);p-p65(图2A,D)、IL-1β(图2A,E~F)、caspase1 p20(图2A,G~H)和NLRP3(图2A,I)蛋白水平下降(P<0.01)。
2.5 Herkinorin预处理提高缺血性卒中鼠脑半影区内IκBα与β-arrestin2的结合水平
与sham组相比,tMCAO组大鼠脑缺血半影区内IκBα与β-arrestin2结合水平下降(P<0.01);但与tMCAO组相比,Herkinorin预处理可提高鼠脑缺血半影区内IκBα与β-arrestin2的结合水平(P<0.01)(图2J)。

A, B.expression of IκBα; A, C.expression of p65; A, D.expression of p-p65; A, E.expression of pro-IL-1β; A, F.expression of IL-1β; A, G.expression of pro-caspase1; A, H.expression of caspase1 p20; A, I.expression of NLRP3; J.interaction of IκBα and β-arrestin2
3 讨论
Herkinorin是以salvinorin A为模板合成的阿片受体激动剂,其与β-arrestins亲和力低,在激动阿片受体的同时较少募集β-arrestins,不导致受体内化,这一特性使Herkinorin既具备传统阿片类药物的治疗作用,又大大减少了药物耐受、便秘、呼吸抑制等不良反应[2]。
NLRP3异常活化关系到多种疾病的发生发展。NLRP3的激活与卒中后神经细胞死亡及行为缺陷密切相关,抑制NLRP3激活可减轻神经元缺血/再灌注损伤[5-7]。
NF-κB通常以p50-p65异二聚体的形式与其抑制性蛋白IκBα结合而呈非活化状态,其通过复杂的分子调节机制参与机体的慢性炎性反应[8]。研究显示, 杨梅花青素通过TLR4/NF-κB信号通路抑制NLRP3激活,从而减轻脑缺血/再灌注损伤[9];环境刺激通过抑制NF-κB信号通路降低NLRP1/NLRP3活性,从而减轻脑缺血/再灌注损伤[10]。
前期研究发现Herkinorin降低大鼠OGD神经元中caspase-1、IL-1β的活化程度及NLRP3的表达水平,而μ阿片受体(μ opioid receptor,MOR)抑制剂β-funaltrexamine可以逆转此作用。Herkinorin可明显抑制NF-κB通路的活化,降低p65的磷酸化水平,上调IκBα的表达,而MOR基因敲除后Herkinorin上述能力消失。这说明Herkinorin可能通过MOR途径降低OGD神经元中p65磷酸化水平,抑制NF-κB/NLRP3通路表达。而本研究在tMCAO大鼠中进一步验证了此作用机制。
阿片受体是G蛋白偶联受体(G protein-coupled receptors,GPCRs)。GPCRs激活后,细胞外信号通过两个信号通路传递到细胞内:G蛋白通路和β-arrestins通路。在G蛋白通路中, GPCRs活化后募集β-arrestins,β-arrestins促进GPCRs和G蛋白解偶联及受体内化,阻止下游效应因子激活,介导受体脱敏;在β-arrestins通路中,β-arrestins与Src、Raf-I、Akt、ERKl/2、JNK3、Mdm2和IκBα等信号分子形成复合物,调控MAPK、P53、NF-κB信号通路[11-12]。前期研究发现,Herkinorin处理大鼠OGD神经元后,IκBα与β-arrestin2结合量增加,IκBα泛素化水平降低。而β-arrestin2基因敲除后,Herkinorin抑制NF-κB通路活化,降低p65磷酸化水平,上调IκBα表达,降低 IκBα泛素化的能力消失。这说明Herkinorin抑制NF-κB通路活化可能是通过增加β-arrestin2与IκBα结合、降低IκBα泛素化实现的。本研究也发现, Herkinorin可增加IκBα与β-arrestin2的结合,稳定IκBα并抑制NF-κB激活,这表明IκBα与β-arrestin2在Herkinorin对tMCAO大鼠的神经保护机制中发挥了重要作用。
综上所述,Herkinorin可能通过抑制NF-κB/NLRP3通路减轻tMCAO大鼠脑缺血/再灌注损伤,这可能是通过增加IκBα与β-arrestin2结合实现的。

