大黄素介导铁死亡途径抑制MHCC-97H 人肝癌细胞的迁移和侵袭
张维一,张栋
(1 解放军总医院第七医学中心肝胆外科 北京 100700;2 北京中医药大学东方医院普通外科 北京 100078)
肝癌是一种发生在肝脏部位的恶性肿瘤,在全球癌症相关死亡中占很大比例,近几十年来肝癌的发病率和死亡率不断上升[1]。肝癌的治疗方法多种多样,包括免疫治疗、肝移植、手术切除、分子靶向治疗、经导管动脉化疗栓塞、放疗和化疗[2]。过去的几十年见证了肝癌从基础研究到临床转化的进展,然而,由于手术切除率低,复发率高,进展迅速,预后仍然很差[3]。鉴于此,研究新的肝癌治疗策略势在必行。近年来大量的基础和临床研究报道中药在预防和治疗肝癌中具有显著的疗效[4],目前发现中药在防治肝癌上具有抑制细胞增殖和迁移侵袭、抗血管生成、诱导细胞凋亡及调节免疫功能等作用[5]。大黄素是一种天然的蒽醌衍生物,存在于多个知名的中草药中(如虎杖、大黄等),其被认为是一种蛋白质酪氨酸激酶抑制剂和抗癌药物,对包括肝癌在内的多种肿瘤细胞均有活性[6]。有研究表明大黄素可通过靶向调控相关基因抑制肝癌细胞增殖,但大黄素调节肝癌细胞恶性生物学行为的机制仍不十分明确,在本研究中将通过体外培养肝癌细胞探讨大黄素对肝癌细胞生物学行为的影响及其作用机制。
材料和方法
1 细胞与主要试剂、仪器
人肝癌细胞MHCC‐97H 购自美国ATCC 公司(平台编号:Bio‐106194);大黄素(上海源叶生物科技有限公司,货号:B20240‐20mg);DMEM 培养基(上海户实医药科技有限公司,货号:12800‐017);顺铂(上海西格玛奥德里奇贸易有限公司,货号:479306);CCK‐8 试剂盒(上海爱必信生物科技有限,货号:abs50003);结晶紫(四川省维克奇生物科技有限公司,货号:wkq‐07202);多聚甲醛溶液(湖北科沃德化工有限公司,货号:kns201639700029);ANNEXIN V‐FITC/PI 凋亡检测试剂盒(北京索莱宝科技有限公司,货号:CA1020);康宁Matrigel 基质胶(北京智杰方远科技有限公司;货号:354230);Transwell 小室(北京杰辉博高生物技术有限公司);兔抗谷胱甘肽过氧化物酶(glutathione peroxidase 4,GPX4)(ATCC 公司,货号:ab125066)、兔抗酰基辅酶A合成酶长链家族成员4(acyl‐CoA synthetase long chain family member 4,ACSL4)(ATCC 公司,货号:ab155282)单克隆抗体;兔抗FTH1 多克隆抗体(北京索莱宝科技有限公司,货号:K108517P);辣根过氧化物酶标记的羊抗兔IgG 二抗(上海创赛科技有限公司,货号:C86‐ SSA004);铁离子检测试剂盒(深圳子科生物科技有限公司,货号:8448);增强化学发光试剂(ECL Enhanced chemi‐luminescence, ECL)(上海泽叶生物科技有限公司,货号:ZY6SL1350);谷胱甘肽(glutathione,GSH)试剂盒(上海碧云天,编号:S0053)。显微镜(型号:M205 FA & M205 FCA;德国徕卡);酶标仪(型号:CLARIOstar Plus,德国BMG 公司);预制凝胶蛋白电泳系统(型号:Bolt TM Bis‐Tris Plus,美国赛默飞世尔)。
2 细胞培养
MHCC‐97H 细胞培养在含有10%胎牛血清和1%双抗的DMEM 培养基中,并置于恒温培养箱中培养,培养箱参数为温度:37 ℃,二氧化碳:5%,相对湿度:95%,湿度:70%~80%。待细胞密度达到80%~90%时进行消化传代。
3 细胞分组与药物处理
取对数期生长的细胞,使用不同浓度(0、0.25、0.50、1.00、2.00、4.00、8.00、16.00、32.00、64.00 μmo/L)的大黄素处理细胞24 h 后采用CCK‐8 法检测细胞存活率,计算IC50 值,筛选大黄素低、高剂量浓度。并将细胞随机分为Blank 组、Dose 1 组、Dose 2 组和Positive 组,其中Dose 1 组、Dose 2 组细胞分别使用8 μmo/L、16 μmo/L 的大黄素处理细胞24 h,Positive 组细胞使用60 μg/mL 的顺铂[8]处理细胞24 h。
4 CCK-8 法检测细胞存活率
取96 孔板,将MHCC‐97H 细胞接种于96 孔板中(密度为5×104个/孔),置于培养箱中培养贴壁至80%~90%时,弃培养液,然后加入不同浓度(0、0.25、0.50、1.00、2.00、4.00、8.00、16.00、32.00、64.00 μmo/L)的大黄素,并设空白对照组,继续处理细胞24 h 后弃培养基,然后使用PBS 清洗3 次,每孔加入CCK‐8 试剂10 μL,继续培养2 h后使用酶标仪检测450 nm处吸光值并计算细胞存活率。细胞存活率(%)=(给药组吸光值‐空白组吸光值)/(对照组吸光值‐空白组吸光值)×100%。
5 平板克隆检测细胞集落形成
收集MHCC‐97H 细胞接种于96 孔板中(5×104个/孔),培养箱培养贴壁至80%~90%时,按照上述细胞分组(Blank 组、Dose 1 组、Dose 2 组和Positive 组)处理细胞,培养24 h 后,使用0.25%的胰酶进行消化,之后将细胞悬浮在培养基中(10%胎牛血清)备用,将细胞接种在6 孔板中(1×104个/孔),培养箱继续培养细胞至肉眼可见克隆细胞团(每隔1 d 更换一次培养液)后终止培养弃培养液,然后使用PBS 清洗3 次细胞后每孔加入1 mL 多聚甲醛固定细胞15 min,PBS 清洗后每孔加入结晶紫(10 g/L,1 mL)进行染色15 min,然后弃染色液并使用PBS 清洗后计数和拍照。克隆形成率(%)=(克隆细胞团数目/接种细胞数目)×100%。
6 Western blot 法检测各组细胞蛋白表达水平
收集MHCC‐97H细胞分组药物处理后加入细胞裂解液裂解细胞提取总蛋白,然后使用BCA 法检测提取的蛋白浓度,然后取适量蛋白样品进行SDS‐PAGE 凝胶电泳,电泳结束后裁剪凝胶并转膜(PVDF膜),然后使用5%的脱脂奶粉进行封闭(摇床,2 h),封闭结束后使用TBST 洗膜3 次后加入稀释的GPX4、ACSL4、FTH1 一抗,并4 ℃孵育过夜,次日回收一抗,TBST 清洗3 次后加入羊抗兔IgG 二抗,在室温下孵育2h,然后洗膜后滴加ECL 显影和拍照,并使用Image J 软件分析灰度值。
7 流式细胞术检测细胞凋亡情况
将MHCC‐97H 细胞接种于6 孔板中(1×106个/孔),按照上述分组使用大黄素处理细胞24 h 后消化并制备细胞悬液,细胞悬液置于离心管中离心(800 r/min,3 min)后弃上清,PBS 试剂清洗后,加入1 mL 的1×Binding buffer 重悬细胞,然后根据试剂盒每管加入100 μL 的细胞核5 μL 的Annexin V‐FITC试剂在室温下避光结合10 min 后加入5 μL 的PI 试剂,在室温下避光结合5 min 后加入PBS 混匀后立即使用流式细胞仪进行检测。
8 Transwell 法检测各组细胞迁移和侵袭能力
收集MHCC‐97H 细胞按照上述分组(Blank 组、Dose 1 组、Dose 2 组和Positive 组)处理细胞24 h。制备基质胶Transwell 小室:将Matrigel 基质胶放入‐4 ℃条件下过夜将基质胶从固体变为液体,将基质胶与DMEM 培养基按照5:1 比例混合混匀,然后取100 μL 混合液加入小室中,37 ℃下孵育60 min 凝固后备用。制备细胞悬液调整细胞密度为5×104个/mL,在Transwell 小室的上室加入细胞悬液(200 μL),下室加入含有胎牛血清的培养基,然后置于培养箱中继续培养48 h 后弃培养液,使用多聚甲醛固定细胞15 min 后PBS 清洗3 次,然后使用结晶紫染色10 min后使用流水去除多余的染色液,晾干后显微镜观察侵袭细胞数并计数。迁移实验不加Matrigel 基质胶,其余步骤与侵袭实验相同。
9 铁离子水平检测
收集细胞接种于6孔板中,根据上述分组(Blank组、Dose 1 组、Dose 2 组和Positive 组)药物处理细胞后弃培养基并使用PBS 清洗,离心后使用100μLPBS重悬细胞,根据试剂盒操作说明检测总铁离子水平。Fe2+检测步骤:每孔加入5 μL 缓冲液(37 ℃)后结合30 min,然后加入铁离子探针100 μL,避光结合1 h(37 ℃)后使用酶标仪检测593 nm 处吸光值。Fe3+检测步骤:每孔加入铁还原剂(5 μL)结合30 min(37 ℃)后加入铁离子探针(100 μL),避光结合1 h(37 ℃)后使用酶标仪检测593 nm 处吸光值。根据标准曲线计算总铁含量(Fe2+浓度+Fe3+浓度)。
10 GSH 水平的检测
取MHCC‐97H 分组药物处理后收集细胞,PBS清洗后离心(1000 r/min,3 min)去上清,加入蛋白去除剂溶液,对细胞进行两次快速冻融后离心(10000 r/min,10 min)取上清使用GSH 试剂盒检测其水平。
11 统计学分析
使用SPSS26.0 软件进行统计学分析,数据均采用平均值±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析,采用Graphpad 8.0软件进行作图,P<0.05 为差异有统计学意义。
结 果
1 大黄素抑制MHCC-97H 细胞存活率
使用不同浓度的大黄素处理细胞24 h 后,采用CCK‐8 法检测细胞存活率,结果如图1 所示,与0 μmo/L 大黄素比较,1.00、2.00、4.00、8.00、16.00、32.00、64.00 μmo/L 大黄素处理细胞后,细胞存活率均显著降低,大黄素作用24 h 时,对于MHCC‐97H细胞的IC50 为15.67 μmo/L,我们选取约1/2 的IC50浓度8 μmo/L 作为大黄素低剂量组干预浓度,选取16 μmo/L 作为大黄素高剂量组干预浓度。

图1 CCK‐8 实验检测大黄素对MHCC‐97H 细胞存活率的影响。与0 μmo/L 组比较,*P<0.05;n=5Fig. 1 The effect of emodin on the survival rate of MHCC‐97H cells was detected by CCK‐8 assay. *P<0.05, compared with 0μmo/L group; n=5
2 大黄素抑制MHCC-97H 细胞集落形成
平板克隆结果显示,与Blank 组比较,Dose‐1、Dose‐2、Positive 组细胞克隆形成率均显著降低;与Dose‐1 组比较,Dose‐2 组细胞克隆形成率进一步显著降低(图2)。由此提示,大黄素可抑制MHCC‐97H细胞集落形成能力。
3 大黄素诱导MHCC-97H 细胞凋亡
流式细胞术结果显示与Blank 组比较,Dose‐1、Dose‐2、Positive组细胞凋亡率均显著增加,与Dose‐1组比较,Dose‐2 组细胞凋亡率进一步显著增加(图3),提示大黄素可随剂量的增加增强诱导细胞凋亡的能力。
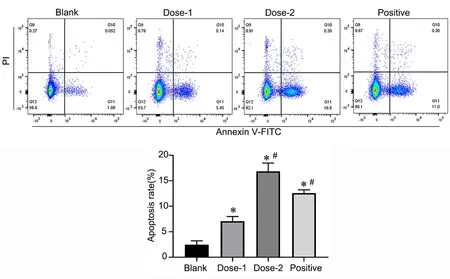
图3 流式细胞术检测大黄素对MHCC‐97H 细胞凋亡的影响。与Blank 组比较,*P<0.05;与Dose1 组比较,#P<0.05;n=5Fig. 3 The effect of emodin on apoptosis of MHCC‐97H cells was detected by flow cytometry. *P<0.05, compared with Blank group; #P<0.05, com‐pared with Dose1 group; n=5
4 大黄素抑制MHCC-97H 细胞迁移和侵袭
Transwell 法检测细胞迁移和侵袭能力显示:与Blank 组比较,Dose‐1、Dose‐2、Positive 组细胞迁移数和侵袭数均显著减少;且与Dose‐1 组比较,Dose‐2组细胞迁移数和侵袭数均进一步显著减少(图4)。结果提示大黄素可明显降低MHCC‐97H细胞的迁移和侵袭能力。
5 大黄素诱导铁死亡途径促进MHCC-97H 细胞凋亡
Western blot结果显示,与Blank组比较,Dose‐1、Dose‐2、Positive 组细胞中GPX4 蛋白表达水平明显降低,ACSL4、FTH1 表达水平明显提高;且与Dose‐1 组比较,Dose‐2 组细胞GPX4 蛋白表达水平进一步降低,ACSL4、FTH1表达水平进一步提高(图3A);与Blank 组比较,Dose‐1、Dose‐2、Positive组细胞铁离子含量明显增加,GSH 含量显著降低,且与Dose‐1 组比较,Dose‐2 组细胞铁离子含量进一步增加,GSH 含量进一步降低(图3B、C)。
讨 论
大黄素对多种恶性肿瘤均具有抑制作用,研究表明大黄素可通过抑制细胞增殖及调控相关因子影响细胞迁移、侵袭和凋亡[9]。多个研究已经表明大黄素可抑制肝癌细胞增殖诱导其凋亡发挥抗癌作用,如Qin 等[10]研究表明大黄素可通过调节自噬和上皮间质转化之间的串扰抑制肝癌细胞转移,并诱导细胞凋亡;Yin 等[11]也在研究中发现大黄素可通过调控巨噬细胞极化抑制肝癌生长发挥其抗肿瘤作用。但大黄素抗肝癌的潜在作用机制并不单一,仍需大量实验进一步进行探究。在本研究中发现大黄素处理细胞后,肝癌细胞克隆形成率显著降低,且高剂量的大黄素对细胞克隆形成率的抑制作用优于低剂量组,同时流式细胞术结果显示MHCC‐97H 细胞凋亡率随着大黄素剂量的增加不断增加,这提示大黄素可通过抑制细胞增殖,诱导凋亡发挥抗肝癌作用。此外Transwell 小室实验显示,大黄素处理后,MH‐CC‐97H 细胞的迁移和侵袭细胞数均显著降低,且高剂量大黄素组的细胞迁移和侵袭数明显低于低剂量组,这提示大黄素可呈剂量依赖性抑制MHCC‐97H细胞迁移和侵袭能力发挥抗癌作用。谭章斌等[12]也在研究中表明大黄素可介导相关信号通路抑制肝癌细胞增殖和侵袭,我们的结果与之一致。
铁死亡是一种铁依赖性的调节细胞死亡形式,由脂质过氧化的超量积累驱动,其特点是细胞内脂质过氧化物酶(GPX4)的减少及铁离子和脂质活性氧的堆积[10,11]。近年来,诱导铁死亡已成为引发癌细胞死亡的一种有前景的治疗选择,特别是对于对传统治疗方法有耐药性的恶性肿瘤[15]。除了铁死亡诱导因子外,许多基因也被鉴定为铁死亡的调节因子或标记物。ACSL4 由于可参与合成某些容易被氧化的膜磷脂,被认为是诱发铁死亡的必要成员之一,此外细胞内储存铁的蛋白FTH1 常被核受体共激活因子4 裂解后释放铁离子[16]。在本研究中发现,大黄素处理后,MHCC‐97H 细胞中GPX4 蛋白水平随着大黄素剂量的增加不断降低,ACSL4、FTH1 蛋白水平逐渐升高,且大黄素可明显提高肝癌细胞中铁离子的含量并降低GSH 水平,这些结果提示大黄素可能通过调节铁死亡途径诱导肝癌细胞凋亡进而发挥其抗肝癌的作用。
综上,大黄素可通过抑制细胞增殖、迁移和侵袭,诱导凋亡发挥其抗肝癌功效,这可能与诱导细胞铁死亡有关。本研究首次证实大黄素可能通过介导铁死亡途径诱导肝癌细胞凋亡,但仍需大量的实验进行进一步的验证。

