利用CRISPR/Cas9 技术靶向编辑青花菜BoZDS
黄文莉 李香香 周炆婷罗莎姚维嘉马杰,2 张芬 沈钰森顾宏辉王建升孙勃
(1.四川农业大学园艺学院,成都 611130;2.毕节市农业科学研究所,毕节 551700;3.浙江省农业科学院蔬菜研究所,杭州 310021)
青花菜(Brassica oleraceavar.italica),又名西兰花、绿菜花等,原产于意大利,属十字花科芸薹属甘蓝种变种,为一二年生蔬菜作物,主要食用部位为球状的花蕾和脆嫩的花茎。青花菜富含类胡萝卜素、维生素及芥子油苷[1-2],具有较高的营养价值和保健作用,深受消费者喜爱[3]。
ζ-胡萝卜素脱氢酶(ζ-carotene desaturase, ZDS)是类胡萝卜素合成的限速酶,其催化ζ-胡萝卜素生成番茄红素[4]。两分子牻牛儿牻牛儿基焦磷酸(geranylgeranyl pyrophosphate, GGPP),经过八氢番茄红素合成酶(phytoene synthase, PSY)、八氢番茄红素脱氢酶(phytoene desaturases, PDS)、ζ-胡萝卜素异构酶(15-cis-ζ-carotene isomerase, ZISO)、ζ-胡萝卜素脱氢酶(ζ-carotene desaturase, ZDS)的催化作用形成顺式番茄红素,顺式番茄红素在类胡萝卜素异构酶(ZISO、carotenoid isomerase, CRTISO)的催化下形成红色的反式番茄红素[5]。ZDS基因的功能在园艺作物中已有很多研究,西瓜果肉中ZDS基因的表达量与番茄红素含量呈正相关[6],在桃果肉中,ZDS基因正向调控类胡萝卜素生物合成及果皮呈色[7],在番茄中,当ZDS受到抑制,成熟果实的特征性红色类胡萝卜素的积累在整个成熟过程中受到抑制[8]。ZDS基因在拟南芥和芹菜中的过量表达可以导致叶黄素和β-胡萝卜素的积累增加,并上调类胡萝卜素生物合成相关基因的表达水平[9],当芥蓝BoaZDS在产生β-胡萝卜素的大肠杆菌中表达时,可增加大肠杆菌中β-胡萝卜素的积累[10]。当ZDS基因功能缺失,突变体会出现光漂白现象。在拟南芥中,ZDS突变体由于叶绿素和类胡萝卜素的严重缺乏而呈现白化幼苗表型[11],在同为芸薹属蔬菜的芥蓝中,ZDS突变体表现出明显的白化表型[12]。因此,本试验选择ZDS基因作为目标基因对青花菜进行基因编辑,突变体的表型可作为基因编辑成功与否的依据。
CRISPR/Cas9 系统是一种RNA 引导的DNA 内切酶系统,由Cas9 核酸酶和可定制的单导向RNA(sgRNA)组成。sgRNA 将Cas9 核酸内切酶导向互补的靶DNA[13]。该系统大大简化了基因编辑过程,拓宽了目标位点的选择范围。目前,作为改善植物性状和基因功能研究的有力工具,CRISPR/Cas9 基因编辑系统在拟南芥[14-15]、水稻[16]、烟草[17]、马铃薯[18]等多种植物中已有广泛地研究,在番茄[19-20]和黄瓜[21-22]等蔬菜作物中也有较多报道。近几年,甘蓝[23]、结球甘蓝[24]、芥蓝[12]等芸薹属蔬菜已陆续建立CRISPR/Cas9 基因编辑系统,而在青花菜中仅有原生质体瞬时体系的报道[25]。由于青花菜的再生体系转化效率和基因编辑载体效率较低,较难实现CRISPR/Cas9 基因编辑[26]。为了加快青花菜基因功能研究和靶向材料创制,建立青花菜高效的CRISPR/Cas9 基因编辑体系显得尤为重要。
1 材料与方法
1.1 材料
试验于2021年8月至2022年5月在四川农业大学园艺学院园艺综合实验室进行,供试材料为青花菜多代自交系‘ZN09’,由浙江省农业科学院蔬菜研究所花菜课题组提供。
1.2 方法
1.2.1 sgRNA 的 设 计 与CRISPR/Cas9 载 体 的 构建 利用CRISPR-P 在线软件(http://crispr.hzau.edu.cn)在青花菜BoZDS基因序列中寻找目标靶位点,通过软件评分和blast 搜索确定靶位点。将退火后的靶位点引物与AtU6-26-sgRNA-SK 质粒连接,得到sgRNA cassette 质粒,然后将酶切后pCAMBIA1300-pYAO : Cas9 质粒与sgRNA cassette 进行连接反应,连接产物转化大肠杆菌,挑取鉴定正确的单克隆扩大培养,提取质粒,相关引物序列见表1。
1.2.2 农杆菌介导的青花菜遗传转化 青花菜遗传转化方法参照课题组已有的方法[12],消毒后的种子在1/2MS 播种培养基中暗培养2 d,然后光下培养3-4 d,切取子叶预培养2 d 后,于农杆菌(GV3101)菌液浸染1-2 min,转入共培养基中生长2-3 d,然后转入延迟筛选培养基,7 d 后再转入抗性筛选培养基。每15 d 继代1 次,培养基同抗性筛选培养基。对不定芽进行拍照取样与分析鉴定。
1.2.3 转基因植株的分子检测与表型鉴定 采用CTAB 法提取抗性植株的基因组DNA,以其为模板,根据载体中所含潮霉素和Cas9 蛋白序列分别设计特异性引物Hyg-F/R 和Cas9-F/R(表1)进行PCR 扩增,电泳检测CRISPR/Cas9 载体是否成功转入青花菜植株中,计算转化效率。在靶位点前后设计特异性引物,以每个抗性植株的基因组DNA 为模板,使用引物BoZDS-CRISPR test-F/R(表1)进行PCR 扩增,切胶回收扩增片段,进行连接转化,挑单克隆进行菌液PCR 鉴定及测序,再使用SnapGene 和DNAMAN软件进行序列比对分析,根据突变情况计算突变率。对每个突变体的表型进行观察和拍照,统计白化株的数量,测定色差值。

表1 本研究中所用的引物Table 1 Primers used in this study
2 结果
2.1 sgRNA设计和CRISPR/Cas9载体构建
根据软件分析结果,在BoZDS基因的第1 个外显子上选取了两个靶位点,靶位点序列分别为CCAGCTACTGCGTTCCTCTCCTC 和CCTCGGAGGTTTCATGTTAGGTC(表2),根据靶位点位置顺序分别命名为1 号和2 号靶位点,下划线为前间区序列邻近基序(protospacer adjacent motif,PAM)序列(图1),之后经过引物退火、酶切和T4 酶连接成功构建了1 号和2 号靶位点的重组载体。

表2 靶位点GC 含量和得分情况Table 2 GC content and scores of target sites

图1 靶位点选择(A)与载体构建(B)Fig. 1 Selection of target sites(A)and construction of vectors(B)
2.2 青花菜稳定遗传转化效率统计
开展青花菜稳定遗传转化(图2),每个靶位点接种转化无菌苗的外植体约2 500 个,1 号靶位点获得20 株抗性芽,转化效率为0.80%,2 号靶位点获得21 株抗性芽,转化效率为0.84%。潮霉素和Cas9检测结果表明,除1 号靶位点株系8,2 号靶位点株系25 和34 外,其余抗性株检测结果均呈阳性,即1 号靶位点转基因阳性率为95%,2 号靶位点转基因阳性率为90.48%(图3)。

图2 青花菜稳定遗传转化的过程Fig. 2 Process of stable genetic transformation of broccoli
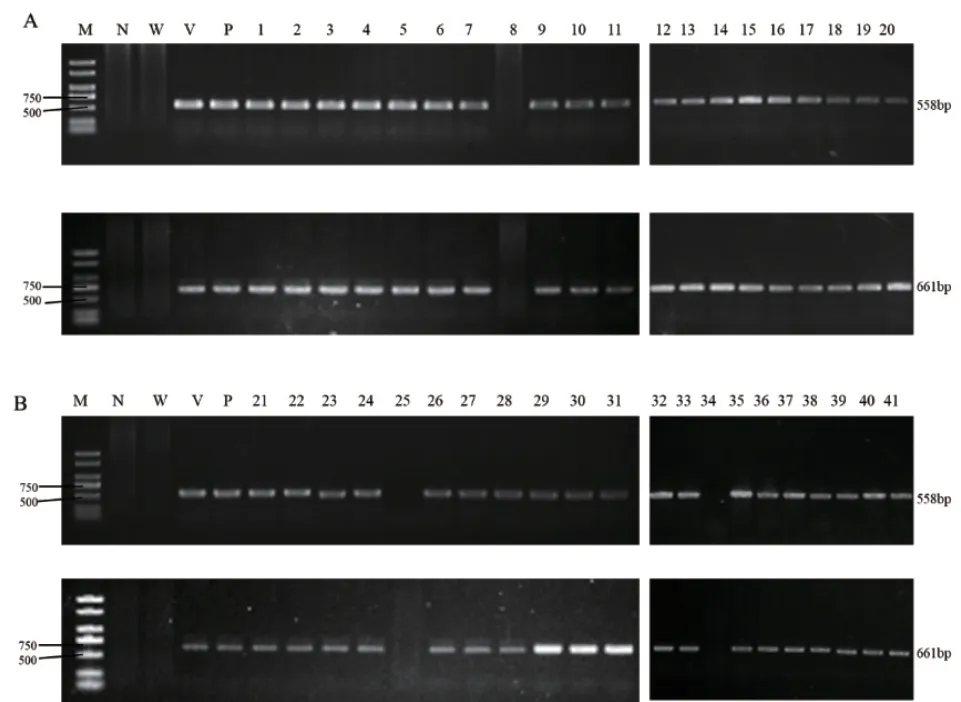
图3 潮霉素抗性基因和Cas9 基因检测Fig. 3 Detection of the hygromycin-resistant gene and Cas9 gene
2.3 CRISPR/Cas9介导的BoZDS基因突变情况分析
测序结果表明,1 号靶位点共有3 个转基因植株发生突变,其中株系1-1 和1-19 突变情况相同,均在靶位点前启动子区域出现了67 bp 的大片段缺失,其他区域有2 个单碱基的替换,突变克隆均占测定克隆数的1/5,而株系1-5 在靶位点前发生了7个碱基的缺失。2 号靶位点共有7 个转基因植株发生突变,其中株系2-1、2-2、2-19、2-23 在靶位点前启动子区域发生了67 bp 的大片段缺失,与1 号靶位点株系1-1 和1-19 的缺失位置相同,在其他位置上发生了3 个单碱基的替换;株系2-12 发生了1个或2 个单碱基的替换;株系2-16 在靶位点前2 个碱基处发生了单碱基的替换;株系2-7 有两种突变情况,其中一个在靶位点上发生了1 个碱基的插入,另一个在靶位点上有1 个碱基的插入和8 个碱基的缺失以及靶位点前7 个碱基的缺失(图4)。
2.4 不同靶位点的突变体数和突变率分析
两个靶位点的突变情况分析表明,1 号靶位点19 株阳性株中有3 株发生突变,突变率为15.79%;2 号靶位点19 株阳性株中有7 株发生突变,突变率为36.84%(图5)。1 号靶位点的3 株突变体均为杂合突变类型,2 号靶位点的突变体有纯合(2-19、2-23)、杂合(2-2、2-16)和嵌合(2-1、2-7、2-13)三种突变类型(图4,图5)。

图4 CRISPR/Cas9 介导的青花菜BoZDS 基因突变类型Fig. 4 Type of CRISPR/Cas9 system-mediated BoZDS mutation in broccoli
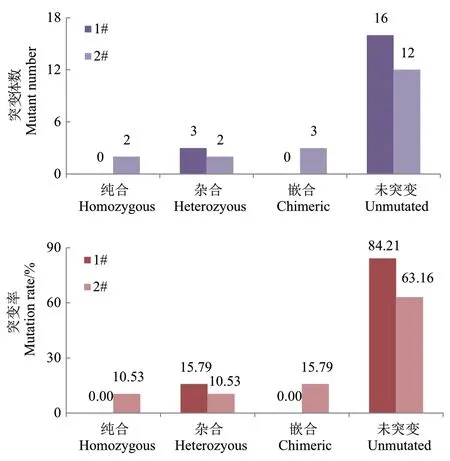
图5 不同靶位点的突变体数和突变率Fig. 5 Mutant number and mutation rate of different targets
2.5 BoZDS突变体表型分析
如图6 所示,与野生型和空载植株相比,2 个靶位点的突变体均发生了不同程度的白化或斑驳,其中株系1-1、1-19、2-1、2-12、2-16、2-19、2-23呈现完全白化的表型,株系1-5、2-2、2-7 呈现斑驳表型,表明突变体中BoZDS基因功能受到不同程度的影响。

图6 BoZDS 突变体及野生型(WT)和空载植株(EV)的表型Fig. 6 Phenotypes of BoZDS mutants, wild-type(WT),and transgenic plant with empty vector(EV)
2.6 BoZDS突变体和野生型植株的颜色参数分析
WT 和突变体的CILAB 颜色参数测定结果如表3 所示,突变体的亮度值L*显著高于野生型植株,约WT 的1.5-1.7 倍,红绿值a*也显著高于WT 植株,黄蓝值b*均有所下降。
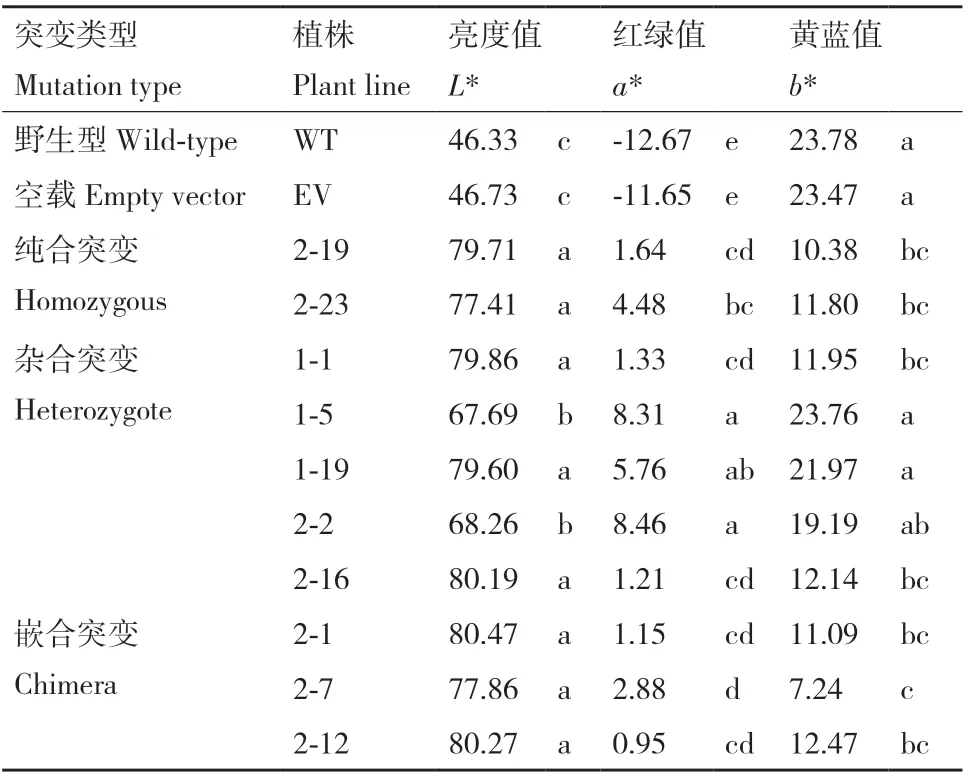
表3 BoZDS 突变体及野生型(WT)和空载植株(EV)的颜色参数Table 3 Color parameters of BoZDS mutants, wild-type(WT), and transgenic plant with empty vector(EV)
3 讨论
建立有效的再生体系是将基因转入植物的先决条件,在甘蓝中,再生和转化效率严重依赖基因型,同一物种中,外植体的选择也尤为重要[27]。本试验成功建立了青花菜稳定遗传转化体系,但转化效率较低,未来可通过调节培养基激素配比或者改变外植体种类来尝试提高转化效率。
CRISPR/Cas9 基因编辑技术在不同物种中的编辑效率存在差异,在水稻中基因编辑的突变率为21.1%-66.7%[28];在 烟 草 中NtPDS和NtPDR6的突变率分别为81.8%和87.5%[17];小麦中基因编 辑 的 突 变 率 为12.7% 和10.8%[29];在 芥 蓝 中BoaCRTISO和BoaZDS的突变率分别为81.25%和68.42%[12,30]。本试验青花菜ZDS基因1 号靶位点的突变率为15.79%,2 号靶位点的突变率为36.84%,编辑效率处于正常范围内,但仍有提高空间。
本试验中,2 号靶位点的软件预测得分明显高于1 号靶位点,突变结果表明,2 号靶位点的编辑效率是1 号靶位点的两倍多,且2 号靶位点株系2-7和2-16 在靶位点上发生突变,而1 号靶位点突变体均未在靶位点上发生突变,说明2 号靶位点的编辑效率明显高于1 号靶位点,与软件预测结果一致,表明选择靶位点时可将得分作为选择依据之一。进一步发现,1 号靶位点突变体均为杂合突变类型,2号靶位点株系2-19 和2-23 为纯合突变类型,这与前人报道的突变效率高的靶位点更容易发生纯合突变的结论一致[31]。本试验中,1 号和2 号靶位点的突变情况类似,可能是由于两个靶位点在位置上较近,仅相隔19 bp。先前的研究表明,sgRNA 的GC 含量可能会影响其与其靶位点的结合,并最终影响编辑效果,高GC 含量有利于增加编辑效率[32-33]。然而,本试验中1 号靶位点的GC 含量高于2 号靶位点,但编辑效率却明显低于2 号靶位点,表明靶位点的GC 含量并非是决定靶位点编辑效率的唯一因素。
研究表明,基因组非编码区的突变可以影响基因调控和表型[34],本试验中发现部分突变体在靶位点上游的启动子区域发生了大片段缺失或碱基替换,结合突变体明显的白化或斑驳表型说明启动子区域发生突变能够对基因功能造成实质性影响。未来,我们可以通过软件预测[33]并结合原生质体瞬时转化筛选编辑效果好的靶位点来进行稳定遗传转化,从而提高青花菜的基因编辑效率。
4 结论
通过CRISPR/Cas9 介导的基因编辑体系,成功编辑了青花菜BoZDS基因,使其基因功能受到影响,产生明显的白化或斑驳表型,并比较了两个靶位点的差异。综上,本试验成功建立了青花菜基因编辑体系,为之后开展青花菜基因功能研究和材料创制提供了技术支撑。