Notch信号通路对骨关节炎软骨细胞增殖和软骨基质合成的作用研究
林飞太 ,林煜 ,林钡,陈赛楠,翁艳 ,冯尔宥
1 厦门大学附属福州市第二医院关节外科,福州 350007;2 福建医科大学第三临床医学院,福州 350122;3福建中医药研究院,福州 350003
骨关节炎(osteoarthritis,OA)是当今中老年人慢性致残的主要原因之一,是由年龄和创伤等多因素引起的关节软骨及其整体结构渐进变性的退行性疾病,严重影响了我国中老年人的生活质量[1-2]。目前OA主要是通过非甾体抗炎药消炎镇痛和降低运动量等来缓解症状,但这些治疗方法仅能延缓疾病进展,而无法逆转软骨退变。因此,探索OA的病理生理过程对该病的精准治疗和靶向治疗具有重要意义。
Notch信号通路在生物进化过程中高度保守,可介导细胞间的相互作用[3]。Notch配体与受体结合后,促使Notch受体发生蛋白水解,释放细胞质中的Notch1受体胞内结构域(Notch1 IC或Notch1 ICD,NICD),Notch信号通路被激活。随后,NICD转移到细胞核,并诱导下游靶基因的表达[4]。Geogan等[5]提出Notch信号与关节软骨内稳态和OA的发病机制相关。RBPjκ基因敲除小鼠出现了进行性关节软骨退化和与年龄相关的OA样病理变化[6],而小鼠关节中Notch信号的暂时抑制,使OA进展延迟[7]。因此提示Notch信号与OA的发病和进展有关。相关研究发现,Notch信号通路与软骨细胞的生长关系密切[8],调控Notch信号通路可影响软骨细胞凋亡[9],软骨持续过表达NICD的小鼠可出现OA进行性病理变化[10],研究显示,与正常软骨细胞相比,OA小鼠软骨细胞Notch1和Jagged1等表达显著增强[11]。但笔者未见相关报道阐明Notch信号通路与OA软骨细胞增殖和软骨基质合成的相关性。本研究采用白介素-1β(interleukin-1β,IL-1β)诱导C28/I2软骨细胞系的NICD沉默和过表达,检测OA软骨细胞的活性和增殖细胞 核 抗 原(proliferating cell nuclear antigen,PCNA),并检测其对软骨基质Ⅱ型胶原蛋白(typeⅡ collagen,ColⅡ)和聚集蛋白聚糖(aggrecan,ACAN)合成的影响,以期探讨Notch信号通路在OA中的潜在分子机制。本研究采用体外细胞实验,于2021年1~12月在福建省中医药科学院研究所完成。现报道如下。
1 材料和方法
1.1 试剂与仪器
标准级胎牛血清(fetal bovine serum,FBS,赛业生物科技);DMEM/F-12、青霉素-链霉素、磷酸盐缓冲液(phosphate buffered solution,PBS)、0.25%胰蛋白酶-EDTA(美国Gibco公司);lipofectamine 2000、TRIzol(美国 Invitrogen 公司);IL-1 β(美国 Sigma 公司);Cell Counting Kit-8(Cck-8)试剂盒(MedChemExpress公司);Evo M-MLV RT Kit with gDNA Clean for qPCR II、SYBRGreen Premix Pro Taq HS qPCR Kit(艾科瑞生物);RIPA裂解液(强)、SDS-PAGE凝胶快速配制试剂盒、BCA蛋白浓度测定试剂盒、QuickBlockTMWestern封闭液(上海碧云天生物技术有限公司);蛋白酶抑制剂混合物(protease inhibitor cocktail,APExBIO 公司);SDS-PAGE蛋白上样缓冲液(SDS-PAGE loading buffer,康为世纪生物科技股份有限公司);PCNA( D3H8P)XPRabbit mAb(Cell Signaling Technology公司);Anti-Aggrecan抗体、Anti-Collagen Ⅱ抗体(Abcam公司);GAPDH Rabbit mAb(武汉爱博泰克生物科技有限公司);其他试剂均为分析纯。
DMI8倒置荧光显微镜(Leica公司);RT-6100酶标分析仪(Rayto公司);7500 Fast Realtime PCR(ABI公司);PowerPac通用电泳仪(BIORAD公司);FluorChem M多色荧光/化学发光成像(Protein Simple公司)。
1.2 细胞与质粒
C28/I2人正常软骨细胞系(ATCC细胞库);HBLV-h-NICD-3xflag-ZsGreen-PURQ、HBLV-ZsGreen-PURO过表达对照[汉恒生物科技(上海)有限公司];NICD siRNA质粒、siRNA control[生工生物工程(上海)股份有限公司]。
1.3 研究方法
1.3.1 软骨细胞培养
C28/I2细胞培养采用含10%胎牛血清FBS和1%青霉素-链霉素的DMEM/F-12培养基,置于37℃、5% CO2的培养箱中,待细胞融合达到80%~90%时用胰蛋白酶消化传代。
1.3.2 IL-1β诱导
细胞按1×104/ml密度接种于96孔板,置于含10ng/ml IL-1β的培养基中,C28/I2细胞分别培养24、48h和72h。CCK-8法检测OA软骨细胞抑制率,吸光度用A表示。细胞抑制率(%)=(AIL-1β诱导组-A空白组)/(A阴性对照组-A空白组)×100%,选取抑制率最低的细胞用于后续实验。同时,采用Western Blot法检测NICD、caspase3和caspase9的蛋白表达水平。
1.3.3 感染
选取NICD过表达组(Ad-NICD)对数生长期的诱导OA软骨细胞,按1×106/ml密度接种于六孔板中,培养12h达到60%~70%的融合度,加入不同滴度[病毒感染复数(multiplicity of infection,MOI)20、MOI40、MOI60、MOI80]的腺病毒培养48 h,根据绿色荧光的强弱确定其最佳MOI。采用最佳MOI的Ad-NICD感染C28I2细胞,平行设置空白对照组(NC)和阴性对照组(Ad-GFP),48h后检测NICD的表达水平。
1.3.4 NICD敲低组(si-NICD)的沉默效率
选取si-NICD组对数生长期的诱导OA软骨细胞,按1×106/ml密度接种于六孔板中,培养12h达到60%~70%的融合度。配制转染稀释液:50μl DMEM/F12培养基中加入4μl lipofectamine 2000,相溶后放置于室温孵育5min。同理,用50μl DMEM/F12培养基稀释50nmol siRNA,相溶后置于室温孵育5min;将稀释后的lipofectamine 2000与稀释后的siRNA轻轻混合,室温静置20min后缓缓加入细胞培养基中,轻轻摇晃孔板使其混匀;将六孔板置于37℃、5% CO2培养箱中培养6~8h后,将原有培养基更换为DMEM/F12完全培养基。设计并合成3个si-NICD,48h后检测NICD的表达水平,选取沉默效果最佳者用于后续实验。
1.3.5 CCK-8检测细胞活性
细胞分为5组:IL-1β诱导对照组、过表达阴性对照组(Ad-NC)、Ad-NICD、敲低阴性对照组(siRNA-NC,si-NC)和si-NICD。每组设置6个复孔,每孔接种1×104个细胞悬液。将96孔板置于培养箱中分别培养24、48h和72h后,各孔加入10μl CCK-8,继续培养4h,使用酶标仪测定A450nm,判定细胞活性。
1.3.6 Real-time PCR 试验
PBS冲洗细胞,TRIzol抽提总RNA,Nanodrop 2000测定A260/A280比值,总RNA采用Evo M-MLV RT Kit with gDNA Clean for qPCR II试剂盒反转录为cDNA,-20℃保存;引物序列GAPDH-F 5'-AGGTCGGTGTGAACGGATTTG-3',R5'-GGGGTCGTTGATGGCAACA-3';PCNA-F 5'-AAGGGCTGAAGATAATGCTGATA-3',R5'-CATATACGTGCAAATTCACCAGAT-3';ColⅡ -F5'-AAGGATGTGTGGAAGCCGGA-3',R5'-CTGAGGCAGTCTITCACGTCT-3';Aggrecan-F 5'-CTTCTGCAACTGAAGTGCCCTC-3',R5'-GCTCTTOCGAGGCTGATGGTT-3';使用7500 Fast Real-time PCR仪,95℃、15s共1个循环,95℃、5s和60℃、30s共40个循环,以GAPDH为内参,2-△△CT计算PCNA、ColⅡ和ACAN的mRNA表达水平。
1.3.7 Western Blot 试验
PBS冲洗细胞,加入RIPA裂解液300μl和蛋白酶抑制剂 Cocktail 3μl,细胞刮刀收集细胞置于EP管中,于冰上裂解30min, 12000r/min(4℃)离心20min;吸取上清液200 μ l加入5×loading buffer 50μl,98℃变性10min。BCA试剂盒测定浓度,每孔上样30 μ g总蛋白;SDS-PAGE凝胶电泳,恒压100V转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜;快速封闭液封闭15min,分别加入一抗4 ℃孵育过夜,Tris-HCl缓冲盐溶液+聚山梨酯-20(polysorbate-20)洗膜,加入对应的二抗1:1000室温孵育1h,TBST洗膜,增强化学发光法(ECL)化学发光显影。分析条带灰度值,以GAPDH为内参,计算PCNA、ColⅡ和Aggrecan的蛋白表达水平。
1.4 统计学方法
采用SPSS 25.0软件进行数据统计分析。实验数值以x±s表示,正态分布的多组间计量资料采用单因素方差分析,非正态分布的多组间计量资料采用非参数检验。P<0.05为具有统计学差异。
2 结果
2.1 IL-1β诱导C28/I2细胞凋亡的作用
与阴性对照组相比,IL-1β诱导后24、48h和72h C28/I2细胞活性均显著降低(P<0.001),72h时抑制率最低(表1),选用于后续实验。Western Blot结果显示,与阴性对照组相比,IL-1β诱导后NICD表达水平显著提高(P<0.001),且caspase3和caspase9的表达水平均显著提高(P<0.01)。见表2和图1。
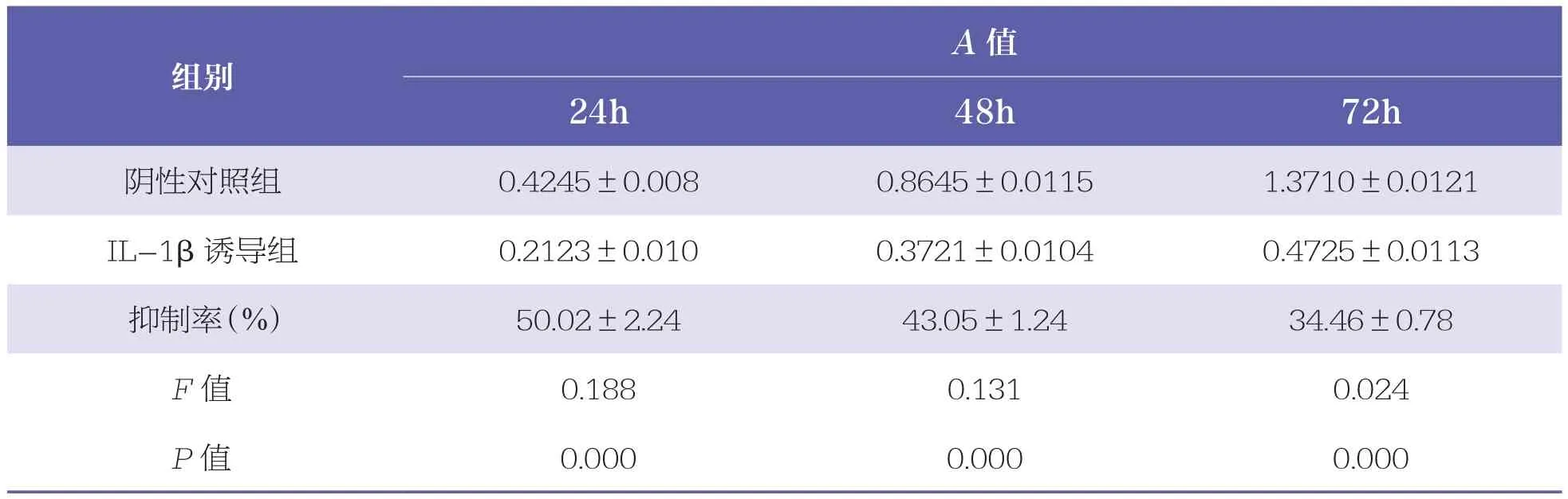
表1 IL-1β对C28/I2细胞的抑制率

表2 Western Blot检测IL-1β诱导软骨细胞的凋亡作用

图1 Western Blot检测IL-1β诱导软骨细胞的蛋白表达
2.2 Ad-NICD的过表达效率
Ad-NICD感染IL-1β诱导后的C28/I2细胞 48h,MOI20、MOI40、MOI60、MOI80的倒置荧光显微镜图见图2。结果显示,MOI为40时感染效果最佳。Real-time PCR和Western Blot法检测细胞NICD mRNA和蛋白表达水平,结果表明Ad-NC组与NC组比较无统计学差异(P>0.05);与Ad-NC组相比,Ad-NICD组感染后细胞NICD mRNA和蛋白表达水平显著增加(P<0.01)。见图3。
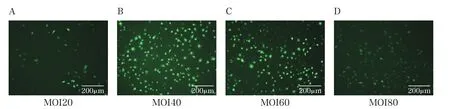
图2 Ad-NICD感染IL-1β诱导后的C28/I2细胞48h的MOI倒置荧光显微镜图
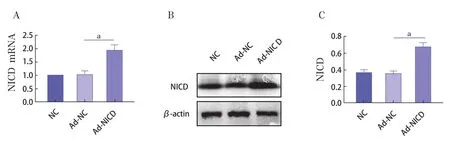
图3 Ad-NICD的过表达效率
2.3 si-NICD的沉默效率
si-NICD转染IL-1β诱导后的C28/I2细胞48h,与si-NC组相比,3个si-NICD组的mRNA和蛋白表达水平均明显下降(P<0.01),其中以si-NICD3组下降最为显著(图4)。因此,选择si-NICD3用于后续实验。
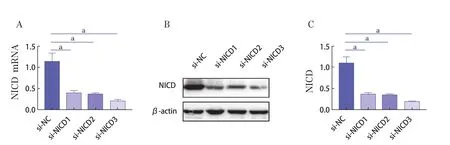
图4 si-NICD的沉默效率
2.4 CCK-8检测细胞活性
与IL-1β诱导对照组相比,Ad-NC组和si-NC 组的A值无统计学差异(P>0.05);24、48h和72h后Ad-NICD组的A值均显著降低(P<0.001),24h和48h后si-NICD组的A值升高,72h呈上升趋势但无统计学差异(表3)。提示Ad-NICD感染IL-1β诱导C28/I2可抑制其增殖,si-NICD3转染可促进细胞增殖。

表3 CCK-8检测细胞增殖
2.5 Real-time PCR法检测软骨细胞增殖和基质合成
与Ad-NC组相比,Ad-NICD组的PCNA、Col Ⅱ和ACAN mRNA表达水平呈现不同程度的降低(P<0.05);与si-NC相比,si-NICD的PCNA、Col Ⅱ和ACAN mRNA表达水平呈现不同程度的升高(P<0.05,表4)。提示Ad-NICD感染IL-1β诱导C28/I2可抑制其增殖和基质分泌,si-NICD3转染可促进细胞增殖和分泌。
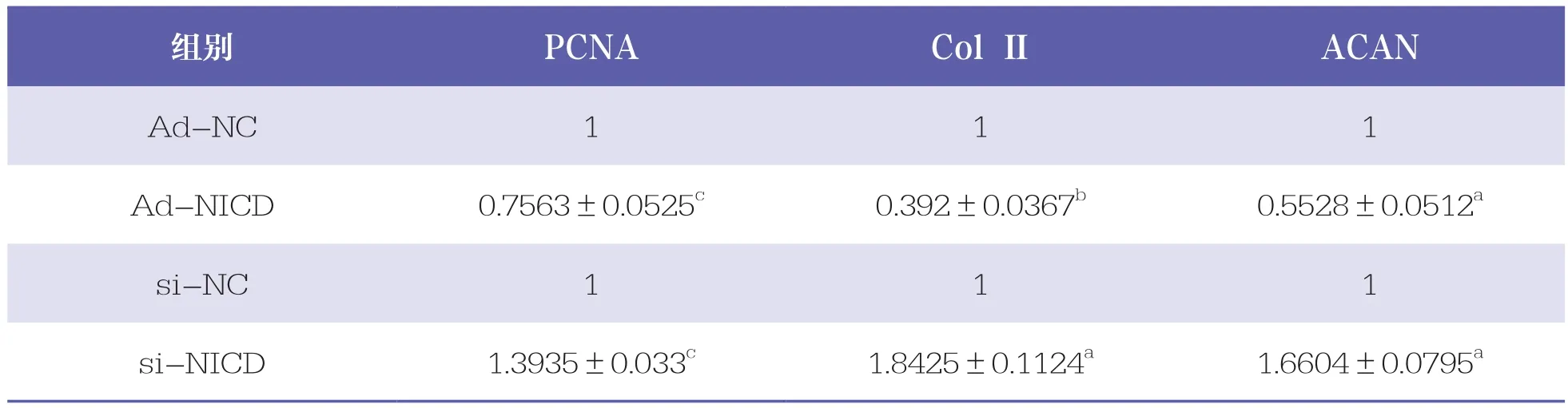
表4 Real-time PCR检测OA软骨细胞增殖和基质合成
2.6 Western Blot检测软骨细胞增殖和基质合成
Western Blot法与Real-time PCR法检测结果的变化趋势相符;与Ad-NC组相比,Ad-NICD组的PCNA、Col Ⅱ和ACAN蛋白表达水平呈现不同程度的降低(P<0.05);与si-NC组相比,si-NICD组的PCNA、Col Ⅱ和ACAN的蛋白表达水平呈现不同程度的升高(P<0.05)。见图5。提示Ad-NICD感染IL-1β诱导的C28/I2可抑制其增殖和基质分泌,si-NICD转染可促进细胞增殖和分泌。
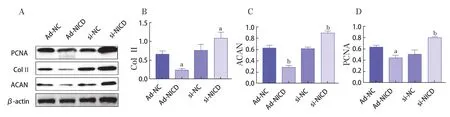
图5 Western Blot检测软骨细胞增殖和基质合成
3 讨论
OA是一种以异常软骨细胞表型、软骨退化、炎症和纤维化为特征的退行性关节疾病。相关动物研究表明[12],Notch 信号传导是软骨稳态和关节维持的关键调节剂之一。然而,人们对OA的病因知之甚少。
Notch信号传导是一种进化上非常保守的通路,通过邻近细胞间传导信号调节细胞各种生理过程,可决定细胞命运(细胞发育、分化、增殖、凋亡、黏附等),是维持体内平衡的关键环节。Notch由5个配体(Dll1、3、4和Jagged1、 2)组成,与 4 个 Notch 受体(Notch1~4)相互作用[13]。配体结合后,Notch受体被切割, Notch NICD易位至细胞核,并最终激活下游基因的表达,从而影响细胞增殖和分化[13-16]。这些基因可在OA活检中被大量检测到[17],尤其是在创伤后发生OA 时,人和小鼠关节组织的Notch通路被高度激活[18]。相关研究提示[7],在疾病早期阶段,OA增殖软骨细胞簇的Notch1、Jag1和Hes5水平高于正常软骨。Notch1和Notch2的NICD位于OA细胞核中,而非正常软骨细胞中,这表明在受疾病影响的关节中 Notch 信号通路被激活[19]。但在正常的软骨生长发育过程中,Notch 信号通常在早期软骨形成过程中高度表达,并随着软骨细胞的分化而降低。因此,Notch信号在成人关节软骨中表达,并且大部分存在于关节软骨中的软骨细胞表达Notch1[17,20]。Dong等[21]在 E11.5~12.0的整个肢芽间质中观察到高水平的Notch1,并在血管组织周围观察到Notch1。Watanabe等[22]证明了在分化鼠软骨细胞系(ATDC5细胞)中,随着软骨细胞的成熟,Notch受体和靶点的表达减弱并主要限制在软骨凝聚物的外围。基于此,本研究推断Notch信号通路在OA软骨细胞与正常软骨细胞中的机制可能不同,过表达NICD激活Notch通路可抑制OA软骨细胞增殖和软骨基质合成。与Watanabe 等[22]研究不同的是,本研究以PCNA、Col Ⅱ和ACAN作为细胞增殖指标,通过蛋白和基因水平检测Ad-NICD转染OA后的PCNA、Col Ⅱ和ACAN的表达水平,结果显示有不同程度的降低。本研究结果提示,过表达NICD激活Notch通路可以抑制OA软骨细胞增殖和软骨基质合成,这与Watanabe 等[22]的研究结果本质相同而途径不同。
关节软骨是一种致密结缔组织,其没有神经、血管及淋巴,在运动中发挥承重、缓冲和保护作用[23]。软骨细胞是软骨组织中的唯一细胞组分,其余均为细胞外基质,软骨细胞通过分泌生长因子和酶来调节细胞外基质 (extracellular matrix,ECM)的合成并进一步嵌入 ECM中形成软骨[24]。ECM的主要成份Ⅱ型胶原蛋白和ACAN是软骨细胞表型的经典标志物[25]。ECM网络负责吸收关节软骨的机械应力,促进软骨细胞黏附和调节细胞内信号转导。
软骨的退化源于软骨ECM的降解,其主要由Ⅱ型胶原蛋白和蛋白聚糖组成[26]。软骨形成的 ECM由蛋白酶降解,包括用于降解胶原蛋白的基质金属蛋白酶 (matrix metalloproteinase,MMP)[27],以及用于降解聚集蛋白聚糖的具有血小板反应蛋白基序的 Adamalysin (ADAMTS)[28]。相关研究发现,包括 MMP-1、MMP-9、MMP-13和MMP-14 在内的胶原酶对胶原蛋白的降解起着至关重要的作用[29]。MMP-13是 OA 中的主要胶原酶,其在 OA 软骨中表达增加[30]。ADAMTS4 和ADAMTS5被认为是最关键的2种基质降解酶[31]。相关证据表明[31],在OA小鼠模型和抗原诱导的关节炎模型中,敲除ADAMTS5导致不太严重的软骨损伤。Cheung等[32]的研究表明,ADAMTS4在人类OA中起着至关重要的作用。除了MMP和ADAMTS外,解联素和金属蛋白酶(metalloprotease,ADAM) 家族也参与介导OA的ECM 降解[33]。Zack等[34]指出,ADAM8是人类OA软骨细胞中的一种纤连蛋白酶,在氨基酸Ala处切割纤连蛋白。这种ADAM8介导的软骨中纤连蛋白的降解可能直接导致OA进展。Notch信号通路已被确立为小鼠[35-36]和人类[37-38]骨骼发育和疾病的关键途径。Dong等[21]和Kohn等[35]的研究确定了Notch信号通路是软骨发育的中央调节器,这表明其可能更多地参与关节软骨维护和OA等退行性疾病。虽然人OA软骨样本显示表达Notch1和其他Notch途径蛋白的细胞频率增加[5,19],但Notch在正常或病理状态下关节软骨中的功能仍不清楚。而本研究中,在分子水平上,持续的Notch信号传导抑制ColⅡ和ACNA表达,证明Notch信号对重要软骨分解代谢因子有特异性调节作用。
已有文献报道[7],Notch 信号有助于 OA 的发展。Notch受体Notch1和Notch2在OA软骨细胞中上调,这些Notch受体被切割形成Notch细NICD并易位至细胞核,因此Notch信号通过与Rbpj蛋白结合形成转录激活因子而被激活, 并诱导Hes/Hey家族蛋白发挥调节功能[39]。敲除小鼠中Rbpj基因可抑制OA进展。Notch信号通路阻滞剂可缓解OA的病理变化[40]。相关研究表明[41],Notch 信号的下游效应因子 Hes1在 OA软骨细胞中高度表达。Hes1由激活的Notch受体NICD诱导,并诱导MMP13的强表达,从而催化软骨形成的ECM的降解,导致软骨退化[40]。因此,Notch-Hes1轴被认为是OA发展的重要机制。本研究中,虽然没有以软骨形成的各种蛋白酶及转录因子为研究对象,但是本研究以PCNA、ColⅡ和ACAN作为观察指标,实验结果表明过表达NICD激活Notch通路可抑制OA软骨细胞基质合成,恰恰证实了这一观点。
Yang等[42]发现软骨特异性 Notch 信号的丢失或减少能够减少小鼠关节内MMP13的含量,并在短期内延缓软骨退化。因此,我们认为抑制Notch通路可促进OA软骨细胞增殖和软骨基质合成。此外,Liu等[10]的研究表明 Notch 信号传导的病理增益导致IL6和STAT3增加以及 MAPK信号传导,这有助于关节软骨退化和纤维化。此外,其他一些信号通路,如受体酪氨酸激酶信号通路、GPCR 信号通路和 NO 信号通路,随着 NICD1在软骨细胞中的持续表达而显著增加。因此,需要Notch 信号活动的良好时空平衡来维持关节软骨稳态和关节完整性[43-44]。现阶段虽无逆转OA病程进展的药物,但通过OA的潜在靶点精准治疗OA仍具有可能性。本研究发现,过表达NICD激活Notch通路可抑制C28/I2细胞增殖和基质的合成能力;抑制Notch信号通路可提高C28/I2细胞增殖和基质的合成能力,在维持软骨细胞功能上有保护作用,可能会成为OA治疗中的潜在靶点之一。本研究仅为体外实验,课题组后续将进一步展开对Notch信号通路的在体动物研究,为OA未来的靶向治疗提供新的理论依据。

