胶体金免疫层析法快速检测食品中的米酵菌酸
曹雪铭,徐振林*,苏燕瑜,王 宇,雷红涛,肖 剑
(1 华南农业大学 广东省食品质量安全重点实验室 广州 510642 2 广州市食品检验所 广州 510410)
米酵菌酸(Bongkrekic acid,BA)是唐菖蒲伯克霍尔德菌椰毒致病变种(Burkholderia gladioli pv.Cocovenenans,BGC)分泌的一种毒素,最早于20世纪30年代被荷兰学者Mertens 和Vanveen在研究爪哇居民椰子发酵食物中毒时发现[1]。流行病学研究表明,BGC 极易污染谷类制品(发酵玉米面、糯玉米汤圆、玉米淀粉等)、变质银耳和薯类制品(马铃薯粉条、甘薯淀粉、山芋淀粉等)等[2]。BA是一种强呼吸毒素,主要靶器官是肝、脑、肾等脏器[3],一旦中毒会因呼吸衰竭而死亡[4-6],其次由于BA 有较强的热稳定性,普通的烹饪方式很难将其去除。有研究表明人体摄入1~1.5 mg 的BA 可能引起生命垂危,而另一项研究则认为口服BA 对人体的半数致死量为3.16 mg/kg[7]。据不完全统计,自2014年以来,我国由BA 引起的食物中毒事件高达几十余起,病死率高达50%以上[8]。2018年11月广东省东莞市先、后出现5 例不明原因急性肝衰竭的病例,其中3 例死亡,在疑似变质的银耳和患者血液标本中均检出高浓度BA[9]。2020年7月28日,11 位顾客在广东省揭阳市惠来县神泉镇石头肠粉店食用河粉后,先、后出现呕吐、腹泻等疑似食物中毒症状,其中1 人死亡;2020年10月5日黑龙江鸡东县发生一起因家庭聚餐食用酸汤子引发的食物中毒事件,9 人食用后全部死亡[10]。为了预防中毒事件的发生和应对中毒后的快速治疗处理,建立BA 的快速灵敏检测方法十分必要。
目前针对BA 的检测方法主要包括高效液相色谱法[11-12]、高效液相色谱-串联质谱[13-15]、超高效液相色谱[16]、超高效液相色谱-串联质谱[17-18]以及荧光层析法[19]等。这些方法虽然准确可靠,但是往往操作比较复杂,检测时间长,成本也较高。基于抗原、抗体特异性结合的免疫分析方法因其快速、灵敏、准确和高通量等优点而深受青睐,特别是胶体金免疫层析法(Colloidal gold immunochromatography,GICA)易操作和低成本的优势,而被广泛应用于食品安全快速筛查[20-23]。早期,刘秀梅等[24-25]制备了抗BA 的抗体并建立了间接竞争酶联免疫分析方法。然而,该方法灵敏度欠佳且尚未在实际检测中应用。对此,本研究开展了BA 特异性单克隆抗体的制备与筛选,并建立了GICA 检测方法,对影响GICA 检测性能和稳定性的条件进行系统优化,最后用于银耳、木耳和米粉等实际样品的检测。
1 材料与方法
1.1 材料与试剂
样品垫、硝酸纤维膜(NC 膜)、吸水垫和聚氯乙烯底板(PVC 底板),上海金标生物技术有限公司;样品垫处理液、金标复溶液,广州万联生物科技有限公司;氯金酸、柠檬酸三钠,国药集团化学试剂有限公司;羊抗鼠IgG,北京全式金生物有限公司;米酵菌酸标准品,上海安谱实验科技股份有限公司;米酵菌酸包被原(BA-BSA)、抗米酵菌酸单克隆抗体(Anti-bongkrekic acid monoclonal antibody,Anti-BA mAb),实验室自制;银耳、木耳、米粉,广州食品检验所;其余试剂均为分析纯级。
1.2 仪器与设备
HGS510 划膜仪、HGS201 裁条机、GIC-Q 金标读数仪,杭州峰航科技有限公司;低温高速离心机,德国Eppendorf 公司;MS 漩涡震荡器,德国IKA 公司;SKFG-01 烘箱,湖北黄石市恒丰医疗机械有限公司;Waters 2695 高效液相色谱仪,美国Waters 公司。
1.3 方法
1.3.1 Anti-BA mAb 的制备 将BA 通过活泼酯法与乳铁蛋白(LF)偶联制备免疫抗原,以皮下注射的方式免疫Balb/c 小鼠。选择免疫原效价最高的小鼠作为脾细胞供体,用于杂交瘤的产生。将上述脾细胞通过细胞融合技术与SP2/0 鼠骨髓瘤细胞融合形成杂交瘤细胞,然后通过有限稀释的方法,将分泌BA 特异性抗体的杂交瘤细胞亚克隆5次,并对最佳的抗体产生克隆进行筛选和扩增,以获得高质量的抗体。
1.3.2 胶体金的制备 采用柠檬酸三钠还原法制备胶体金颗粒[21]。准确称量100.0 mL 屈臣氏水于干净的圆底烧瓶,置于磁力搅拌油浴锅中搅拌加热回流至煮沸,随后加入4.0 mL 10.0 g/L 的氯金酸溶液,持续加热搅拌至再次沸腾后,迅速加入4.6 mL 10.0 g/L 的柠檬酸三钠溶液,待溶液颜色变成透亮的酒红色,持续搅拌10 min 后停止加热,并利用余热继续搅拌5 min 后冷却至室温,4℃保存备用。
1.3.3 单克隆抗体-胶体金标记物的制备 取1.0 mL 1.3.2 节制备的胶体金溶液,用0.2 mol/L 碳酸钾溶液将胶体金溶液调节至合适的pH 值,加入一定量的抗体,室温下振荡反应15 min,再加入40.0 μL 100.0 g/L 的BSA 溶液封闭没有结合抗体的位点,继续室温下振荡反应1 h。4 ℃条件下,10 000 r/min 离心10 min,弃上清,加入1.0 mL 金标复溶液使红色沉淀物复溶并混匀,最后将其包被在96 孔的酶标板中,包被体积为40 μL,45 ℃过夜烘干待用。
1.3.4 GICA 方法的建立
1.3.4.1 试纸条的组装 试纸条是由PVP 底板、样品垫、NC 膜以及吸水垫组成。首先将BA-BSA和羊抗鼠IgG 用0.2 mol/L 磷酸缓冲液(pH 7.4)稀释至适合浓度,用划膜仪喷洒于NC 膜上,分别作为检测T 线和质控C 线,45 ℃干燥箱中静置过夜待用。另外将玻璃纤维素膜(预先切割成22 mm宽)在样品垫处理液中浸泡10 min,取出后在45℃下过夜烘干待用。最后将样品垫、NC 膜和吸水垫依次粘贴在PVP 板上,用切条机切割成4 mm宽的试纸条用于后续试验。
1.3.4.2 检测步骤和原理 取100.0 μL 配好的标准溶液或样品提取液加入金标微孔中吹打混匀,反应3 min 后,将微孔内的所有溶液吸出,加到试纸条的样品垫上反应5 min。如图1所示,胶体金标记的Anti-BA mAb 会被固定在NC 膜上的BA-BSA 捕捉,形成一条红色的检测线,而过量的Anti-BA mAb 进一步迁移,并被形成对照的羊抗鼠IgG 抗体捕获。当样品中有目标分析物BA 存在时,它将与检测线上的BA-BSA 竞争,并优先结合胶体金标记的Anti-BA mAb,检测线从而表现为不显色。通过读数仪测定,建立标准曲线,可对样品中BA 含量进行测定。

图1 GICA 检测示意图Fig.1 Schematic diagram of GICA
1.3.5 GICA 检测条件的优化 为了实现最佳的检测灵敏度、稳定性和良好的色彩强度,探究了几个重要参数的优化,包括标记体系pH 值、标记抗体质量浓度、T、C 线质量浓度、样品垫处理液以及样品前处理方法。为了准确地说明优化过程,筛选出最佳抑制率条件,应用读数仪对检测线进行扫描,可得到T 线和C 线的信号值。抑制率按以下公式计算,BX为阳性样品T 线和C 线信号强度比值,B0为阴性样品T 线和C 线信号强度比值。
1.3.6 试纸条的性能评价
1.3.6.1 灵敏度 GICA 方法不仅可以定性检测目标分析物,还可以利用读卡仪定量检测。定性检测时,试纸条的检出限定义为裸眼消线值,即引起检测线颜色消失的最低分析物浓度[26]。使用0.01 mol/L PB 溶液配制系列标准品溶液(0.00,0.25,0.50,1.00,2.00,3.00,4.00,8.00,16.00,32.00,64.00 μg/kg),定量分析时,以检测样本与阴性样本的检测线信号值的比值(B/B0)为纵坐标,以BA 含量或含量的对数值为横坐标绘制散点图,用Origin 8.0拟合后得标准曲线和标准曲线方程。根据线性曲线方程可计算出GICA 方法的半抑制浓度(IC50)(用于评估试纸条灵敏度)和检出限(LOO),同时通过相关数(R2)判断线性回归方程的拟合优度。
1.3.6.2 特异性 将食品中常检的其它毒素:毒黄素(TF)、呕吐毒素、T-2 毒素(T-2)、伏马毒素(FB)、赭曲霉毒素(OTA)、黄曲霉毒素B1(AFB1)、玉米赤霉酮(ZEN)用0.01 mol/L 的PB 缓冲液稀释后用试纸条进行检测,判断试纸条的特异性。
1.3.6.3 实际样品检测 首先对阴性银耳、木耳及米粉进行米酵菌酸添加回收试验。选择3 个不同含量(2.0,10.0,50.0 μg/kg)的样品用本试验所优化的样品前处理方法和GICA 测定。其次是盲样检测。参考曾雪芳等[17]使用LC-MS/MS 方法进行检测,最后将结果与GICA 方法检测结果比较,以其验证GICA 方法的准确度。
2 结果与讨论
2.1 抗BA 单克隆抗体性能鉴定
本研究通过细胞融合和有限稀释筛选获得了一株分泌特异性识别BA 的单克隆抗体的细胞株,命名为C3。该抗体亚型为IgG1(图2a)。将该细胞株注射小鼠腹腔制备腹水,并经亲和柱纯化获得单克隆抗体,经凝胶电泳鉴定,抗体纯度良好(图2b)。

图2 抗米酵菌酸单克隆抗体的性能鉴定Fig.2 Performance evaluation of the Anti-BA mAb
2.2 胶体金免疫层析条件优化
2.2.1 标记pH 值和抗体标记体积的优化 胶体金溶液pH 值会影响抗体与标记物的结合效率以及抗体活性[27-28]。胶体金溶液pH 值一般是通过控制标记过程中K2CO3溶液的体积来调节。如图3a所示,探究0.2 mol/L K2CO3溶液的体积(5,10,15,20,25 μL)对胶体金性能的影响。当K2CO3用量从5.0 μL 增加为10.0 μL 时,试纸条T、C 线的颜色明显变深;而随着K2CO3体积的增加,试纸条T 线颜色逐渐变浅且T/C 比值无明显变化。综上,K2CO3的体积为10.0 μL 时,该试纸条的灵敏度和显色情况表现为最佳。
抗体标记体积是影响胶体金试纸条检测效果的关键性因素,适量的抗体标记体积有利于胶体金-抗体结合物的稳定性,而标记过量可能导致灵敏度下降[29-30]。在最适标记pH 值条件下,比较不同抗体标记体积对试纸条检测效果的影响。结果显示,在1 mL 胶体金溶液中,当标记的抗体浓度较低时阴性T 线显色不明显,当标记体积分别为4.0 μL 和5.0 μL 时(对应抗体标记量为16.0 μg和20.0 μg),试纸条的T、C 线显色明显。标记过程中添加抗体的体积为4.0 μL 可达到检测要求且在后期实验中抑制率较好,因此选择4.0 μL 作为最佳抗体标记体积(图3b)。
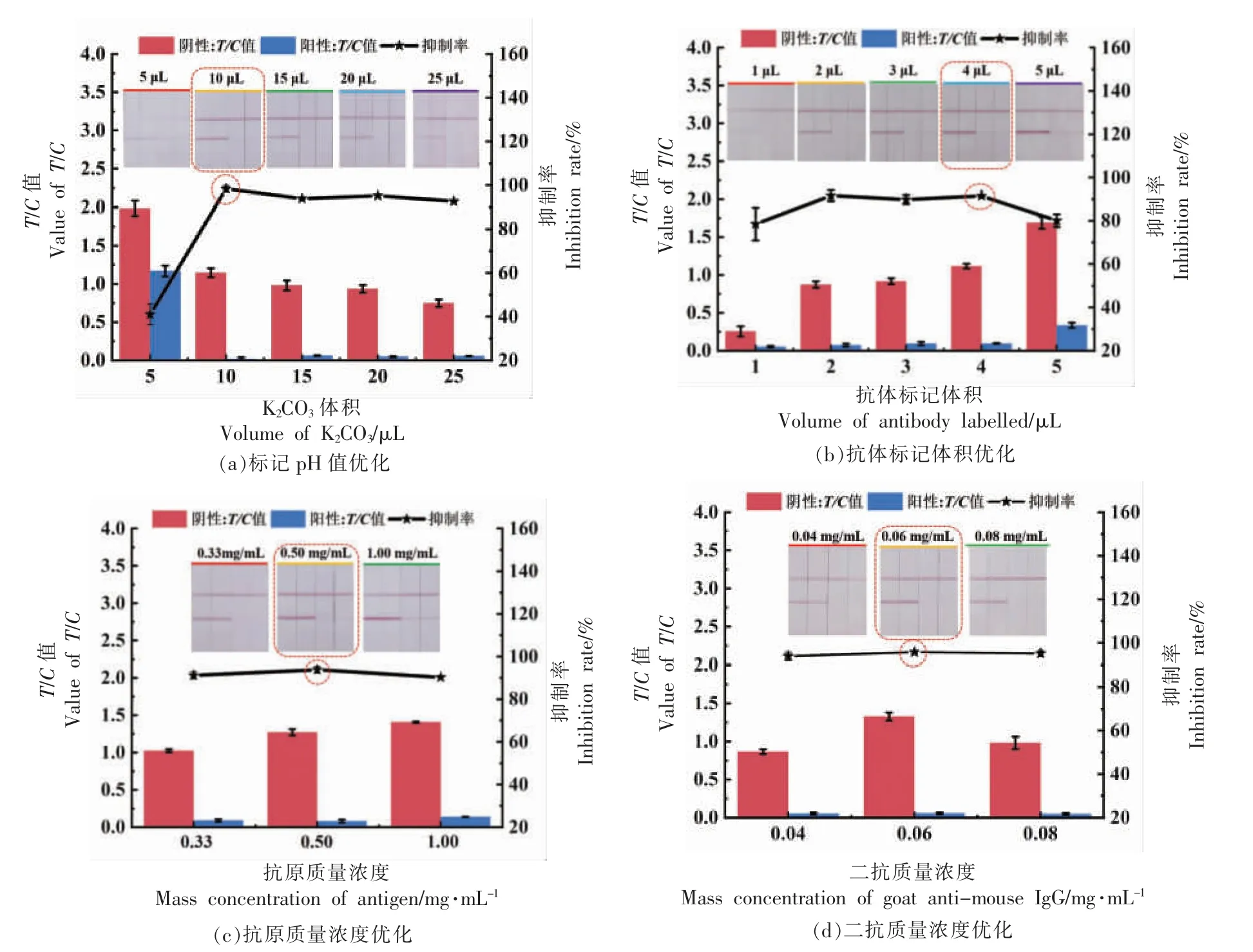
图3 不同反应条件对GICA 性能的影响Fig.3 Effects of different reaction conditions on GICA performance
2.2.2 T 线(抗原)和C 线(二抗)包被质量浓度优化 为了使试纸条的灵敏度和显色达到最佳效果,对T 线和C 线的包被质量浓度进行优化。从图3c 可以看出,随着抗原质量浓度的增加,裸眼观察时试纸条的T 线颜色逐渐变深;使用读数仪测定时,试纸条的T/C值虽不断增大,但抑制率却呈现先上升后逐渐下降的趋势。当包被质量浓度为0.50 mg/mL 时试纸条的T/C值更接近1.0 且抑制率较高,故选择0.50 mg/mL 作为最佳T 线包被质量浓度。
在最佳T 线包被质量浓度下,对C 线包被质量浓度进行优化,随着二抗质量浓度的增加,裸眼观察时,试纸条C 线的颜色不断加深,;使用读数仪测定时,虽然包被质量浓度为0.06 mg/mL 和0.08 mg/mL 时试纸条的抑制率无明显区别,但包被质量浓度为0.06 mg/mL 条件下试纸条T、C 线显色较明显,故选择0.06 mg/mL 为最佳C 线包被质量浓度(图3d)。
2.2.3 样品垫缓冲液中离子浓度和吐温-20 质量浓度优化 样品垫的缓冲体系不仅影响抗原、抗体在NC 膜上的结合,还对样品待测液起到一定的缓冲作用[31]。样品垫中缓冲液离子浓度和表面活性剂对试纸条检测性能的影响。如图4a所示,当离子浓度为0.5 mol/L(PB 缓冲液)时,抗原抗体的结合受到较大影响,试纸条显色不明显。随着缓冲液离子浓度降低,试纸条的显色逐渐增强,当离子浓度为0.2 mol/L 时,试纸条阴性T/C值比0.01 mol/L 更接近1.0,且显色明显。因此样品垫缓冲体系中最佳离子浓度为0.2 mol/L。
在最优离子浓度条件下,对表面活性剂吐温-20 的质量浓度进行优化。结果表明,在同一检测条件下,不添加吐温-20 的试纸条显色很淡,随着吐温-20 添加量的增大,试纸条显色逐渐加深;使用读数仪测定时,吐温-20 质量浓度为5.0 mg/mL时试纸条的阴性T/C值为1.1,抑制率为93.6%,相比更高添加量的吐温-20,该添加量的抑制效果已经达到最大(图4b),体系中选择吐温-20 添加质量浓度为5.0 mg/mL。

图4 工作缓冲液和不同提取剂对GICA 性能的影响Fig.4 Effects of buffer solution and sample extractant on GICA performance
2.3 样品前处理提取溶剂的优化
银耳、木耳和米粉3 种样品经粉碎后,分别使用0.01 mol/L 的PB 缓冲液、乙腈和乙酸乙酯进行提取。PB 缓冲液直接提取的样品液基质干扰大,无法提取样品中的米酵菌酸。采用有机溶剂提取后吹干复溶进行检测,发现乙腈提取银耳和木耳样品有干扰,阴性样品出现假阳性(T/C值<1.0),且5.0 μg/kg 加标样品回收率均低于50%;相比之下,乙酸乙酯提取效果较好,基质干扰小,加标样品回收率均高于80%(图4c)。因此,选择乙酸乙酯最为提取溶剂。
2.4 试纸条性能评价
2.4.1 灵敏度 在上述的优化条件下进行试验。在0~64.0 μg/kg 的BA 含量范围内,根据检测BA含量和试纸条检测结果绘制标准曲线。当BA 含量达到16.0 μg/kg 时,胶体金试纸条检测线条带完全消失,因此该试纸条检测BA 的裸眼消线值为16.0 μg/kg(图5a)。通过拟合结果,本研究所建立的方法检出限为(LOD)1.2 μg/kg,IC50为3.6 μg/kg,其中在1.8~7.2 μg/kg 的BA 含量范围内,所建立的GICA 方法对BA 检测有良好的线性关系,其线性回归方程为Y=0.93-0.13X(R2=0.995)(图5b)。
2.4.2 实际样品检测 选择银耳、木耳和米粉3种样品进行添加回收实验,BA 添加量为2.0,10.0 μg/kg 和50.0 μg/kg,每个添加量设3 个重复。采用上述样品前处理后进行检测,结果如表1所示。3个样品中BA 的添加回收率在80.2%~101.2%之间,RSD<6.4%。在盲样检测中,首先采用优化后的LC-MS/MS 色谱条件和质谱参数进行测定,BA 的多反应检测(MRM)色谱图如图5c所示,峰型对称,分离效果好,响应灵敏度高,重现性好;最后对GICA 方法的检测结果进行验证。如图5d所示,两种方法具有很好的相关性(R2=0.988),说明本研究所建立的免疫层析检测方法具有良好的准确性。最后对比了文献中关于BA 的检测方法,本研究建立的免疫层析法不仅灵敏度高,而且操作简便、成本低,能满足市场的大批量筛查(表2)。
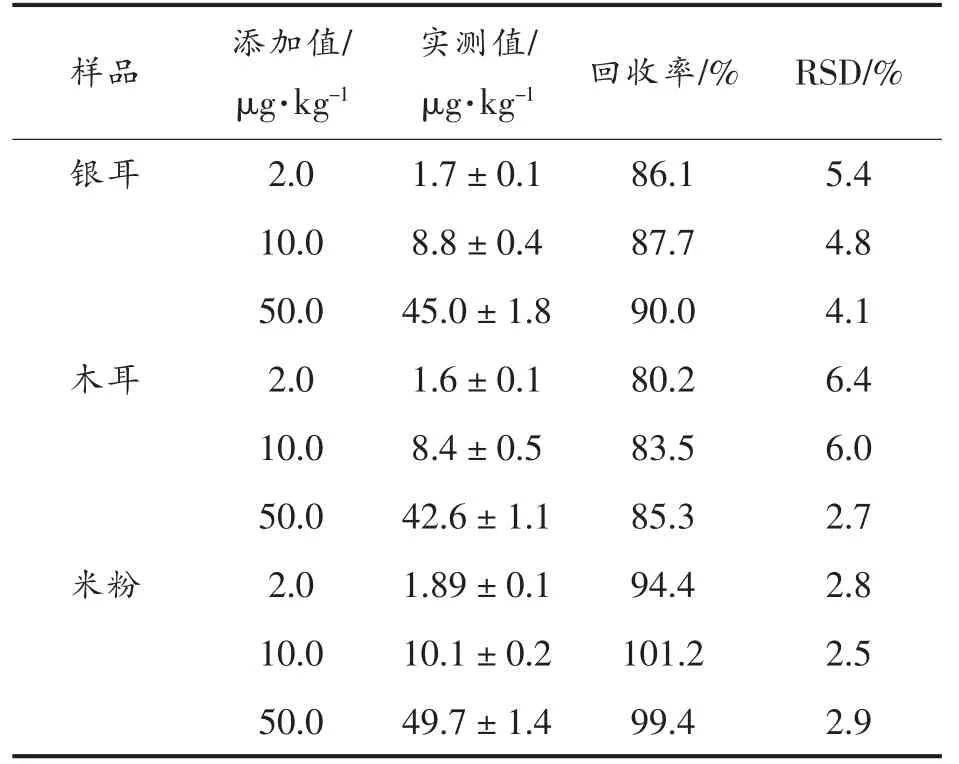
表1 样品添加回收检测结果(n=3)Table 1 Recoveries of spiked samples(n=3)

表2 检测米酵菌酸方法对比结果Table 2 Comparison of the analytical methods for BA
2.4.3 特异性 选取另外几种常见的毒素如TF、呕吐毒素、T-2、FB1、OTA、AFB1 和ZEN 进行特异性试验。如图5e所示,GICA 对低添加量BA(16.0 μg/kg)显示强阳性,而对7 种常见毒素在高含量下(1.0 μg/g)均为阴性,表明该方法的特异性强,与常见的毒素无交叉反应。
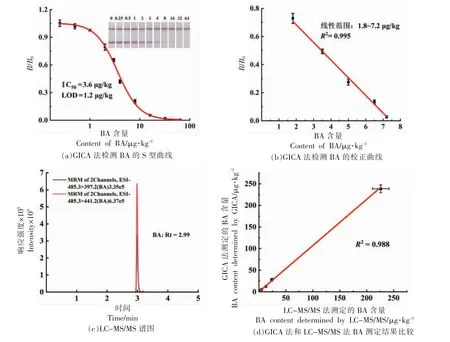

图5 GICA 性能评价Fig.5 Performance evaluation of the GICA
2.4.4 试纸条稳定性 为了验证试纸条的稳定性,参考Liu 等[32]的方法,在45 ℃下进行加速稳定性试验。图5f 记录不同时间段试纸条的T/C值和抑制率。结果表明,加速试验7,14 d 和28 d 后,试纸条的阴性显色和阳性抑制均保持良好的稳定性。
3 结论
本文首次建立了基于单克隆抗体快速检测BA 的胶体金免疫层析方法。该方法可以实现对食品中BA 含量的快速定量检测,检出限为1.2 μg/kg,线性范围为1.8~7.2 μg/kg;也可以进行定性检测,裸眼消线值为16.0 μg/kg。该方法特异性良好,与常见的其它毒素无交叉反应,且稳定性好,有较长的货架期。对实际样品进行添加回收试验,结果表明样品添加回收率在80.2%~101.2%之间,RSD<6.4%,且结果与LC-MS/MS 吻合度高,表明本研究建立的方法准确、灵敏、可靠,且检测时间短。总之,本研究建立的快速检测方法非常适用于食品中BA 的现场快速筛查,可以作为风险监测和预警手段用于实际监管中。

