泛素受体蛋白OsDSK2b负向调控水稻叶瘟和渗透胁迫抗性
丁杰荣 马雅美 潘发枝 江立群 黄文洁 孙炳蕊 张 静 吕树伟 毛兴学 于 航 李 晨,* 刘 清,*
泛素受体蛋白OsDSK2b负向调控水稻叶瘟和渗透胁迫抗性
丁杰荣1,**马雅美1,**潘发枝2江立群1黄文洁3孙炳蕊1张 静1吕树伟1毛兴学1于 航1李 晨1,*刘 清1,*
1广东省农业科学院水稻研究所 / 广东省水稻育种新技术重点实验室 / 广东省水稻工程实验室, 广东广州 510640;2华南农业大学, 广东广州 510642;3广东省农业科学院农业生物基因研究中心 / 广东省农作物种质资源保护与利用重点实验室, 广东广州 510640
泛素受体蛋白DSK2 (dominant suppressor of KAR2)在植物生长发育和逆境胁迫中发挥重要作用, 但其在水稻抗病和渗透胁迫中的作用尚未见报道。本研究发现受多种逆境的调控, 该基因的表达水平在稻瘟病菌侵染和20% PEG-6000处理后显著降低。时空表达分析表明基因在三叶期幼苗中的表达水平最高, 亚细胞定位结果显示该蛋白定位于细胞质。接种稻瘟病菌(GD08-T13和Guy11)后, 敲除植株的病斑面积约为0.05 cm2和0.10~0.13 cm2, 远小于野生型植株的病斑面积(0.24 cm2和0.31 cm2)。敲除显著增强水稻的叶瘟抗性。而且在病原菌侵染后, 敲除植株中病程相关蛋白()基因的表达受到明显诱导。敲除也显著增强水稻的渗透胁迫抗性, 20% PEG-6000模拟渗透胁迫处理后,敲除植株的存活率为58.3%~74.0%, 显著高于野生型植株的存活率(17.0%)。敲除植株的离子渗透率和植株失水率则显著低于野生型植株。扫描显微镜的结果表明, 无论在20% PEG-6000处理前后, 敲除能够促进气孔的闭合, 且在20% PEG-6000处理后, 这种促进作用会更强。此外, qRT-PCR结果表明, 在20% PEG-6000处理后,敲除植株中基因以及脱落酸(ABA)合成或通路相关基因的表达水平显著高于野生型植株, 且敲除植株和的内源ABA含量分别为314.2 ng g–1和344.4 ng g–1, 显著高于野生型植株的内源ABA含量(206.8 ng g–1), 揭示参与调控渗透胁迫的过程同时涉及ABA依赖和ABA非依赖途径。本研究通过解析基因在水稻应对生物与非生物胁迫时所发挥的调控作用, 为水稻抗性品种的选育提供了新的候选基因。
水稻(L.); 稻瘟病; 渗透胁迫; PR; DREB; ABA
植物遭受各种逆境胁迫时, 细胞内会产生各种有害蛋白, 使植物生长发育受到严重影响。泛素/26S蛋白酶体系统(ubiquitin/26S proteasome system, UPS)由泛素(ubiquitin, Ub)、泛素激活酶(ubiquitin- activating enzyme, E1s)、泛素结合酶(ubiquitin- conjugating enzyme, E2s)、泛素连接酶(ubiquitin ligase enzyme, E3s)和26S蛋白酶体组成, 可以有选择性地清除细胞内变性、错误折叠和各种调节蛋白, 在植物应对胁迫反应中起着重要的作用[1-2]。前人研究发现, 拟南芥E3泛素连接酶基因通过调控脱落酸(abscisic acid, ABA)的合成影响植物耐旱性[3],(C)通过对茉莉酸(jasmonic acid, JA)含量的影响, 调节植物抗性和育性[4]。
DSK2 (dominant suppressor of KAR2)是一类泛素受体蛋白, 存在于人类、拟南芥、水稻、刚性弓形虫和酵母等物种中[5-7]。DSK2具有UBA (C-terminal ubiquitin-associated domain)和UBL (N-terminal ubiquitin-like domain)结构域, 它们的UBA和UBL结构域可分别与泛素化的底物和蛋白酶体亚基相结合, 将多泛素化底物转运到蛋白酶体进行降解[6,8-9]。Zhang等[6]研究发现DSK2对弓形虫细胞内复制有重要作用。Wang等[10]研究发现DSK2参与球孢白僵菌的分生孢子萌发、多重胁迫耐受和热适应。拟南芥的DSK2a和DSK2b均可与PEX2、PEX10和PEX12等蛋白互作, 形成过氧化物体膜相关蛋白降解系统, 影响过氧化物酶体的功能[11]。水稻的OsDSK2a则通过调节赤霉素代谢平衡影响水稻生长和盐胁迫应答[7]。植物中对DSK2的功能研究还较少, 它们在植物应对各种胁迫时所发挥的功能及其分子机制仍亟待研究。
稻瘟病会严重影响水稻的产量和谷物品质[12]。病程相关蛋白(pathogenesis-related protein, PR蛋白)通过水解病原菌细胞壁、降解病原毒素、抑制病原外壳蛋白与植物受体结合等方式赋予了植株体外抗病原菌的能力[13]。不同基因的抗病机制也不同, 其中通过过敏反应介导的防御途径和水杨酸介导的抗性反应增强对植株真菌的抵抗能力[14]。能编码催化降解病原真菌细胞壁中β-1,3葡聚糖的β-1,3葡聚糖酶[15]。编码具抗真菌活性的permatins、zeamatins、osmotins和具葡聚糖酶活性的类甜蛋白[16]。编码的几丁质酶能降解病原真菌细胞壁中的几丁质[17]。诱导稻瘟病抗性且防御过程与过敏性反应有关[18]。PR蛋白在植物抗病反应中被诱导表达, 在抗病过程中发挥着重要作用[19]。
干旱胁迫会严重影响水稻的生长, 导致水稻减产[20]。植物受到干旱胁迫时, DREB (dehydration responsive element binding)转录因子能激活干旱等逆境相关基因的表达, 从而增强植物的耐逆性[21]。ABA合成基因()和()能促进ABA的合成和积累, 从而影响()、()、()和()等ABA通路相关基因的表达, 进而影响植株的耐旱性[22-23]。
OsDSK2b是本实验室前期在研究类胚素蛋白调控水稻稻瘟病抗性的过程中, 通过酵母双杂交筛选到的其中一个候选互作蛋白, 它可能在水稻抗稻瘟病过程中起着重要作用。本研究以野生型日本晴和3个的CRISPR-Cas9敲除植株为研究对象, 测定了在不同逆境处理下的三叶期野生型日本晴和正常生长条件下的野生型日本晴各部位的表达水平, 并对OsDSK2b进行了亚细胞定位。同时鉴定了野生型和基因敲除株系稻瘟病和渗透胁迫的表型, 观察了野生型和基因敲除株系渗透处理前后的气孔状况, 并测定了它们的内源ABA含量。本研究还测定了稻瘟病胁迫处理前后相关基因的表达水平和20% PEG-6000处理前后部分基因、ABA合成基因和ABA通路相关基因的表达水平。旨在阐明在水稻耐逆胁迫中的功能及其响应的分子机制。
1 材料与方法
1.1 植物材料及试剂
使用日本晴(L. spp.)为水稻遗传转化受体, 所获得的转基因植株后代均种植于广东省农业科学院水稻研究所转基因试验田, 常规田间种植管理。本研究用的主要试剂有: TRIzol(湖南艾科瑞生物工程有限公司)、KOD FX(东洋纺(上海)生物科技有限公司)、DNA重组试剂盒(南京诺唯赞生物技股份有限公司)、I-HF(New England Biolabs)、T4 DNA连接酶(New England Biolabs)、Evo M-MLV反转录试剂盒(湖南艾科瑞生物工程有限公司)和ProHS SYBR Green Mix(湖南艾科瑞生物工程有限公司)。多靶点基因编辑载体pYLCRISPR/Cas9Pubi-H、pYLgRNA-OsU6a和pYLgRNA-OsU6b由华南农业大学刘耀光院士馈赠。引物由生工生物工程(上海)股份有限公司合成(表1)。

表1 本研究所使用的引物信息表
1.2 实验方法
1.2.1敲除株系的获得 从水稻Rice Genome Annotation Project (http://rice.uga.edu/)数据库中获得()的基因序列, 依据Xie等[24]提供的方法在第2个外显子区分别设计2个靶点。通过重复叠加法(Overlapping PCR)构建sgRNA表达盒[25]。第1轮PCR用接头引物 U-F/-6aF和U-F/-6bF分别扩增U6a和U6b启动子; 用接头引物gR-R/- 6aR和gR-R/-6bR分别扩增U6a和U6b终止子。第一轮PCR产物直接稀释10倍后各取1 μL作为第2轮PCR模板, 用位置特异引物Pps-GGL/ Pgs-GG2和Pps-GG2/Pgs-GGR分别进行第2轮扩增, 琼脂糖凝胶电泳检测目的条带。利用PCR产物纯化回收试剂盒分别回收6a和6b表达盒。然后每个表达盒各取20 ng, 利用I和T4 DNA连接酶将表达盒连接到pYLCRISPR/Cas9Pubi-H质粒。连接完成后, 取一半连接产物通过热激法将连接产物导入大肠杆菌DH5α感受态细胞, 培养过夜后挑单菌落, 用引物对SP1/SP2进行PCR验证。PCR检测阳性的质粒进一步通过测序的方法进行验证。
选取构建好的编辑质粒送武汉伯远生物有限公司进行水稻遗传转化, 共获得36株T0代转基因植株。采用十六烷基三甲基溴化铵(CTAB)法提取转基因植株叶片的DNA, 而后利用OsDSK2bJC-F/ R引物扩增编辑位点两侧的基因组序列。通过DNA测序检测的基因编辑情况。
1.2.2 不同逆境处理及取样 将野生型日本晴种子置于49℃烘箱2 d以打破休眠, 然后置于清水中室温浸泡36 h。种子吸涨后, 沥干表面水分, 并置于32℃培养箱黑暗条件下催芽2d。选取发芽一致的种子置于96 孔板中, 清水培养至苗长5cm时, 换成木村营养液培养至三叶期。三叶期的幼苗用于不同逆境处理, 处理条件分别如下: (1) 稻瘟病菌接种: 取大小一致的叶片离体接种稻瘟病菌生理小种Guy11 (具体接种方法见1.2.5), 分别于接种后1、2、3、4和5d取样; (2) 聚乙二醇6000(PEG-6000)、NaCl处理: 三叶期的幼苗分别置于用木村培养液配置的20% PEG-6000和150mmol L–1NaCl溶液中, 分别于处理前后0、3、6、9、12和24h取样; (3) ABA处理: 采用叶喷的方法将100μmol L–1ABA溶液均匀喷洒于水稻幼苗表面, 直至培养盆底部有明水出现, 分别于处理前后0、3、6、9、12和24h取样。取样时, 用剪刀取下幼苗除根部外的地上部所有组织, 每个时间点取3株幼苗混样, 用锡箔纸包好, 用液氮速冻后置于-80℃冰箱保存备用。每个取样时间点均同时取一个未处理样品作为对照, 以防止光照对基因表达的影响。水稻幼苗培养与逆境处理均于宁波江南仪器厂智能光照培养箱(GXZ型)中完成, 其参数设定为: 光照200 μmol m–2s–1, 光周期12h, 温度28℃, 相对湿度75%。
1.2.3 亚细胞定位 为了检测OsDSK2b蛋白的亚细胞定位, 我们采用引物OsDSK2b-GFP-F/R扩增的编码序列插入35S-GFP载体以产生OsDSK2b-GFP融合蛋白。然后将OsDSK2b-GFP融合蛋白以及35S-GFP空载蛋白按照Zhang等[26]提供的方法分别转入到水稻原生质体中。26℃孵育24 h后, 使用激光共聚焦显微镜(蔡司LSM710, 德国)观察GFP荧光。
1.2.4 荧光定量PCR检测基因表达 日本晴不同组织(2周龄幼苗、幼根、茎节、倒二叶、旗叶、孕穗期根、幼穗和抽穗期穗)以及日本晴三叶期幼苗在稻瘟病分离株Guy11、20% PEG-6000、150 mmol L–1NaCl和100µmol L–1ABA处理的样品用液氮研磨后, 采用TRIzol法提取总RNA, 微量分光光度计(NanoDrop One)检测RNA浓度并电泳检测RNA质量。取500ng总RNA用Evo M-MLV反转录试剂盒(湖南艾科瑞生物工程有限公司)反转录为cDNA, 反转录程序为: 37℃反应15min; 85℃反应5s。荧光定量PCR (qRT-PCR)反应以cDNA为模板, 内参选用基因, 具体反应体系包含1µL cDNA模板、10µL ProHS SYBR Green Mix(湖南艾科瑞生物工程有限公司)、正反引物各1 µL和7µL无菌水。扩增反应在Bio-Rad实时荧光定量PCR仪(CFX Connect Optics Module)里进行, 扩增程序为: 95℃3min; 95℃5s, 60℃30s, 循环40次。基因相对表达量的计算用2–ΔΔCt法, 结果用平均值±标准方差表示。
1.2.5 稻瘟病抗性鉴定 野生型日本晴和敲除植株的稻瘟病抗性鉴定采用活体接种和离体接种2种方法。水稻种子的发芽过程同上(方法1.2.2), 将3.5 kg从水稻田中挖取的泥土装入30 cm×15 cm×8 cm的方盆中, 混匀后, 选取发芽一致的种子播种到方盆中, 置于网室生长。活体接种(打孔接种)使用的菌株为GD08-T13, 具体方法如下: 三叶期的水稻幼苗移栽到直径为30 cm的黑桶中继续培养至分蘖盛期(约播种后42 d左右), 选取生长较一致的水稻叶片用于稻瘟病菌接种, 其方法参考Ding等[27]。水稻叶片用老鼠耳夹按压出伤口后用移液枪吸取10 µL浓度为5×105个孢子 mL–1的菌液(菌液中包含0.05%的吐温20)滴到伤口中, 再用防水胶布将菌液固定在水稻叶片上。每个株系至少接种10株, 每株至少接种3片叶。接种后的植株于26℃黑暗培养24 h, 之后转移到网室继续培养6d, 每隔2h喷水一次(每次2 min)以保持湿度。接种7 d后通过ImageJ程序(http://imagej.nih.gov/ij/)测量病斑面积。将菌斑从叶片上剪下来后用双面胶固定在白纸上并照相。
离体接种使用的菌株为Guy11, 具体方法如下: 剪取三叶期水稻幼苗的第1片叶片(从上至下)于方形培养皿(事先于底部平行粘贴2条近边长的双面胶)内进行固定(叶尖端与末端分别粘于双面胶, 叶片背面朝上), 将2条脱脂棉卷成适合放入方形培养皿大小的条状, 蘸取事先加入终浓度为2μg mL–1的激动素(kinetin, KT)的无菌超纯水, 轻轻挤去多余的液体,分别贴于叶尖端与叶末端, 盖上培养皿盖备用。用灼烧灭菌的打孔器在培养8d后的稻瘟病菌菌落边缘打取菌碟, 用灭菌的牙签挑取3~5个菌碟倒扣(菌丝面朝下)于同一叶片(背面), 以同样数量、大小且无菌的西梅果汁培养基为对照进行接种。接种完成后, 盖上培养皿盖(无需封口), 将整个方形培养皿轻轻放入托盘中, 小心地向托盘中加入适量无菌水(注意不要没过培养皿导致培养皿内进水), 用保鲜膜封住托盘以充分保湿, 最后将整个托盘置于28℃黑暗处理24h后, 转移至光/暗交替(12 h/12h)条件下继续处理, 处理期间可观察托盘内水量, 确保适量的水分, 5d后可开始观察水稻离体叶片的发病情况。接种7d后通过ImageJ程序测量病斑面积, 将接种后的叶片通过双面胶固定在白纸上并照相。
1.2.6 渗透胁迫表型鉴定 木村培养液培养的三叶期野生型日本晴和敲除植株幼苗用于渗透胁迫表型鉴定, 渗透胁迫采用20% PEG-6000处理。三叶期的水稻幼苗用包含20%PEG-6000的木村培养液培养3 d, 复水继续培养5 d, 之后统计株高, 用包含20%PEG-6000的木村培养液培养5 d, 复水继续培养5 d, 之后统计存活率。离子渗透率测定方法如下: 选取20% PEG-6000处理前(0 h)和处理后(24 h和48 h)的三叶期水稻植株上长势一致的倒二叶, 置于10 mL蒸馏水中孵育过夜, 用电导率计(B-173, 笔式, HORIBA, 日本)测定叶片煮沸前后的电导率, 离子渗漏率以煮沸前后电导率值的比值表示。植株失水率测定方法如下: 取三叶期长势基本一致的水稻幼苗地上部(除根部以外的部分)并立即放在干净的滤纸上, 称取初始净重, 计时为0min。之后在30、60、90、120、180、240和300min 7个时间点称重, 计算水稻幼苗的相对失水率。相对失水率(%)=(初始鲜重-测定时鲜重)/初始鲜重×100。
1.2.7 气孔成像与观察 选取三叶期野生型日本晴和敲除植株20% PEG-6000处理前和处理4 h的倒二叶, 立即置于戊二醛(生工生物工程(上海)股份有限公司)溶液中固定。气孔照片采用激光共聚焦扫描显微镜(S-3400N, 日立, 日本)拍摄。对叶片背面的气孔开度、气孔大小和密度进行统计分析。
1.2.8 ABA含量测定 选取三叶期野生型日本晴和敲除植株20% PEG-6000处理前和处理4 h的地上部用于ABA含量测定, 每个重复至少取15株幼苗。样品前处理参考Pan等[28]和Hui等[29]的方法, 具体如下: 称取100 mg新鲜水稻粉末样品(或50 mg冷冻干燥粉末样品), 加入500 μL异丙醇∶水提取液, 置于4℃振摇30 min, 再加入1 mL二氯甲烷, 充分混匀后, 在4℃下11,766转 min–1离心10 min, 取上清液800 μL置于氮气吹干后, 随后用甲醇水将样品复溶, 转移到带有150 μL内插管的进样瓶中用于LC-MS分析。
色谱质谱条件: 本试验采用超高效液相色谱三重四极杆串联质谱联用仪(API4000, AB SCIEX, 美国)进行激素分析。色谱柱: C18色谱柱(XBridge BEH C18, 2.5 μm, 2.1 mm´100.0 mm, Waters), 流速为0.1 mL min–1, 柱温为30℃。色谱分离系统采用梯度洗脱, A相为0.1%甲酸+5 mmol L–1甲酸铵 + 超纯水, B相为0.1%甲酸+ 5 mmol L–1甲酸铵+甲醇, 进样量为10 μL。洗脱梯度为: 0~2 min, 30% B; 2~20 min, 30%~100%B; 20~22 min, 100% B; 22~25min, 100%~30% B; 25~30min, 30% B。质谱分析系统采用电喷雾离子源(ESI)和三重四级杆质量分析器(API 4000), 采用定量模式为多反应监测(multiple reaction monitoring, MRM)采集数据。离子极性, 负离子; 电喷雾电压, −4500 V; 离子源温度, 550℃; 气源, 氮气; 气帘气, 25 psi; 雾化气, 55 psi; 碰撞气, 55 psi。用分析软件 Analyst 1.5.2 (AB SCIEX, 美国)进行仪器的控制和质谱数据的采集与处理。
1.2.9 数据分析 不同逆境处理、抗性基因表达检测和ABA含量检测, 均进行2次独立实验, 不同逆境处理和抗性基因表达检测每次实验设置3个生物学重复, ABA含量检测每次设置6个生物学重复。抗病以及渗透胁迫表型鉴定分别进行3次独立实验, 每次实验至少设置3个生物学重复。数据分析采用IBM SPSS统计软件(版本23)中的Dunnett’s测验, 所有数据用3个生物学重复的平均值±标准差表示。
2 结果与分析
2.1 多种胁迫影响OsDSK2b的表达
通过检测稻瘟病菌接种、渗透胁迫、高盐和ABA处理后三叶期水稻幼苗中的表达量, 发现的表达显著地受稻瘟病菌侵染、渗透胁迫、高盐胁迫和ABA处理的影响。上述胁迫处理后, 水稻中的表达量发生不同程度的变化。稻瘟病菌侵染显著抑制的表达, 在处理后的1d,的表达量显著降低, 约为处理前的1/3, 并一直维持至5d后。高盐胁迫诱导的持续表达, 在处理后的3h,的表达量显著升高, 之后呈现波动状态, 并一直维持到24 h后(图1-A)。渗透胁迫和ABA处理均使的表达量在处理后3h达到峰值, 后又在处理后的12 h降至处理前水平(图1-A)。这些结果表明,很可能在水稻生物胁迫和非生物胁迫中发挥重要作用。
2.2 OsDSK2b在水稻不同部位的表达模式和蛋白的亚细胞定位
为了更好地探究基因在水稻抗逆中的功能, 我们检测了该基因在水稻不同组织的表达情况以及该蛋白的亚细胞定位。荧光定量PCR的结果表明,在野生型日本晴的营养组织和生殖组织中均有不同程度表达(图1-B)。值得注意的是,在水稻两周龄幼苗的地上部中检测到较高的转录水平, 而在幼根和抽穗期穗中较低, 在茎、倒二叶、旗叶、孕穗期根和幼穗则处于中间水平, 表明在2周龄幼苗中的表达水平最高。亚细胞定位的分析结果显示, 对照(空载) GFP蛋白的绿色荧光信号在细胞质、质膜和细胞核中均有分布, 而OsDSK2b-GFP融合蛋白的绿色荧光信号主要分布于细胞质中, 表明OsDSK2b是一个定位于细胞质的蛋白(图1-C)。

(图1)
A:在稻瘟病分离株Guy11、20% PEG-6000、150mmol L–1NaCl和100μmol L–1ABA处理前后的相对表达量; B:在日本晴不同组织(2周龄幼苗、幼根、茎节、倒二叶、旗叶、孕穗期根、幼穗和抽穗期穗)中的相对表达量; C: OsDSK2b蛋白在水稻原生质体中的亚细胞定位(标尺为10 μm)。数据均为3个生物学重复的平均值(±标准差) (Dunnett’s test, *:< 0.05, **:< 0.01)
A: the relative expression levels ofbefore and after Guy11, 20% PEG-6000, 150 mmol L–1NaCl, and 100 μmol L–1ABA treatments. B: the relative expression levels ofin different tissues of Nipponbare (two-week-old seedlings, young roots, node, second leaf, flag leaves, root of booting stage, young panicle, and panicle of heading stage). C: the subcellular localization of OsDSK2b in rice protoplast (Bar: 10 μm). Values are means (± SDs) from three biological replicates (by Dunnett’s test, *:< 0.05, **:< 0.01).
2.3 敲除OsDSK2b增强水稻对稻瘟病的抗性
为了明确在水稻中的功能, 我们利用CRISPR-cas9技术敲除了野生型日本晴中的, 获得了26个T0代转基因株系, 最后挑选了3个纯合的转基因株系(、和)用于后续的表型鉴定。其中插入了碱基T,缺失碱基T,缺失碱基TAGTC (图2-A)。敲除植株与野生型植株无明显的表型差异。
为了鉴定在水稻抗病中的功能, 我们在野生型植株和敲除植株的分蘖盛期采用活体接种(打孔接种)的方法接种稻瘟病菌生理小种GD08-T13, 接种7d后测量其发病面积。结果表明,敲除植株比野生型植株对GD08-T13的抗性显著增强(< 0.01) (图2-B), 敲除株系的病斑面积约为0.05 cm2, 而野生型植株的病斑面积为0.24cm2(图2-C)。为进一步验证在水稻抗病中的作用, 我们又通过离体接种的方法在三叶期的水稻叶片上接种了稻瘟病菌生理小种Guy11。结果表明,敲除植株、和的叶片病斑面积(0.13、0.12和0.10 cm2)均显著小于野生型的叶片病斑面积(0.31 cm2) (图2-D, E)。综上所述, 敲除显著增强水稻的稻瘟病抗性。
2.4 OsDSK2b调控病程相关蛋白基因的表达
为了进一步探究调控水稻稻瘟病抗性的分子机制, 我们对野生型日本晴和敲除植株中的基因的表达量进行测定, 分析了8个基因(、、、、、、和)在稻瘟病菌Guy11侵染前后的表达模式。结果表明, 正常条件下敲除植株中和基因的表达水平显著高于野生型植株(图3)。病原菌侵染后, 野生型和敲除植株中、、、、和的转录均被诱导。侵染2d后, 敲除植株中、和的表达水平显著高于野生型植株, 而侵染4d后, 它们的表达水平在野生型和敲除植株中则无显著差异。侵染2d后,、和在敲除植株中的表达水平与野生型植株相比并无显著差异, 而侵染4d后, 它们在敲除植株中的表达水平显著高于野生型植株(图3)。综上所述, 敲除介导的水稻稻瘟病抗性增强很可能与基因的激活密切相关。
2.5 敲除OsDSK2b增强水稻对渗透胁迫的抗性
为了进一步探究在水稻渗透胁迫中的调控作用, 将野生型日本晴和敲除植株的三叶期幼苗, 置于含有20% PEG-6000的木村培养液中分别处理3d和5 d, 复水培养5 d后观察表型。20% PEG-6000处理前, 敲除植株与野生型生长情况基本一致。渗透胁迫处理3 d并复水培养5 d后, 野生型和敲除植株的叶片均出现了干枯和卷曲, 且敲除植株、和的绿色部分的株高(11.03、12.13和11.01 cm)显著高于野生型植株的株高(8.28 cm)(图4-A, B)。20% PEG-6000处理5 d并复水培养5 d后, 绝大多数的野生型植株已死亡, 而大多数的敲除植株仍存活, 敲除植株、和的存活率(62.5%、58.3%和74.0%)显著高于野生型植株的存活率(17.0%)(图4-C, D)。20% PEG-6000处理前后离子渗透率测定结果表明, 胁迫处理条件下, 野生型和敲除植株叶片的离子渗透率均出现了增加, 在处理后的24 h, 敲除植株、和叶片的离子渗透率分别为7.4%、7.6%和6.9%, 显著低于野生型植株叶片的离子渗透率(12.0%) (图4-E)。在处理后的48 h, 敲除植株、和叶片的离子渗透率(11.0%、10.2%和10.7%), 也显著低于野生型植株叶片的离子渗透率(18.0%) (图4-E)。
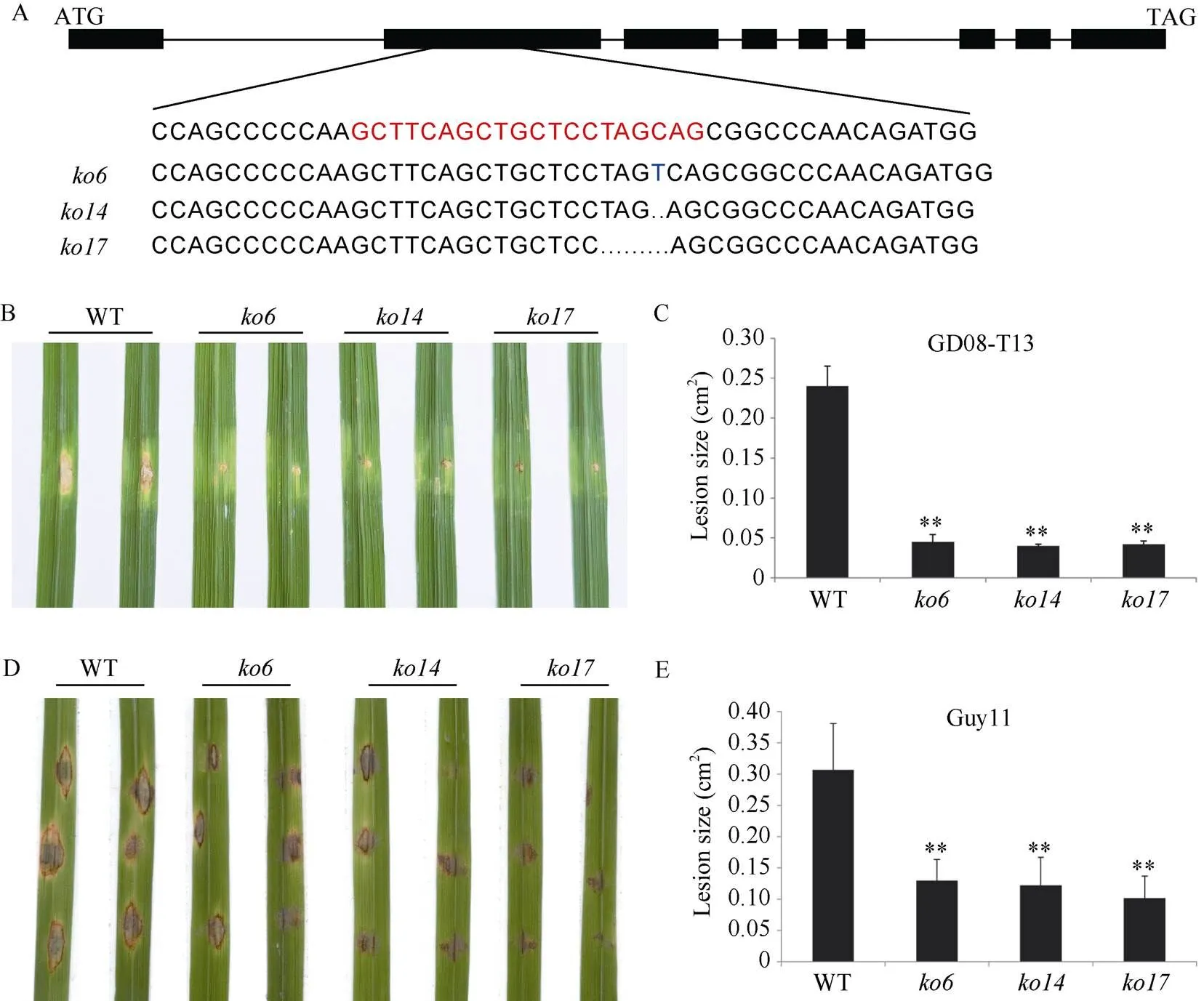
图2 敲除OsDSK2b增强水稻对稻瘟病的抗性
A:的结构和各敲除株系的靶序列突变情况。外显子和内含子分别用黑色矩形和黑线表示, 红色字体表示CRISPR载体构建的靶序列, 蓝色字体表示插入的碱基, 省略号表示缺失的碱基; B: 打孔接种GD08-T13菌株7 d后, 野生型日本晴和敲除株系的表型图; C: 打孔接种GD08-T13菌株7 d后,敲除株系和野生型日本晴的病斑面积统计图; D: 离体接种Guy11菌株7 d后, 野生型日本晴和敲除株系的表型图; E: 接种Guy11菌株7 d后,敲除株系和野生型日本晴的病斑面积统计图。数据为3个生物学重复的平均值(±标准差) (Dunnett’s测验, *:< 0.05, **:< 0.01)。
A:the gene structure ofand mutation of target sequence inknockout strains. Exon and intron are represented by the blank rectangle black line. Red font represents the target sequence in CRISPR vector construction, blue fonts represent the inserted bases, and ellipsis represent the missing bases; B: the phenotype of wild-type Nipponbare andknockout plants 7 d after inoculation with GD08-T13 using the punch method; C: the lesion sizes of wild-type Nipponbare andknockout plants 7 d after inoculation with GD08-T13 using the punch method; D: the phenotype of wild-type Nipponbareandknockout plants 7 d after inoculation with Guy11; E: The lesion sizes of wild-type Nipponbare andknockout plants 7 d after inoculation with Guy11. Values are means (± SDs) from three biological replicates (Dunnett’s test, *:< 0.05, **:< 0.01).
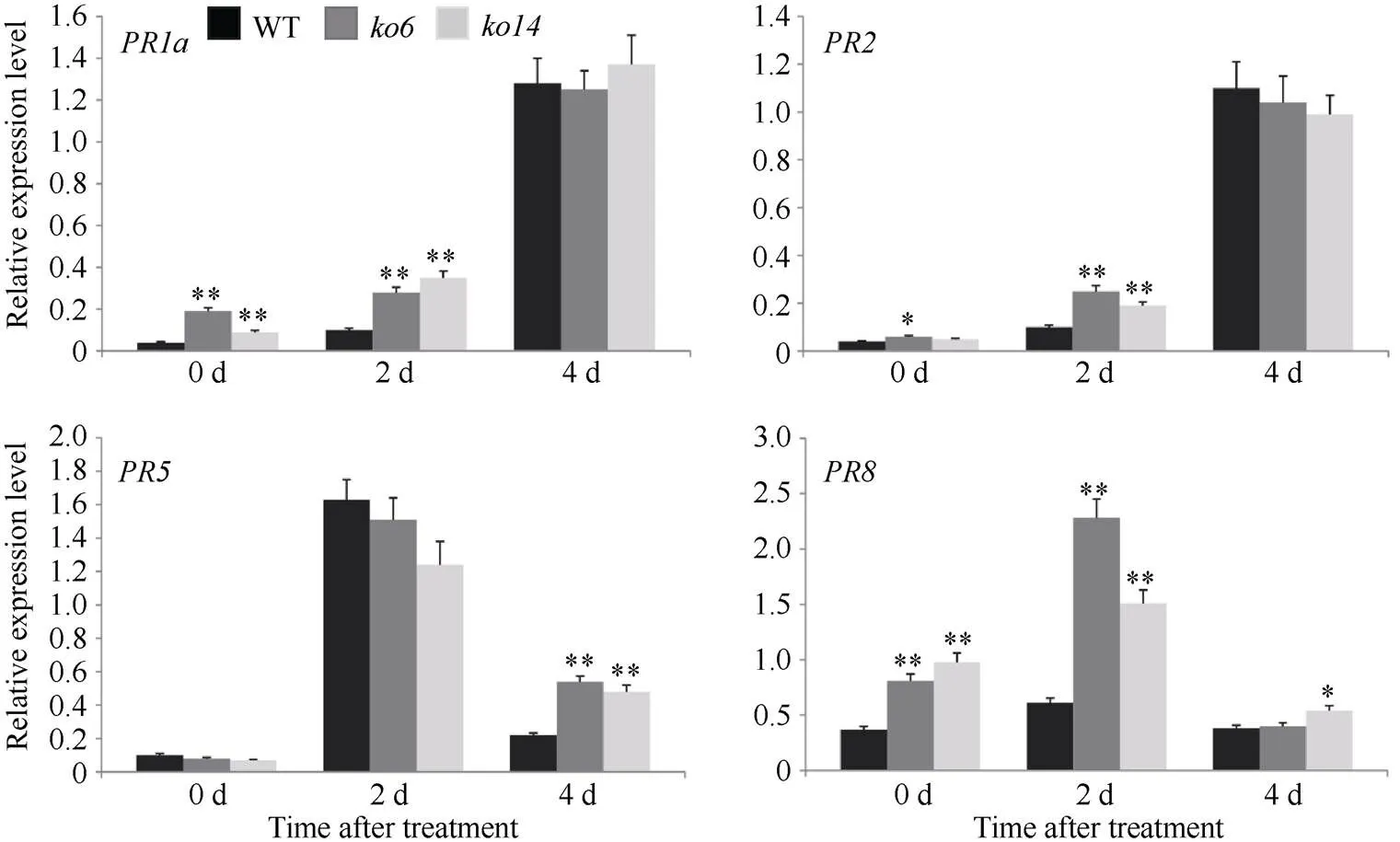
(图3)
稻瘟病菌Guy11接种前(0 h)和接种后(2 d和4 d), 野生型日本晴和敲除植株叶片中的基因的相对表达量。数据均为3个生物学重复的平均值(±标准差)(Dunnett’s测验, *:< 0.05; **:< 0.01)。
The relative expression levels ofgenes inleaves ofwild-type Nipponbareandknockout plants before (0 h) and after (2 d and 4 d) pathogen inoculation with Guy11. Values are means (± SDs) from three biological replicates (Dunnett’s test, *:< 0.05; **:< 0.01).
此外, 我们还对野生型和敲除植株地上部的离体失水率进行了测定, 结果显示在整个失水过程中, 3个敲除株系的失水率均明显低于野生型植株(图4-F)。已有研究表明植物的失水率与气孔密切相关[30]。为了明确敲除导致的渗透胁迫抗性增强是否与植株的气孔有关, 我们检测了野生型和敲除植株叶片上的气孔大小、气孔密度以及20% PEG-6000处理前后气孔的张开度。结果如图5-A所示, 一共发现了3种类型的气孔(全开、半开和全闭合)。正常条件下, 野生型气孔全开类型占比30.52%, 而敲除株系中气孔全开类型的比例为24.16%~ 26.25%。野生型气孔全闭合类型占比43.15%, 而敲除株系中气孔全闭合类型的比例为51.87%~54.08% (图5-B)。20% PEG-6000处理条件下, 野生型气孔全开类型占比10.29%, 而敲除株系中气孔全开类型的比例为2.32%~3.03%。野生型气孔全闭合类型占比44.52%, 而敲除株系中气孔全闭合类型的比例为65.15%~71.23% (图5-C)。野生型和敲除植株叶片上气孔的大小和密度均无显著差异(图5-D, E)。上述结果表明敲除能够促进气孔的闭合, 从而增强植株的渗透胁迫抗性。

(图4)
A: 20% PEG-6000处理前与处理3 d再复水生长5 d后, 野生型日本晴和敲除株系的表型图; B: 20% PEG-6000处理3 d再复水生长5 d后, 野生型日本晴和株高统计图; C: 20% PEG-6000处理前与处理5 d再复水生长5d后, 野生型日本晴和敲除株系的表型图; D: 20% PEG-6000处理5 d再复水生长5d后, 野生型日本晴和的存活率统计图; E: 20% PEG-6000处理前后, 野生型日本晴和的离子渗透率统计图; F: 野生型日本晴与敲除株系地上部在0、30、60、90、120、180、240和300 min的离体失水率统计图。数据均为3个生物学重复的平均值(±标准差) (Dunnett’s测验, *:< 0.05; **:< 0.01)。
A: the phenotype of wild-type Nipponbare andknockout plants under normal condition or 3 d 20% PEG-6000 treatment and 5 d recovery; B: the plant height of wild-type Nipponbare andknockout plants under normal condition or 3 d 20% PEG-6000 treatment and 5 d recovery; C: the phenotype of wild-type Nipponbare andknockout plants under normal condition or 5 d 20% PEG-6000 treatment and 5 d recovery; D: the survival rates of wild-type Nipponbare andknockout plants under normal condition or 5 d 20% PEG-6000 treatment and 5 d recovery; E: the ion leakage of wild-type Nipponbare andknockout plants before and after osmotic stress treatment; F: the water loss rates of seedlings ofwild-type Nipponbare andknockout plants at 0, 30, 60, 90, 120, 180, 240, and 300 min. Values are means (± SDs) of three biological replicates (Dunnett’s test, *:< 0.05; **:< 0.01).
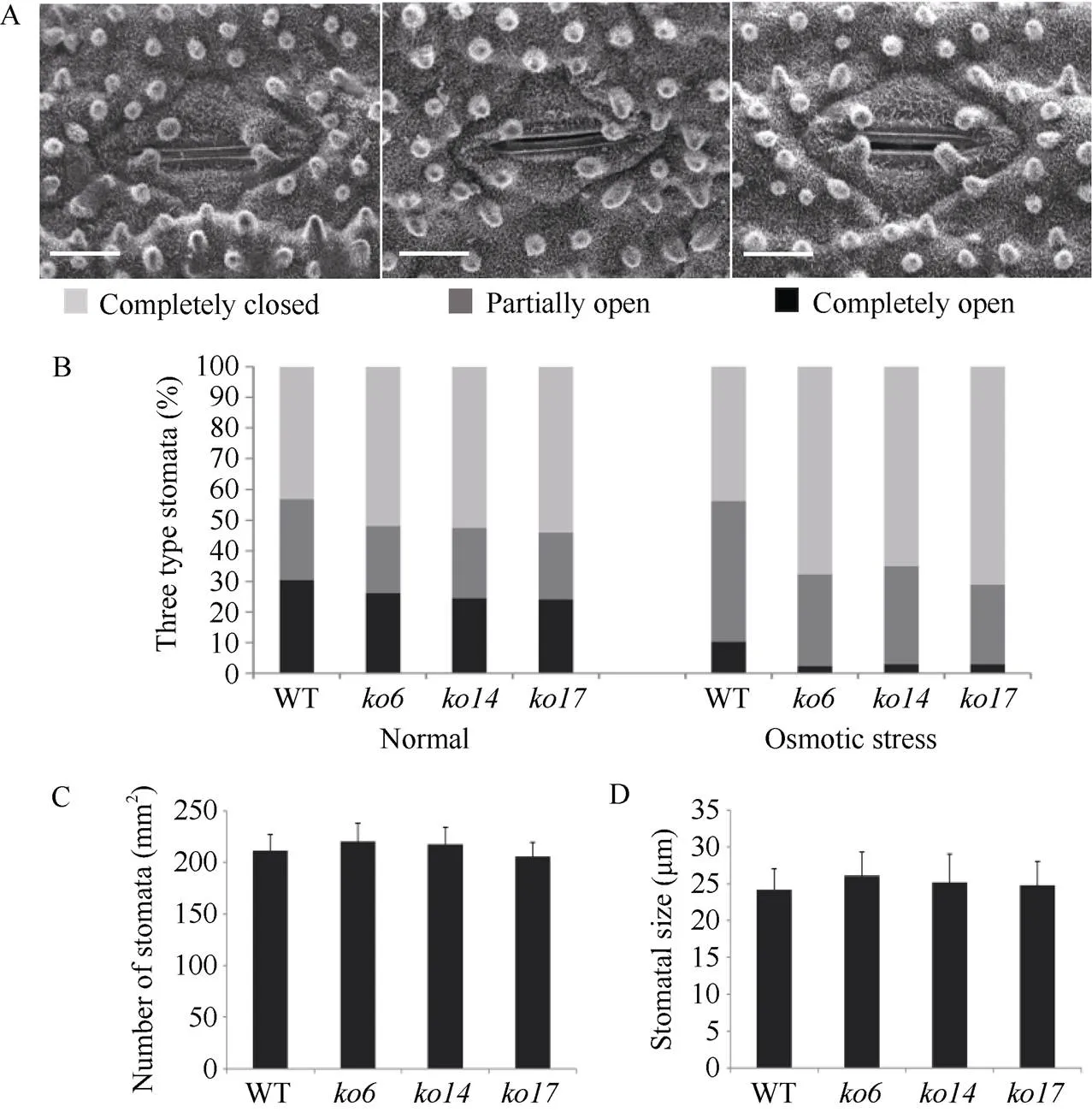
图5 敲除OsDSK2b降低气孔开度
A: 不同开放程度的气孔图。标尺为10 μm; B: 正常条件下和20% PEG-6000处理4 h后, 野生型日本晴和敲除株系中3种不同开放程度的气孔占比统计图。结果以3个生物学重复的平均值(±标准差)表示, 每个重复至少统计300个以上气孔; C: 野生型日本晴和敲除株系中气孔密度统计图; D: 野生型日本晴和敲除株系中气孔大小统计图。结果以3个生物学重复的平均值(±标准差)表示, 每个重复至少统计100个气孔。
A: the stomata with different opening degrees. Bar: 10 μm; B: the stomatal proportions of three different degrees of opening on the leaves of wild-type Nipponbare andknockout plants under normal condition and after 20% PEG-6000 treatment for 4 h. Values are means (± SDs) of three biological replicates, and at least 300 stomata were calculated in each replicate; C: the stomatal density of wild-type Nipponbare andknockout plants; D:the stomatal size of wild-type Nipponbare andknockout plants. Values are means (± SDs) of three biological replicates, and at least 100 stomata were calculated in each replicate.
2.6 OsDSK2b调控抗逆相关基因的表达
为了深入探究调控水稻渗透胁迫的分子机制, 在正常和20% PEG-6000处理条件下, 分析了野生型和敲除植株之间抗逆相关基因的表达水平。选取了4个与脱水胁迫密切相关的基因(、、和)、2个ABA合成基因(和)和4个ABA通路相关基因(、、和)进行分析。在正常条件下, 只有、和在敲除植株中的表达水平显著高于野生型。20% PEG-6000处理条件下, 上述10个基因的表达在野生型和敲除植株中均受到显著诱导, 且它们在敲除植株中的表达水平均显著高于野生型植株(图6)。结果表明在渗透胁迫条件下能够调控脱水胁迫相关基因以及ABA通路相关基因的表达。
2.7 OsDSK2b影响内源ABA的积累
ABA合成和通路相关基因的表达变化预示着很有可能可以调控内源ABA的水平。为了验证这一猜想, 我们利用LC-MS测定了野生型和敲除植株中在正常条件和20% PEG-6000处理后的ABA含量。结果表明, 在正常条件下, 野生型和敲除植株中的ABA含量并无明显差异。在20% PEG-6000处理后, 野生型和敲除植株的ABA含量均显著上升, 且敲除植株和中的内源ABA含量(314.2 ng g–1和344.4 ng g–1)显著高于野生型植株的内源ABA含量(206.8 ng g–1) (图7)。这表明敲除能够影响胁迫条件下植株体内ABA的积累。

(图6)
A: 20% PEG-6000处理前(0 h)和处理后(4 h)野生型日本晴和敲除株系中基因的相对表达量; B: 20% PEG-6000处理前(0 h)和处理后(4 h)野生型日本晴和敲除株系中ABA信号通路相关基因的相对表达量。数据均为3个生物学重复的平均值(±标准差) (Dunnett’s测验, *:< 0.05; **:< 0.01)。
A: the relative expression levels ofgenes in wild-type Nipponbare andknockout plants before (0 h) and after (4 h) 20% PEG-6000 treatment; B: the relative expression levels of ABA-related genes in wild-type Nipponbare andknockout plants before (0 h) and after (4 h) 20% PEG-6000 treatment. Values are means (± SDs) from three biological replicates (Dunnett’s test, *< 0.05; **< 0.01).
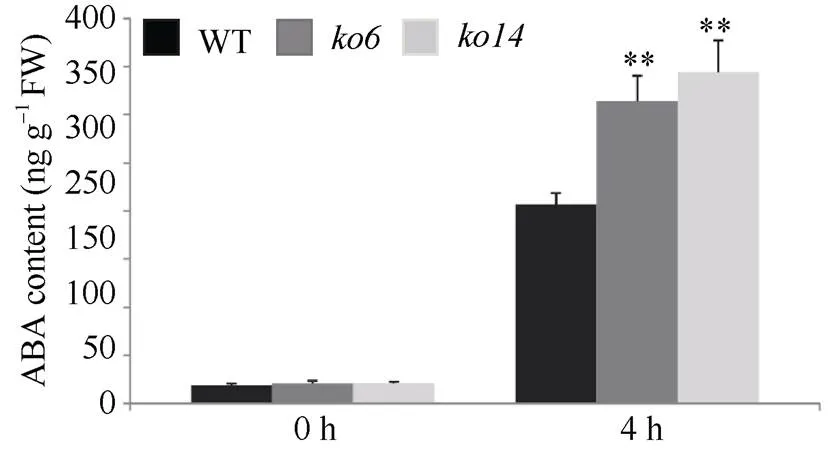
图7 OsDSK2b影响20% PEG-6000处理下水稻内源ABA的积累
数据均为6个生物学重复的平均值(±标准差)(Dunnett’s测验, *:< 0.05; **:< 0.01)。
Values are means (± SDs) from six biological replicates (Dunnett’s test, *:< 0.05; **:< 0.01).
3 讨论
DSK2是一类可以将泛素化底物转运到蛋白酶体进行降解的泛素受体蛋白, 对生物体生长发育、耐热、耐盐等起着重要作用[6-7,10]。本研究发现野生型株系受到稻瘟病菌的侵染后,表达量显著下调,敲除株系对稻瘟病的抗性显著强于野生型株系, 这说明能负向调控水稻对稻瘟病的抗性。进一步研究发现, 受到稻瘟病侵染后,敲除株系中的部分基因比野生型株系上调程度显著更大, 说明对水稻稻瘟病抗性的影响与基因的差异表达有关。植株受到稻瘟病胁迫后,的下调表达能提高部分基因的转录水平, 进而增强植株对稻瘟病的抗性。不同类型基因的抗病机制有所不同[14-18]。本研究也发现不同基因在敲除株系稻瘟病菌侵染后有不同的响应模式。更值得注意的是, 在稻瘟病菌接种前,敲除株系中的和基因的表达量显著高于野生型株系。已有研究表明,表达量的变化会影响水稻对白叶枯病的抗性[31-33]。这预示着可能也影响着水稻对白叶枯的抗性。
本研究还发现敲除能增强植株的20% PEG-6000处理后的渗透胁迫抗性。进一步研究发现, 20% PEG-6000处理后, 4个脱水胁迫密切相关的基因(、、和)、2个ABA合成基因(和)和4个ABA通路相关基因(、、和)的表达在野生型和敲除植株中均受到显著诱导, 且它们在敲除植株中的表达水平均显著高于野生型植株。众所周知, 植物对逆境的应答主要分为ABA依赖和ABA非依赖型的信号传导途径[34]。转录因子DREB通过ABA非依赖途径被激活后, 会特异结合启动子的DRE/CRT顺式作用元件并调控耐逆相关基因的表达, 过表达等基因有利于增强植物的耐逆性[21,35]。20% PEG-6000处理后,敲除植株中基因的表达水平均显著高于野生型植株, 可能赋予了敲除植株更强的渗透胁迫抗性。已有研究表明, 内源ABA浓度能够影响植物气孔的开闭[36]。在水分胁迫下, 植物内源ABA含量增加, 导致气孔关闭, 最终减少了由于蒸腾作用带来的水分损失[36]。本研究中, 我们也发现敲除会影响植株的气孔开闭度,渗透胁迫下,敲除植株中的气孔开放程度显著低于野生型植株。内源ABA的定量结果显示, 渗透胁迫下,敲除植株中的内源ABA含量显著高于野生型植株, 这刚好与敲除植株中拥有更多闭合气孔的结果是相吻合的。综上所述, 敲除导致的渗透胁迫抗性增强与ABA依赖和ABA非依赖型的信号均密切相关。
是的同源基因。Wang等[7]研究发现, 正常条件下,敲除株系的株高显著低于野生型株系, 盐胁迫条件下,敲除株系的存活率显著高于野生型株系。进一步研究发现, OsDSK2a通过与EUI (ELONGATED UPPERMOST INTERNODE)相互作用来调节GA分解代谢, 进而影响水稻幼苗的生长发育及其对盐胁迫的抗性[7]。在正常条件下, OsDSK2a介导EUI的降解以维持植物正常生长。在盐胁迫条件下, OsDSK2a表达水平降低, 从而释放EUI蛋白, 使植株GA水平降低, 通过抑制植物生长速度来提高植株存活率[7]。本研究发现与一样, 在水稻的各个组织部位都有表达。但是, 正常条件下,敲除株系与野生型株系在表型上无显著差异。而Kaur等[11]在拟南芥中通过microRNA降低基因的表达量, 对植株的生长也无明显影响。这说明具有与不一样的生物学功能,参与水稻响应逆境胁迫的分子机制也可能不同于, 具体机制需要进一步探究。
4 结论
本研究证明了负向调控水稻的稻瘟病抗性和渗透胁迫抗性。初步证明通过影响基因的表达, 调控水稻的稻瘟病抗性。通过ABA信号依赖和ABA非依赖通路途径, 调控水稻的渗透胁迫抗性。本研究还发现参与水稻响应逆境胁迫的分子机制不同于它的同源基因, OsDSK2b与相关蛋白的互作机理仍有待探究。此外, 本研究结果预示可能还参与调控水稻的白叶枯抗性。具有功能多效性, 深入探究它在水稻逆境胁迫下功能及其调控的分子机制, 将为培育强耐逆性和高抗病性的水稻品种奠定理论基础。
[1] 王亦栖, 余炳伟, 颜爽爽, 邱正坤, 陈长明, 雷建军, 田时炳, 曹必好. 植物泛素基因研究进展. 中国农学通报, 2020, 36(20): 14–22. Wang Y Q, Yu B W, Yan S S, Qiu Z K, Chen C M, Tian S B, Cao B H. Advances in research on plant ubiquitin genes., 2020, 36(20): 14–22 (in Chinese with English abstract).
[2] 盛仙永. 泛素/蛋白酶体途径在青扦花粉萌发及花粉管生长过程中的作用. 西北大学博士学位论文, 陕西西安, 2006. Sheng X Y. Roles of the Ubiquitin/Proteasome Pathway inPollen Germination and Tube Growth. PhD Dissertation of Northwest University, Xi’an, Shaanxi, China, 2006 (in Chinese with English abstract).
[3] Ko J H, Yang S H, Han K H. Upregulation of anRING-H2 gene,, confers drought tolerance through increased abscisic acid biosynthesis., 2006, 47: 343–355.
[4] Xie D X, Feys B F, James S, Nieto-Rostro M, Turner J G.: angene required for jasmonate-regulated defense and fertility., 1998, 280: 1091–1094.
[5] Fu H, Lin Y L, Fatimababy A S. Proteasomal recognition of ubiquitylated substrates., 2010, 15: 375–386.
[6] Zhang H, Yang X, Ying Z, Liu J, Liu Q.UBL-UBA shuttle protein DSK2s are important for parasite intracellular replication., 2021, 22: 7943.
[7] Wang J, Qin H, Zhou S, Wei P C, Zhang H W, Zhou Y, Miao Y C, Huang R F. The ubiquitin-binding protein OsDSK2a mediates seedling growth and salt responses by regulating gibberellin metabolism in rice., 2020, 32: 414–428.
[8] Fatimababy A S, Lin Y L, Usharani R, Radjacommare R, Wang H T, Tsai H L, Lee Y, Fu H. Cross-species divergence of the major recognition pathways of ubiquitylated substrates for ubiquitin/26S proteasome-mediated proteolysis., 2010, 277: 796–816.
[9] Díaz-Martínez L A, Kang Y, Walters K J, Clarke D J. Yeast UBL-UBA proteins have partially redundant functions in cell cycle control., 2006, 1: 28.
[10] Wang D Y, Lv C, Guan Y, Ni X Y, Wu F Z, Dsk2 involves in conidiation, multi-stress tolerance and thermal adaptation in., 2021, 13: 384–393.
[11] Kaur N, Zhao Q Z, Xie Q, Hu J P.RING peroxins are E3 ubiquitin ligases that interact with two homologous ubiquitin receptor proteins., 2013, 55: 108–120.
[12] 汪文娟, 苏菁, 陈深, 杨健源, 陈凯玲, 冯爱卿, 汪聪颖, 封金奇, 陈炳, 朱小源. 广东省侵染美香占2号的稻瘟病菌致病性及无毒基因变异分析. 中国农业科学, 2022, 55: 1346–1358. Wang E J, Su J, Chen S, Yang J Y, Chen K L, Feng A Q, Wang C Y, Feng J Q, Chen B, Zhu X Y. Pathogenicity and avirulence genes variation offrom a rice variety Meixiangzhan 2 in Guangdong province., 2022, 55: 1346–1358 (in Chinese with English abstract).
[13] Muthukrishnan S, Liang G H, Trick H N, Gill B S. Pathogenesis-related proteins and their genes in cereals., 2001, 64: 93–114.
[14] Alexander D, Goodman R M, Gut-Rella M, Glascock C, Weymann K, Friedrich L, Maddox D, Ahl-Goy P, Luntz T, Ward E. Increased tolerance to two oomycete pathogens in transgenic tobacco expressing pathogenesis-related protein 1a., 1993, 90: 7327–7331.
[15] Kauffmann S, Legrand M, Geoffroy P, Fritig B. Biological function of ‘pathogenesis-related’ proteins: four PR proteins of tobacco have 1,3-β-glucanase activity., 1987, 6: 3209–3212.
[16] Datta K, Velazhahan R, Oliva N, Ona I, Mew T, Khush G S, Muthukrishnan S, Datta S K. Over-expression of the cloned rice thaumatin-like protein (PR-5) gene in transgenic rice plants enhances environmental friendly resistance tocausing sheath blight disease., 1999, 98: 1138–1145.
[17] Park C H, Kim S, Park J Y, Ahn I P, Jwa N S, Im K H, Lee Y H. Molecular characterization of a pathogenesis-related protein 8 gene encoding a class III chitinase in rice., 2004, 17: 144–150.
[18] Midoh N, Iwata M. Cloning and characterization of a probenazole-inducible gene for an intracellular pathogenesis-related protein in rice., 1996, 37: 9–18.
[19] 侯明明. 病程相关蛋白质在水稻发育及与白叶枯病菌互作过程中的表达研究. 河北农业大学硕士论文, 河北保定, 2011. Hou M M. Characteristic Expression of Pathogenesis-related Proteins in Rice Development and Interaction withpv.. MS Thesis of Hebei Agricultural University, Baoding, Hebei, China, 2011 (in Chinese with English abstract).
[20] 郑家国, 任光俊, 陆贤军, 姜心禄. 花后水分亏缺对水稻产量和品质的影响. 中国水稻科学, 2003, 17: 239–243. Zheng J G, Ren G J, Lu X J, Jiang X L. Effects of water stress on rice grain yield and quality after heading stage., 2003, 17: 239–243 (in Chinese with English abstract).
[21] 王平荣, 邓晓建, 高晓玲, 陈静, 万佳, 姜华, 徐正君. DREB 转录因子研究进展. 遗传, 2006, 28: 369–374. Wang P R, Deng X J, Guo X L, Chen J, Wang J, Jiang H, Xu Z J. Progress in the study on DREB transcription factor.(Beijing), 2006, 28: 369–374 (in Chinese with English abstract).
[22] Liu Q, Yan S J, Huang W J, Yang J Y, Dong J F, Zhang S H, Zhao J L, Yang T F, Mao X X, Zhu X Y, Liu B, 2018b, NAC transcription factor ONAC066 positively regulates disease resistance by suppressing the ABA signaling pathway in rice., 98: 289–302.
[23] 王彬, 陈敏氡, 林亮, 叶新如, 朱海生, 温庆放. 植物干旱胁迫的信号通路及相关转录因子研究进展, 西北植物学报, 2020, 40: 792–1806. Wang B, Chen M D, Lin L, Ye X R, Zhu H S, Wen Q F. Signal plant pathways and related transcription factors of drought stress in plants,, 2020, 40: 1792–1806 (in Chinese with English abstract).
[24] Xie X R, Ma X L, Zhu Q L, Zeng D C, Li G S, Liu Y G. CRISPR-GE: a convenient software toolkit for CRISPR-based genome editing., 2017, 10: 1246–1249.
[25] 曾栋昌, 马兴亮, 谢先荣, 祝钦泷, 刘耀光. 植物CRISPR/ Cas9多基因编辑载体构建和突变分析的操作方法. 中国科学: 生命科学, 2018, 48: 783–794. Zeng D C, Ma X L, Xie X R, Zhu Q L, Liu Y G. A protocol for CRISPR/Cas9-based multi-gene editing and sequence decoding of mutant sites in plants.(Vitae), 2018, 48: 783–794 (in Chinese with English abstract).
[26] Zhang Y, Su J B, Duan S, Ao Y, Dai J R, Liu J, Wang P, Li Y G, Liu B, Feng D R, Wang J F, Wang H B. A highly efficient rice green tissue protoplast system for transient gene expression and studying light/chloroplast-related processes., 2011, 7: 30.
[27] Ding B, Bellizzi M D R, Ning Y S, Meyers B C, Wang G L. HDT701, a histone H4 deacetylase, negatively regulates plant innate immunity by modulating histone H4 acetylation of defense-related genes in rice., 2012, 24: 3783–3794.
[28] Pan X Q, Welti R, Wang X M. Quantitative analysis of major plant hormones in crude plant extracts by high-performance liquid chromatography-mass spectrometry., 2010, 5: 986–992.
[29] Hui W K, Wang Y, Yan S J, Shi J F, Huang W J, Zayed M Z, Peng C C, Chen X Y, Wu G J. Simultaneous analysis of endogenous plant growth substances during floral sex differentiation inL. using HPLC-ESI-MS/MS.(Amsterdam), 2018, 241: 209–217.
[30] Zhao J H, Zhang W, Da S J, Liu X C, Duan J. Rice histone deacetylase HDA704 positively regulates drought and salt tolerance by controlling stomatal aperture and density., 2021, 254: 79.
[31] Park C J, Han S W, Chen X, Ronald P C. Elucidation of- mediated innate immunity., 2010, 12: 1017–1025.
[32] Son S, An H K, Seol Y J, Park S R, Im J H. Rice transcription factordirectly regulates the expression ofand chitinase to enhance resistance againstpv., 2020, 533: 1262–1268.
[33] Wang G N, Ding X H, Yuan M, Qiu D Y, Li X H, Xu C G, Wang S P. Dual function of ricegene in disease resistance and thiamine accumulation., 2006, 60: 437–449.
[34] 赵慧. 水稻耐旱性调控网络关键调节基因的克隆及的功能研究. 华中农业大学硕士学位论文, 湖北武汉, 2020. Zhao H. Cloning of Key Regulatory Genes in Rice Drought Tolerance Regulatory Network and Functional Study of. MS Thesis of Huazhong Agricultural University, Wuhan, Hubei, China, 2020 (in Chinese with English abstract).
[35] Lata C, Prasad M. Role of DREBs in regulation of abiotic stress responses in plants., 2011, 62: 4731–4748.
[36] Assmann S M, Wang X Q. From milliseconds to millions of years: guard cells and environmental responses., 2001, 4: 421–428.
Ubiquitin receptor protein OsDSK2b plays a negative role in rice leaf blast resistance and osmotic stress tolerance
DING Jie-Rong1,**, MA Ya-Mei1,**, PAN Fa-Zhi2, JIANG Li-Qun1, SUN Bing-Rui1, ZHANG Jing1, LYU Shu-Wei1, MAO Xing-Xue1, YU Hang1, LI Chen1,*, and LIU Qing1,*
1Rice Research Institute, Guangdong Academy of Agricultural Sciences / Guangdong Key Laboratory of New Technology in Rice Breeding / Guangdong Rice Engineering Laboratory, Guangzhou 510640, Guangdong, China;2South China Agricultural University, Guangzhou 510642, Guangdong, China;3Agro-biological Gene Research Center, Guangdong Academy of Agricultural Sciences / Guangdong Key Laboratory for Crop Germplasm Resources Preservation and Utilization, Guangzhou 510640, Guangdong, China
The ubiquitin receptor protein DSK2 (dominant suppressor of KAR2) plays an important role in the growth, development, and stress tolerance in plant, but its role in rice disease resistance and osmotic stress has not been reported yet. In this study, we identified thatwas regulated by various stresses, and the relative expression level of this gene decreased significantlyafterinfection and 20% PEG-6000 treatment. The spatio-temporal expression analysis showed that the relative expression level ofwas highest at three-leaf seedlingstage. The subcellular localization analysis demonstrated that OsDSK2b was localized in the cytoplasm in rice protoplast. The lesion area ofknockout plants was about 0.05 cm2and 0.10–0.13 cm2, which was much smaller than wild-type plants (0.24 cm2and 0.31 cm2) after inoculation with(GD08-T13 and Guy11). Compared with wild-type plants, knockout ofsignificantly enhancedthe leaf blast resistance in rice, and the relative expression levels of pathogenesis-related protein () genes were induced significantlyinknockout plants after(Guy11) infection. The knockout ofalso significantly enhanced the osmotic stress tolerance in rice.knockout plants had higher survival rate (58.3%–74.0%) than wild-type plants (17.0%) after 20% PEG-6000 treatment. Meanwhile, compared with wild-type plants,knockout plants had lower ion permeability and water loss rate after 20% PEG-6000 treatment. Scanning microscopy revealed that knockout ofcould promote the stomatal closure both before and after 20% PEG-6000 treatment, and the promotion effect was stronger after osmotic stress treatment. In addition, qRT-PCR results showed that the relative expression level ofgenes and abscisic acid (ABA) synthesis or pathway-related genes were significantly higher inknockout plants than wild-type plants after osmotic stress treatment.The endogenous ABA contents ofandknockout plants were 314.2 ng g–1and 344.4 ng g–1, respectively, which were significantly higher thanwild-type plants (206.8 ng g–1). These results indicated thatcould regulate rice osmotic stress through both the ABA-dependent and ABA-independent pathways. This study provides a new candidate gene for the breeding of rice resistant varieties by analyzing the regulatory role ofin rice coping with biotic and abiotic stresses.
rice (L.); rice blast; osmitic stress; PR; DREB; ABA
10.3724/SP.J.1006.2023.22039
本研究由广东省发展和改革委、农业农村厅投资项目(粤发改农经[2021]272号), 科技创新战略专项资金: 广东省农业科学院高水平人才建设项目(R2020PY-JX001)和广东省重点实验室运行费专项(2020B1212060047)资助。
This study was supported by the Investment Project of Department of Agriculture and Rural Affairs, Development and Reform Commission, Guangdong province (Yue Fa Gai Nong Jing [2021]272), the Special Fund for Scientific Innovation Strategy-Construction of High Level Academy of Agriculture Science (R2020PY-JX001), and the Guangdong Key Laboratory of New Technology in Rice Breeding (2020B1212060047).
刘清, E-mail: liuqing198504@126.com; 李晨, E-mail: 2369538973@qq.com
**同等贡献(Contributed equally to this work)
丁杰荣, E-mail: jierongdjr@163.com; 马雅美, E-mail: mayamei@gdaas.cn
2022-06-22;
2022-11-25;
2022-12-07.
URL: https://kns.cnki.net/kcms/detail//11.1809.S.20221206.1614.006.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

