铜胁迫下的西瓜食酸菌转录组分析
宋金迪,刘 君,孙玉芳,优丽图孜·乃比,陈宝强,颉兵兵
(新疆农业大学生命科学学院,乌鲁木齐 830052)
0 引 言
【研究意义】细菌性果斑病(Bacterial fruit blotch,简称BFB)在葫芦科植物各个部位均可发病,如子叶、果实等,发病的果实表皮产生水浸斑,内部果肉腐烂且种子会带菌[1]。细菌性果斑病给一些商品西瓜地造成的损失可达50%甚至90%以上[2]。细菌性果斑病的病原菌-西瓜食酸菌,种群内存在铜抗性的菌株,导致生产中以铜制剂为主的杀菌剂对细菌性果斑病防控基本无效[3]。解析病菌的抗铜分子机制,对发掘防控病菌的新方法、新途径有重要意义。【前人研究进展】目前已报道的抗铜相关基因为:编码P型ATP酶的copA,在西瓜食酸菌亚群I和亚群II菌株中均存在,其缺失可导致菌株在一定铜浓度下不能生长[4];多铜氧化酶基因cueO,其突变菌株对硫酸铜敏感性增强[5];类cueR与类cusB,在研究组前期工作中发现,分别与大肠杆菌(Escherichiacoli)的Cue和Cus抗铜系统组分同源[6,7],对该菌的抗铜性有重要贡献。【本研究切入点】对西瓜食酸菌的铜抗性机制认知至今较少,高通量测序技术是研究基因表达模式的有力工具。通过转录组学数据预测西瓜食酸菌响应胁迫的相关代谢途径、通路,需研究铜胁迫下病菌反馈机制。【拟解决的关键问题】采用RNA-Seq技术,比较不同铜培养条件下西瓜食酸菌FC440菌株转录组水平上基因表达的差异,解析细菌响应铜胁迫相关的路径和特征,为分析该菌抗铜机制的相关研究提供参考依据。
1 材料与方法
1.1 菌 株
西瓜食酸菌FC440菌株分离自感病甜瓜(CucumismeloL.),由南京农业大学胡白石教授惠赠,参考用基因组为西瓜食酸菌AAC00-1菌株(GenBank No.NC_008752.1)。
1.2 方 法
1.2.1 样品收集
将保存的甘油菌在含30 μg/mL Amp及1.25 mmol/L Cu2+的KMB(King’s Medium B)培养基上活化,28℃培养48 h。挑取单菌落分别接种于含30 μg/mL及含有0.625 mmol/L Cu2+(该处理组标注为T)或者含0 mmol/LCu2+(此对照组标注为CK)的NB(nutrient broth)培养基中,于220 r/min、28℃过夜培养至饱和菌液,再以1∶10进一步扩大培养至OD600值达0.5~0.8,将上述菌液于4℃、10 000 r/min离心后收集菌体并置于液氮保存备用。处理组(T)与对照组(CK)的样本均设置3个重复。
1.2.2 RNA提取和转录组测序
菌体样本总RNA提取,采用Trizol裂解法进行RNA提取,提取后的总RNA通过凝胶电泳检测其完整性以及是否受到基因组污染,采用超微量分光光度仪(Titertek-Berthold Colibri)检测RNA浓度。检测合格后送至南京派森诺基因科技有限公司对总RNA纯化后构建文库,并利用Illumina高通量测序平台HiSeq2000对文库进行双末端测序(Paired-End, PE)测序。
1.2.3 转录组数据处理
对每个样本的Raw Data数据分别进行Reads数、碱基量、Q30(即质量值大于或等于Q30的碱基所占的百分比)、模糊碱基所占百分比、以及Q20(%)和Q30(%)统计。将测序中包含的一些带接头、低质量的Reads采用Cutadapt(Version 1.2.1)[8]去除3'端的接头,平均质量分数不低于Q20,采用FastQC(http://www.bioinformatics.babraham.ac.uk/projects/fastqc)分析碱基质量。使用序列比对软件Bowtie2[9]对筛选后的高质量数据(http://bowtie-bio.sourceforge.net/index.shtml)与参考基因组比对,再组装合并得到完整基因并通过KEGG、GO等数据库进行基因信息比对注释。
1.2.4 差异基因表达及富集
FPKM(Fragments Per Kilobase Million)值作为基因转录水平的一个依据,衡量每个基因在样品中的表达量[10]。不同处理样本的mRNA转录本的表达量通过FPKM计算,使用R语言计算相关系数,再以相关系数观察不同处理样本的可重复性。使用HTSeq 0.6.1p2(http://www-huber.embl.de/users/anders/HTSeq)统计比对到每一个基因上Read Count值作为基因的原始表达量,将该数值采用DESeq(version 1.18.0)对基因表达进行差异分析,筛选差异表达基因,按照表达倍数差异log2|fold change|>1,显著性P<0.05进行筛选差异表达基因,计算出上下调基因数量。所有分组的差异表达基因,使用R语言Pheatmap软件包对基因和样品进行双向聚类分析。采用Euclidean方法计算距离,层次聚类最长距离法(Complete Linkage)进行聚类。采用R语言 ggplots2 软件包绘制火山图和 MA 图,MA 图用于评估文库标准化程度[11]。
1.2.5 转录组数据的qPCR验证
随机选取15个基因进行qPCR以验证所得转录组数据的可靠程度。使用primer 5设计引物,以不同处理的菌体提取的RNA经反转录获得的cDNA为样本,qPCR反应体系(20 μL):cDNA模板100 ng,正反向引物(10 μM)各0.4 μL,2×TransStartGreen qPCR SuperMix 10 μL,Passive Reference Dye(50×)(optional)0.4 μL,Nuclease-free Water 8.8 μL。采用两步法进行qPCR,反应条件为:94 °C,5 s;60 °C,30 s共45个循环。采用2^(-ΔΔCt)法(Livak法)计算相对表达量,比对Log2FoldChange值与-ΔΔCt值的整体变化趋势验证转录组测序结果的准确性。表1
2 结果与分析
2.1 铜胁迫处理下FC440菌株转录本碱基质量
2.1.1 碱基质量
研究表明,共得到26.3 Gb Clean Data,各个样品的Q30碱基百分比均不小于91.82%,Clean Data中N的比例均小于0.5%,碱基质量较好。Clean Data中GC含量(即 Clean Data中G和C两种碱基占总碱基的百分比)在64.33%~64.58%,该菌具有高的GC含量。表2
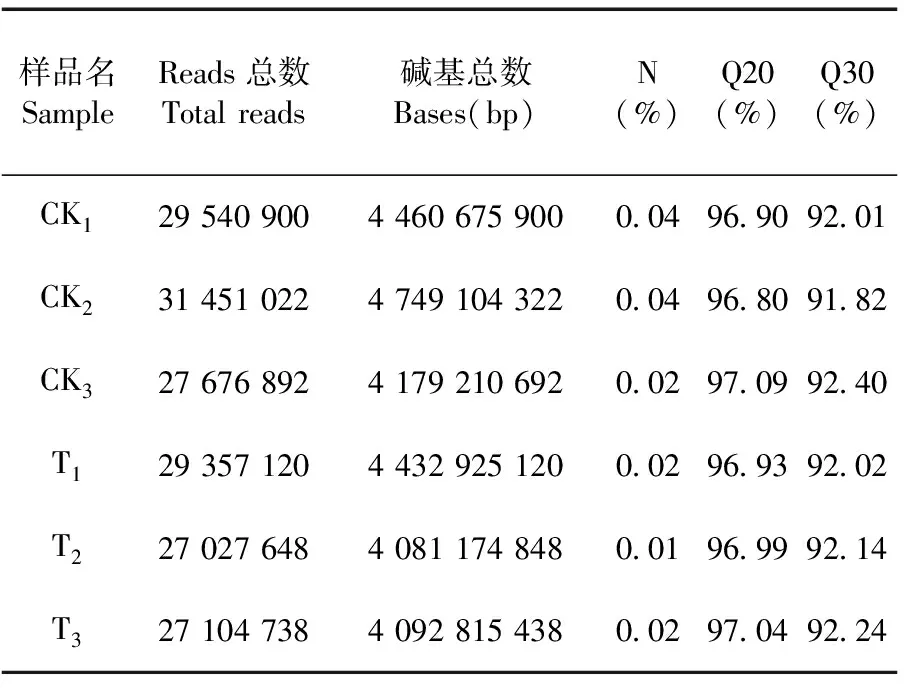
表2 铜胁迫处理下FC440菌株 转录本的碱基质量统计Table 2 Base mass statistics of the transcript of Acidovorax citrulliFC440 under copper stress
2.1.2 参考基因组比对
研究表明,对照组和处理组样品间有99.55%以上的单映射比对率,而多映射读取比例在3.68%以下,单映射比对率高,测序数据质量较好、可信度高。表3
2.2 基因表达及富集
2.2.1 样品相关性检验
研究表明,T1和T2和T3、CK1和CK2和CK3之间r2大于0.9,样本的相关性较强。T1和T2和T3均位于PC1的10附近,CK1和CK2和CK3均位于PC1的-10附近,样本内离散度低,而CK和T位于PC1的两端离散度高,差异显著。样本的重复性好。图1~2
2.2.2 聚类分析
研究表明,同一处理各样本的基因在图中的颜色呈现基本一致,基因表达模式相同,同组样本每列的颜色显示基本一致,基因表达水平相似且样本的重复性好。图3
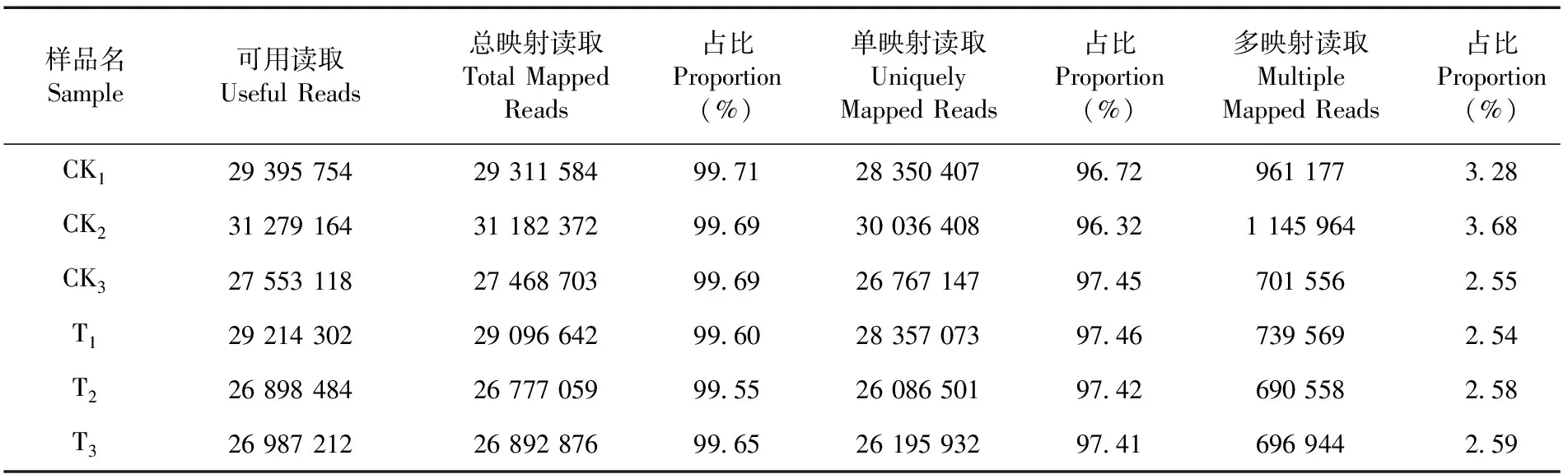
表3 FC440菌株的参考基因组比对统计Table 3 Reference genome comparison of Acidovorax citrulliFC440
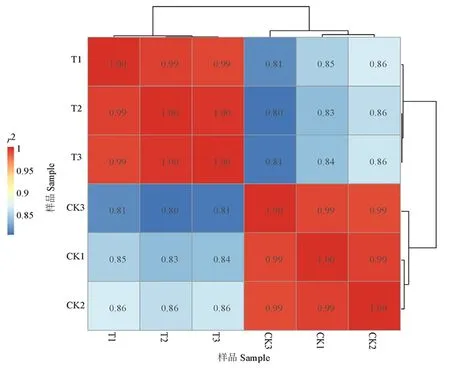
图1 FC440菌株铜胁迫处理下的相关性检验
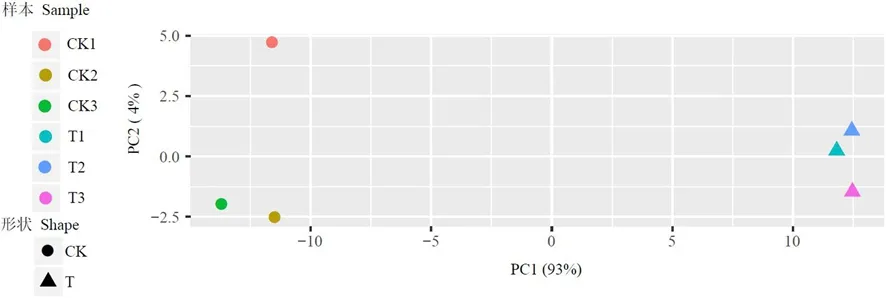
图2 FC440菌株铜胁迫处理下的PCA变化
2.3 差异基因统计
研究表明,铜胁迫下,西瓜食酸菌4 344个表达基因中差异表达的有466个,其中上调表达的和下调表达的分别为266个(占57%)和200个(占43%)。文库标准化后基因的表达量呈上下对称分布,表达差异趋势不随基因表达量变化而发生偏向,文库标准化程度较好。表达差异的基因整体分布对称。图4~5
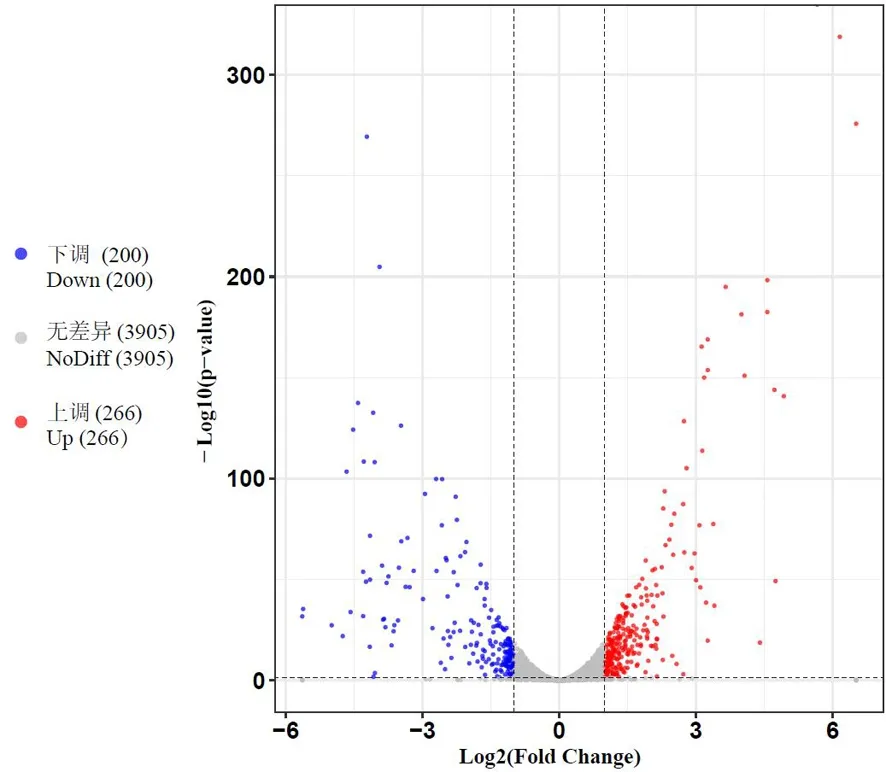
图5 FC440菌株铜胁迫处理组下的差异表达基因火山图
2.3.1 差异表达基因的GO功能注释
研究表明,获得253个GO条目,富集于329个差异表达的基因,这些基因的占比分别对应于: 28.3%的生物过程中的代谢过程(metabolic process),18.5%的氧化还原过程(oxidation-reduction process), 19.5%的分子功能中的催化活性(catalytic activity),13.4%的绑定(binding), 14%的细胞组分中膜(membrane)。
上调表达差异极显著的基因(上调表达量超过8倍且P-value<0.01)归类于:生物过程的转运(transport)、跨膜转运(transmembrane transport)、定位(localization)、定位的组建(establishment of localization);分子功能的催化活性(catalytic activity)、绑定、水解酶活性(hydrolase activity)、辅因子(cofactor binding)等,其中催化活性和绑定相关的基因数量最多。下调表达差异极显著的基因(下调表达量超过8倍且P-value<0.01)归类于:生物过程的氧化还原过程、代谢过程;分子功能绑定、阳离子绑定(cation binding)、金属离子绑定(metal ion binding)等。表达差异极显著的基因中,生物过程相关基因数量多、分布广,分子功能绑定相关的基因数量最多,细胞组分的膜、膜组分基因数量相对较少。图6
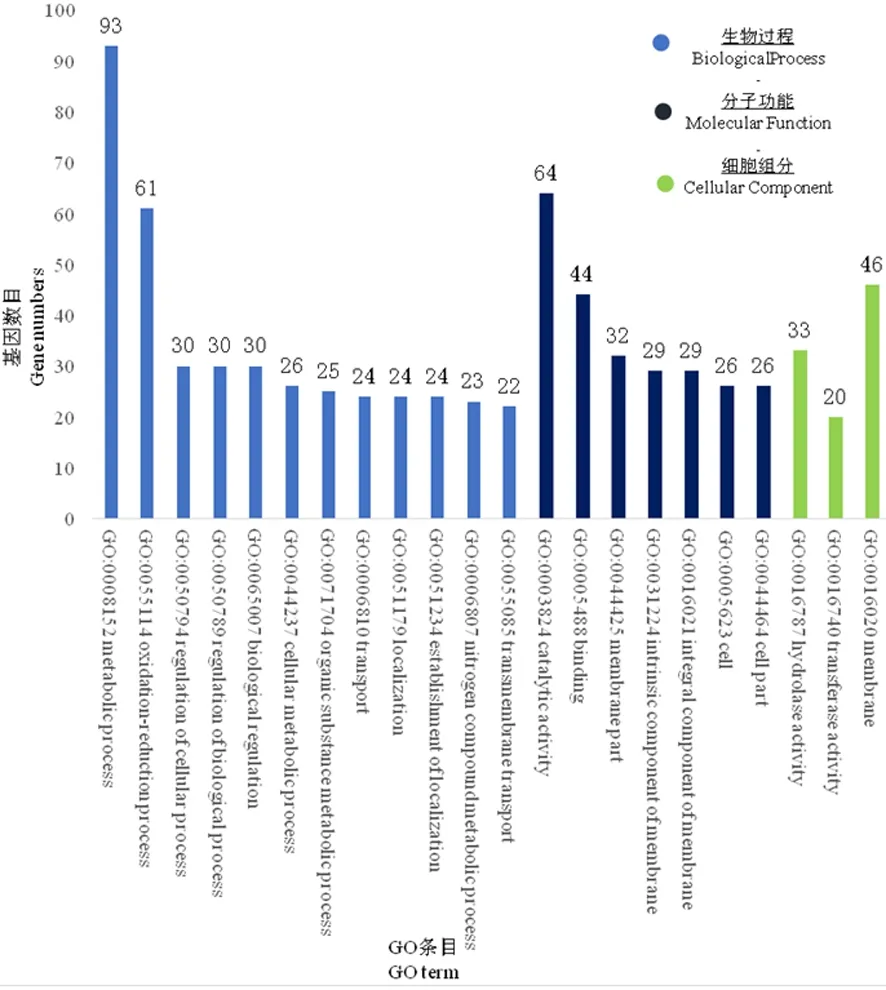
图6 FC440菌株铜胁迫处理下的差异表达基因GO功能富集
2.3.2 差异表达基因KEGG富集分析
研究表明,差异表达的基因富集在128个通路,富集程度最显著的前20个通路中,富集基因数量含3个以上的通路有:双组分系统通路(ko02020)22个(下调18个、上调4个),丙酮酸代谢(ko00620)通路,鞭毛组装(ko00790)通路,氧化磷酸化(ko00190)通路,叶酸合成(ko00790)通路,糖酵解/糖异生代谢(ko00010)通路,柠檬酸循环(ko00020)通路,缬氨酸、亮氨酸和异亮氨酸的降解(ko00280)通路(上调6个,下调1个),谷氨酸代谢途径(ko00480(上调5个)以及心肌收缩(ko04260)通路。
上调表达差异基因最多的ABC(ATP-binding cassette)转运通路(ko02010)涉及140个基因,其中差异表达基因19个(上调17个,下调2个),通路。下调差异表达基因最多的双组分系统通路涉及124个基因,差异表达基因22个(下调18个,上调4个)。图7
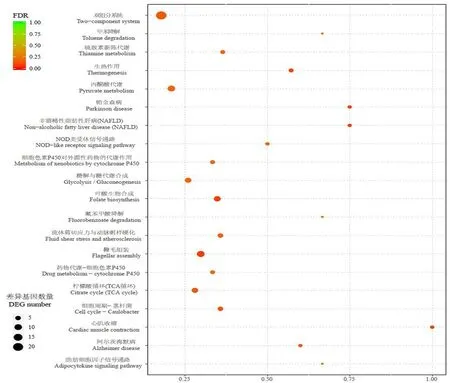
注:纵坐标为 KEGG Pathway 条目;横坐标为Richfactor,图中圆点的大小表示注释到该通路的差异基因的多少,颜色表示该通路的显著性 FDR 值
2.3.3 转录组数据的qPCR验证
研究表明,选取15个随机挑选基因,参照的管家基因为rpoB,该15个基因的相对表达量结果与转录组测序数据中相应基因的相对表达量在上调或下调表达倍数相近,表达趋势一致,转录组数据可靠。图8
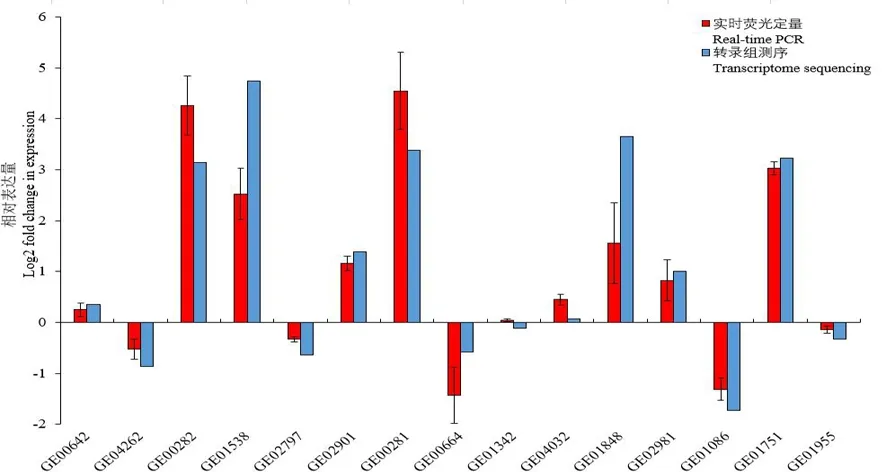
图8 铜胁迫处理后西瓜食酸菌15个基因相对表达量
3 讨 论
西瓜食酸菌其他菌株如M6菌株和pslb65菌株相似[9,12]。样品间相关性评估指标皮尔逊相关系数(Pearson's correlation coefficient,r)[13]r2越接近1,2个样品的相关性越强。细菌为应对环境中重金属或离子浓度过量的伤害,在长期进化中形成了多种胞内(重)金属离子处理方式,如氧化还原反应、跨膜转运、胞内束缚沉淀等等,以维持其胞内金属离子的稳态,与金属代谢和(重)金属离子抗性相关的基因位于细菌基因组或质粒中[14]。一个具有(重)金属抗性的细菌通常含有很多抗性系统,其(重)金属抗性是多个系统互作的结果[15]。西瓜食酸菌中已经被验证存在类CueO多铜氧化酶,在细菌中该酶的功能是将周质的Cu+氧化成渗透性较弱、毒性较小的Cu2+以减轻对细胞膜损伤,进而再通过离子外排系统排出细胞外膜;那么,在西瓜食酸菌中有怎样的类Cue系统,类CusB[6]、TolC[16]和ATP驱动的CopA[4]对应的系统及其组分,各种系统如何协作进行离子的外排等等问题,研究中铜胁迫下西瓜食酸菌转录组数据显示,差异表达基因数量较多且显著富集于氨基酸代谢通路、ABC转运通路、双组分系统等通路。
3.1 铜胁迫下西瓜食酸菌的氨基酸代谢
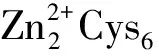
注释为脯氨酸/精氨酸代谢的途径(Arginine and proline metabolism,ko00330)中共有3个基因均为上调表达,经RCSB蛋白数据库(PDB)预测分别为2个谷胱甘肽转移酶家族成员和1个过氧化氢酶;谷胱甘肽代谢在KEGG代谢通路中有5个基因均为上调,通过RCSB蛋白数据库(PDB)分别被预测为1个酰基转移酶、3个谷胱甘肽转移酶和1个葡萄糖脱氢酶。这些基因的表达量增高,显示在铜胁迫下病菌可能通过脯氨酸/精氨酸通路、谷胱甘肽代谢等过程加速某些氨基酸合成速率。缬氨酸、亮氨酸、谷氨酸和异亮氨酸的代谢路中有86%的基因发生了显著上调表达,这些氨基酸在一些细菌中可以通过与铜离子形成螯合物或作为氧化还原酶的关键位点,参与细菌胞内铜稳态维持。
3.2 铜胁迫下西瓜食酸菌的ABC转运体
ABC转运体广泛存在于生物界,是目前已知最大、功能最广泛的蛋白家族,能利用水解ATP的能量参与细胞内多种物质的跨膜转运[27, 28]。
在嗜热细菌中至少存在42个ABC转运体,这些转运体可以结合Fe2+、Cu2+以提高菌在金属环境的耐受能力[29]。细菌中ABC转运系统对镍离子也具有高亲和力,如大肠杆菌的NikABCDE转运体,其中NikB、NikC形成跨膜的镍通道,NikD和NikE能结合并水解ATP,NikA作为周质蛋白可以结合一个镍离子,保持胞内镍离子稳态[17]。球囊霉菌(Glomusintraradices)在含有Cu2+的培养基中培养12 h后,其gintABC1(ABC转运体的MRP亚家族)的表达高出近4倍的水平,证明了ABC转运体GintABC1的表达受铜离子诱导[30]。西瓜食酸菌前期的研究鉴定到一类利用ATP的外排系统,是由P型ATP酶CopA[4]、多铜氧化酶CueO[5]和类CueR组成的类Cue系统参与该菌对铜离子的外排。研究结果显示Cu2+胁迫下该菌的ABC转运通路89%的基因上调表达,从转录组水平证实该菌中存在依赖ATP、主动的ABC转运体参与该菌对Cu2+离子的外排。该菌中存在多条主动的铜离子外排系统。
3.3 铜胁迫下西瓜食酸菌的双组分系统
由信号转导组氨酸激酶和转录调节因子组成的双组分系统(Two-Component Regulatory System,简称TCS)广泛存在于微生物中。TCS在细菌适应高浓度重金属离子环境上有着不可或缺的作用[31]。铜绿假单胞菌(Pseudomonasaeruginosa)在含铜的环境中胞内双组分系统czcRS表达增强,调控czcCBA操纵子表达,进而CzcCBA金属转运系统得以表达,促进Cu2+外排,维持胞内金属稳态[32]。大肠杆菌DNA微阵列检测表明,在培养基中加入CuSO4可以诱导菌中CpxAR双组分系统[33]、YedVW双组分系统的表达[34]。铜胁迫下的幽门螺旋杆菌(Helicobacterpylori)中,通过突变分析和体外DNA/蛋白结合实验发现,CrdRS双组分系统的铜离子诱导是其转录必须的,敲除crdS后铜离子无法诱导其表达,突变体表现对铜敏感,显示该系统的表达对调控铜外排泵crdAB和czcBA至关重要。此外,ABC转运体既可以诱导TCS基因的表达,也可以负调控TCS,如农杆菌(Agrobacterium)的virAG(TCS)基因的表达依赖于ABC转运体GguAB(糖结合蛋白),高糖条件下GguAB可以诱导virAG的表达,GguAB首先与组氨酸激酶VirA互作,进而使virAG转录激活,从而表达细胞坏死因子[36]。枯草芽抱杆菌(Bacilussubtilis)中PhRB是一种调节磷酸盐同化的TCS,受同一基因簇上的pstCAB(ABC转运体)和phoU负调控,当高浓度的磷酸盐存在时Pst基因簇表达,PhoU与phoR相互作用,抑制DNA结合蛋白PhoB的磷酸化和激活,从而抑制磷酸盐的同化作用;低浓度磷酸盐环境则不抑制磷酸盐的同化,从而使细胞适应磷酸盐有限的环境[36]。研究中铜胁迫处理后西瓜食酸菌的TCS通路基因表达显著下调,显示其参与菌对铜的响应,且受到负调控,是否受高表达的ABC转运系统的负调控,以及该菌的TCS与ABC转运体间的关系,有待后续实验解析。
4 结 论
差异表达的基因显著富集于ABC转运系统的跨膜转运、双组分系统通路的信号转导以及氨基酸代谢等约9大通路显示这些通路在西瓜食酸菌对铜的胁迫响应中起积极作用。含谷氨酸和谷胱甘肽(5个基因均上调表达)等的氨基酸代谢在西瓜食酸菌抗铜胁迫中发挥重要作用;双组分系统(22个基因,18个发生上调表达)参与西瓜食酸菌对铜离子胁迫的响应,且受到负调控;该菌中可能存在包含ABC转运体的跨膜转运、氧化还原反应、胞内束缚沉淀等多种系统互作的抗铜机制。

