缺氧诱导因子和促红细胞生成素及其受体基因在绵羊各组织中表达量
雷 艳,兰 斌,余万里,戴小华,蔡 鹏,顾伟芳,阿迪莱·艾力,赵红琼
(新疆农业大学动物医学学院,乌鲁木齐 830052)
0 引 言
【研究意义】缺氧(hypoxia)是指因组织的氧气供应不足或用氧障碍而导致组织的代谢、功能和形态结构发生异常变化的病理过程。轻度的缺氧应激会降低动物的采食量和免疫力,影响动物的生产性能,而严重的缺氧应激可能会造成动物死亡[1]。诸多缺氧相关因子中缺氧诱导因子(hypoxia inducible factor, HIF)是氧信号转导系统的核心因子。HIF是由α亚基和β亚基组成的异源二聚体,β亚基是结构亚基,在细胞内稳定表达;而α亚基是功能亚基,在不同的状态下表达存在显著差异,对低氧适应性起激活作用的HIF主要有HIF-1α、HIF-2α[2,3]。人体中HIF-1α和HIF-2α的氨基酸序列仅有48%的同源性[4]。促红细胞生成素(erythropoietin, EPO)是一种活性糖蛋白,能促进骨髓中红系造血祖细胞的增殖和分化,对机体供氧状况发挥重要的调控作用[5]。EPO是HIF的下游靶基因之一,当机体受到缺氧应激时,HIF会激活EPO的转录活性,促进EPO的表达。EPO主要通过与靶细胞膜表面的促红细胞生成素受体(erythropoietin receptor, EPOR)结合,发挥其生物学效应[6]。【前人研究进展】Befani等[7]使用化学物质氯化钴模拟缺氧,蛋白表达量在48 h内随着缺氧暴露时间递增。米晓钰等[8]对牦牛脑部HIF-1α的表达与定位进行研究,发现HIF-1α基因和蛋白在脑垂体表达量最高,垂体可能对缺氧具有较强的易感性。商鹏等[9]将饲养到平原地区的猪移居到高原,发现EPOR基因表达量增加,EPOR基因可能对高原适应性有重要作用。【本研究切入点】检测缺氧相关因子及其受体在动物各组织的基因表达情况有利于探究机体缺氧耐受或不耐受可能的靶组织或器官。【拟解决的关键问题】研究用实时荧光定量PCR的方法探新疆地方品种绵羊新疆细毛羊缺氧相关因子HIF和EPO及其受体的表达,为该品种绵羊引入高原缺氧地区研究提供组织学依据,为靶向缓解或调控缺氧应激提供组织学参考。
1 材料与方法
1.1 材 料
1.1.1 试验动物
4只健康新疆细毛羊,公羊,体重26.1 kg±0.2 kg,3~4月龄,来源于新疆畜牧科学院绵羊繁育试验基地。采样前1周,圈舍饲养,一天饲喂两次,饲喂量为600 g/只/d,精料,秸秆青贮和苜蓿干草的比例为1∶1∶2,饮水自由。
1.1.2 主要试剂
反转录试剂盒,HiFiScript cDNA Synthesis Kit(CW2569M,康为世纪生物科技有限公司);2 ×TaqMastreMix(CW0682M,康为世纪生物科技有限公司);50 × TAE(biosharp);核酸染料(博迈德生物);琼脂糖(BIOWEST);荧光定量PCR试剂盒,PerfectStart Green qPCR SuperMix(AQ601,北京全式金生物技术有限公司)。
1.1.3 主要仪器
荧光定量PCR仪(7500 fast,Applied Biosystems);稳压稳流电泳仪(DYY-6C,北京六一生物科技有限公司);微型电泳槽(DYCP-31DN,北京六一生物科技有限公司);单滴分光光度计(SMA400,Merinton)。
1.2 方 法
1.2.1 绵羊组织样品的采集与处理
采样前一晚绵羊禁食不禁水,次日早晨颈部放血处死,共采集4只绵羊的样品,每只绵羊采14种组织。每种组织样品采样点保持一致。采集的组织用无菌生理盐水冲洗干净,滤纸蘸干后放入无菌无酶冻存管,立即置于液氮中速冻,之后保存于-80℃冰箱,用于RNA的提取。表1
1.2.2 引物设计
根据GenBank中已经发布的HIF-1a、HIF-2a、EPO和EPOR的全基因组序列(NCBI参考序列号分别为:XM_027971915.1、XM_015094403.2、NM_001024737.1和XM_027970663.1),以GAPDH为内参基因,按照实时荧光定量PCR的引物设计原则,用Primer Premier 5.0软件设计引物序列,由生工生物工程(上海)股份有限公司合成。表2
1.2.3 总RNA的提取
使用Trizol法提取组织中总RNA,置-80℃保存备用。用单滴分光光度计在波长为230 nm处检测RNA的纯度和浓度。通过1.5%琼脂糖凝胶电泳和凝胶成像系统检测RNA的完整性。

表1 采集的绵羊组织样品及位点Table 1 The samping site of the tissues

表2 HIF-1α、HIF-2α、EPO和GAPDH 的PCR引物序列Table 2 PCR primer sequences of HIF-1α, HIF-2α, EPO and GAPDH
1.2.4 cDNA的合成
使用HiFiScript cDNA Synthesis Kit反转录试剂盒将绵羊各组织提取的RNA反转录为cDNA,RNA总量为2 000 ng,反应总体系为20 μL。先加入4 μL的dNTP Mix (2.5 mmol/L),2 μL的Primer Mix,模板RNA 2 μg,用RNA无酶水补足到13 μL,70℃水浴10 min,迅速冰浴2 min。然后继续加入4 μL 5×RT buffer,2 μL DTT(0.1 mol/L),1 μL HiFiScript反转录酶(200 U/μL),混合均匀,50℃水浴15 min。瞬时离心,置于冰上冷却后,将反转录产物保存于-20℃,备用。
1.2.5 引物的特异性
以反转录产物cDNA为PCR模板,进行目的基因扩增和引物特异性验证。PCR体系为2 ×TaqMastreMix 7.5 μL,模板0.5 μL,上下游引物各0.5 μL,ddH2O补足到12 .5 μL。PCR条件为:94℃ 10 min,94℃ 30 s,60℃ 30 s,72℃ 30 s,72℃ 10 min,35个循环。PCR反应结束后,进行2%的琼脂糖凝胶电泳,1×TAE,电压120 V,电流100 mA,电泳35 min后观察引物特异性。
1.2.6 实时荧光定量PCR
将反转录的cDNA进行2倍稀释,作为实时荧光定量PCR的模板。实时荧光定量PCR反应体系为:2 × PerfectStart Green qPCR SuperMix 7.5 μL,模板1.5 μL,上下游引物各0.3 μL,Passive Reference Dye 0.3 μL,ddH2O补足到12.5 μL。每个样品进行3个重复。反应条件为:94℃ 30 s,94℃ 5 s,60℃ 34 s,72℃ 34 s,40个循环。
1.3 数据处理
使用2-△△Ct法比较各基因相对表达量,△Ct=(Ct(目的基因)-Ct(内参基因)),△△Ct=△Ct(一个组织目的基因)-△Ct(混样RNA)。RNA混样由同一只绵羊的各个组织RNA经稀释到同一浓度后等量吸取混合而成。SPSS Statistics 21软件进行2-△△Ct值统计分析,比较各组织之间目的基因相对表达量的差异,结果用均值±标准误表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 总RNA的提取结果
研究表明,RNA电泳条带清晰,A260/A280比值大于1.9,无蛋白质和DNA等杂质污染,提取的总RNA可进行后续反转录和荧光定量PCR检测。图1
图1 绵羊各组织提取的RNA完整性检验
2.2 目的基因的扩增
研究表明,HIF-1α、HIF-2α、EPO及EPOR基因均扩增出单一清晰条带,且无其它非特异性条带,片段大小与预期相符(HIF-1α为166 bp,HIF-2α为185 bp,EPO为73 bp,EPOR为139 bp)。图2

图2 绵羊组织中HIF-1α、HIF-2α、EPO和EPOR基因的扩增
2.3 实时荧光定量PCR产物的特异性
研究表明,从4种基因的荧光定量PCR熔解曲线均峰形单一,无引物二聚体等杂峰出现,4种基因的引物具有很强的扩增特异性。扩增曲线基线平整,扩增期和平台期明显,无特殊趋势。图3,图4
图3 实时荧光定量PCR熔解曲线

图4 实时荧光定量PCR扩增曲线
2.4 HIF-1α基因在绵羊各组织中相对表达量
研究表明,HIF-1α基因在绵羊肺组织的相对表达量最高(4.2±1.2),且极显著高于其它组织,差异具有统计学意义(P<0.01);脾(1.8±0.3)和睾丸(1.7±0.6)中该基因的相对表达量显著高于肝和心脏组织(P<0.05);其它各组织之间差异无统计学意义(P>0.05),相对表达量均值为(0.8±0.1)。图5
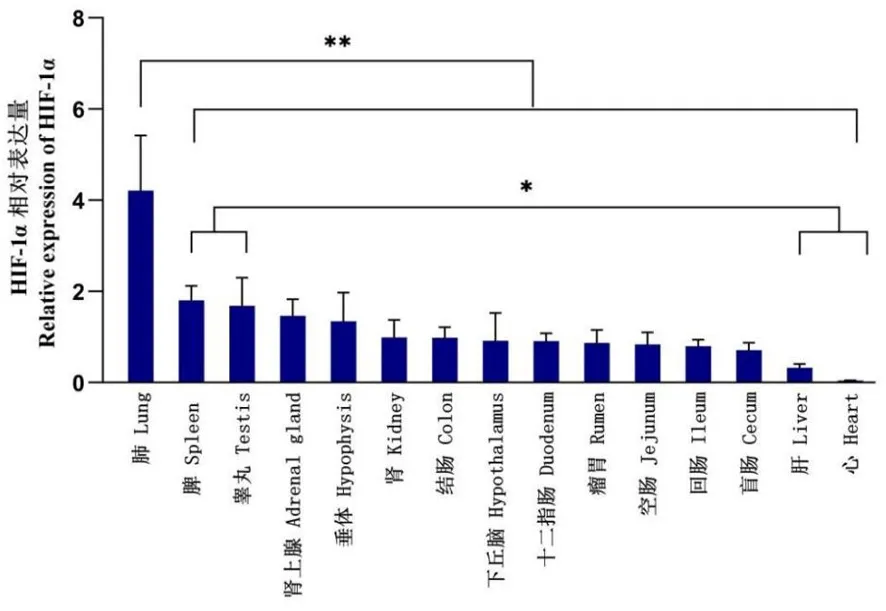
注:绵羊各组织之间相对表达量具有统计学意义用*表示P<0.05水平,用**表示P<0.01水平,下同
2.5 HIF-2α基因在绵羊各组织中相对表达量
研究表明,HIF-2α基因在绵羊各组织中相对表达量,肺组织中HIF-2α基因的相对表达量最高(21.9±4.7),其差异具有统计学意义(P<0.01);脾中HIF-2α基因的相对表达量(5.1±3.5)高于盲肠、结肠、空肠、下丘脑、肾脏、回肠、心脏、肾上腺以及睾丸,差异具有统计学意义(P<0.05);其它各组织之间差异不具有统计学意义(P>0.05),其均值为(0.7±0.1)。图6
2.6 HIF-1α和HIF-2α两种基因在表达量最高组织中的比较
研究表明,将HIF-1α和HIF-2α基因在表达量最高的肺组织中进行比较,HIF-2α基因的表达量显著高于HIF-1α基因,差异具有统计学意义(P<0.05),且约为HIF-1α表达量的5.2倍。图7

图6 HIF-2α基因在绵羊各组织中的相对表达量
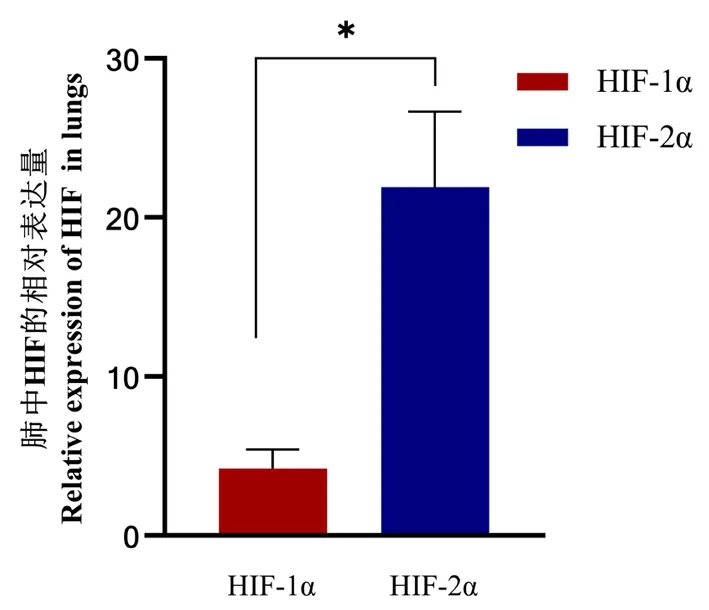
注:两种基因相对表达量差异具有统计学意义用*表示P<0.05水平,用**表示P<0.01水平
2.7 EPO基因在羊各组织中的相对表达量
研究表明,该基因在肾脏中的相对表达量最高(3.8±3.6),且显著高于垂体、结肠、脾脏、盲肠、肝脏、肾上腺、瘤胃、下丘脑以及心脏,差异具有统计学意义(P<0.05);其它各组织之间差异无统计学意义(P>0.05),其均值为(0.7±0.1)。图8
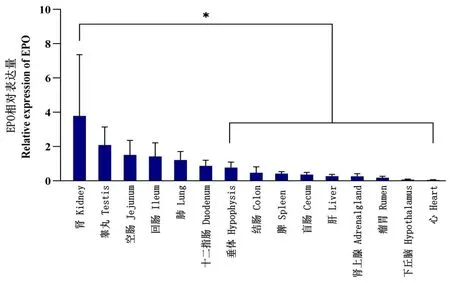
图8 EPO基因在绵羊各组织中的相对表达量
2.8 EPOR基因在绵羊各组织中的相对表达量
研究表明,该基因在肺(21.1±14.2)和睾丸(18.5±9.0)中相对表达量最高,且显著高于其它组织,差异具有统计学意义(P<0.05);其它各组织之间差异不具有统计学意义(P>0.05),其均值为(0.6±0.2)。图9
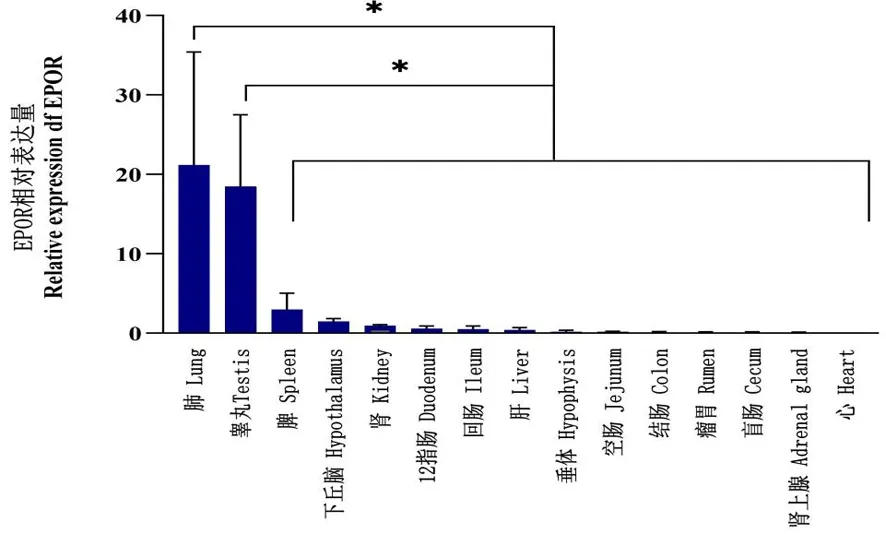
图9 EPOR基因在绵羊各组织中的相对表达量
3 讨 论
试验采用实时荧光定量PCR方法检测到HIF-1α和HIF-2α基因在绵羊的各组织中都有表达,并有明显的组织差异性,且均在绵羊肺脏的相对表达量最高,其次是脾脏。生活在高海拔缺氧环境的藏羚羊,HIF-1α和HIF-2α基因在肺脏、心肌、肝脏、大脑、小脑、骨骼肌等组织中均有表达,其中肺脏的表达量最高[10,11]。Spencer等[12]提出,在常氧条件下,HIF-2α mRNA在血管丰富组织中表达量较高,与试验中肺脏高表达的结果基本一致,但试验在心脏中检测到HIF-2α mRNA的表达量非常低,究其原因可能是两个研究心脏取样位点不同,研究主要采集的是右心室心肌部的样品,因而有必要进一步研究心脏不同部位HIF表达是否有差异。常氧环境下的绵羊和处于高原缺氧氧地区的藏羚羊,HIF-1α和HIF-2α基因都在肺脏高表达,肺脏可能是HIF的主要来源器官。对于生活在高海拔缺氧地区的哺乳动物如藏羚羊或牦牛,可高表达HIF基因的肺脏具有更强大的功能,如肺部气体扩散容量很高,扩散能力强,血液流速更快,以保证体内氧气的供应[13]。高原哺乳动物为适应低氧环境,发生低氧适应性进化,肺泡发育时期更早,肺泡数目在单位面积内增多,肺泡面积也较小[14],而赵晓萌等[15]也发现HIF-1α在牦牛肺脏中的肺泡、终末细支气管环形平滑肌以及肺泡隔间充质细胞中都有表达。肺脏是机体适应低氧环境,使HIF发挥缺氧调控作用的重要器官。
HIF-1α和HIF-2α基因均在绵羊肺部的相对表达量最高,而且HIF-2α的表达量约为HIF-1α的5.2倍。HIF-1α和HIF-2α基因虽然同属一个家族,在基因表达和低氧调控中具有一定的相似性,但功能与作用有不同之处。Uchida等[16]在研究肺上皮细胞时发现,在低氧后6 ~ 12 h内HIF-1α的m RNA表达量快速下降,而在相同时间点HIF-2α的mRNA的表达量明显增加,且在蛋白水平HIF-1α和HIF-2α的表达情况与mRNA表达一致,在缺氧应激过程中HIF-2α表达量的变化可能较HIF-1α更敏感,作用也更明显。
EPO的表达会受到HIF基因的影响。Miao等[17]研究发现小鼠肝癌组织中EPO和EPOR的表达与HIF呈正相关,缺氧可使肝癌细胞中EPO和EPOR的表达量增加。试验检测绵羊各组织中EPO和EPOR基因的表达量结果显示,EPO基因在绵羊肾脏的相对表达量最高,这表明肾脏是EPO基因的主要合成部位。Jacobson等[18]发现大鼠产生EPO的主要器官是肾脏,由肾小管周围毛细血管内皮细胞或成纤维细胞合成,仅少部分由肝脏、巨噬细胞和有核红细胞产生。EPO具有促进红细胞的生成、抗炎症反应、抗细胞凋亡、增强免疫功能等多种生物学功能。当机体缺氧时,肾脏中的EPO,会刺激幼稚红细胞的增生,血红蛋白化和红细胞的成熟,通过增加红细胞数量,从而增加组织的供氧量。
EPOR是EPO具有高特异性亲和力的受体,EPO需与EPOR特异性结合而激活相关信号通路从而发挥促进红细胞增殖等功能。试验通过对绵羊各组织中EPOR基因相对表达量检测发现,EPOR基因在不同组织中广泛表达,但表达量有所不同,肺脏相对高于其它组织。管春燕[19]研究表明,EPOR基因在牦牛和西藏牛的肺脏、肾脏、臀肌等组织中均有表达,其中肺脏的表达量最高,与研究结果一致。EPO主要来源于肾脏,可能在机体具有广泛的调节作用,但是主要作用部位在肺脏。
4 结 论
HIF-1α和HIF-2α基因均在绵羊肺组织的相对表达量最高;在肺脏HIF-2α基因的表达量约为HIF-1α表达量的5.2倍。EPO基因在绵羊肾脏的相对表达量最高且高于垂体、结肠、脾脏、盲肠、肝脏、肾上腺、瘤胃、下丘脑以及心脏。EPOR基因在肺脏的表达量最高,且肺脏和睾丸的相对表达量高于脾脏、下丘脑、肾脏、心脏等组织。肺脏和肾脏可能是绵羊缺氧应激感受和调控的重要器官。

