锌和镍离子对鲫肠道黏膜重要酶活性的影响
胡雨佳,王伟,倪静媛,张盛周
(安徽师范大学生命科学学院,安徽省重要生物资源保护与利用重点实验室,安徽 芜湖 241000)
随着我国工业化和城市化的不断发展,大量含有重金属离子的工业废水被排放到水体环境中,导致水域重金属污染日益严重。锌和镍为水体重金属污染的主要元素,可在鱼体内富集,并与生物体内的蛋白质等高分子物质结合或者与DNA 等相互作用,引起不可逆转的变性或遗传突变,阻碍生理或代谢过程的正常进行,进而影响鱼类的生长发育和繁殖等,甚至出现胚胎、幼体致死现象[1-5]。
鲫(Carassius auratus),隶属鲤科,鲫属,是一种温水性鱼类,在我国分布广泛。鲫肉味鲜美、营养丰富,可进行人工养殖,具有较高的经济价值[6]。研究表明,重金属离子在鲫体内富集后,与酶和核酸等生物大分子相互作用,引起鲫中毒或死亡[7]。目前有关重金属离子对鲫肠道黏膜上酶活性的影响研究未见报道。现以鲫为研究对象,探讨不同浓度的锌和镍离子对其肠道黏膜中过氧化物酶(POX)、非特异性酯酶(NSE)、碱性磷酸酶(ALP)、酸性磷酸酶(ACP)和三磷酸腺苷酶(ATPase)5 种酶活性的影响,以期为鱼类的清洁养殖和污染防治提供参考。
1 材料与方法
1.1 试验材料
鲜活鲫5 条,体长为20~25 cm,体质量为350~500 g,购于芜湖市黄山西路菜市场。购回后清水静养2~3 h,待其将肠道残留物排出。
1.2 制备组织切片
解剖并取鲫中肠,切成5 mm 的肠段,用0.1 mol/L磷酸缓冲液清洗干净,于OCT 包埋剂包埋,冰冻切片,制成厚度8 μm 的组织切片,置于-20 ℃冰箱保存备用。
1.3 金属离子处理
分别设置2×10-5,2×10-4,2×10-3,2×10-2和2×10-1mol/L 5 个不同浓度的硫酸锌和氯化镍试验组,并对应设置2 个空白对照组。每个试验组和对照组均放入5 块鲫肠组织切片,30 min 后吸除离子溶液,进行酶组织化学染色。
1.4 酶组织化学染色
采用酶组织化学染色法,对金属作用过的鲫组织切片进行染色,POX 采用DAB 法、NSE 采用偶氮法、ALP 采用NBT/BCIP 法、ACP 采用铅法、ATPase采用钙-钴法,染色方法参考文献[8-9],染色时间根据颜色反应强度适当调整。
1.5 数据分析
使用BX61 型显微镜观察并拍照记录各酶组织化学染色结果。利用Image-Pro Plus 分析软件,对酶组织化学染色的阳性部位进行光密度分析,测出其面积(Area)与累积光密度值(IOD),计算出IOD 与Area 的比值,即用平均光密度值来表示酶活性大小。最后利用SPSS 软件中的单因素分析法,将不同离子浓度梯度下的酶活性与对照组进行比较,得出不同浓度梯度的金属离子对酶活性影响的差异显著性。P<0.05 为差异显著,P<0.01 为差异极显著。
2 结果与分析
2.1 鲫肠道黏膜5 种重要酶的组织化学染色特征
鲫肠道黏膜中5 种重要酶均呈现明显的酶组织化学染色反应。POX 酶组织化学反应呈棕红色,颗粒状,主要分布于肠道黏膜上皮细胞的纹状缘和固有层,见图1(a);NSE 酶组织化学反应呈砖红色,主要分布于黏膜上皮细胞的顶部和基部,在固有层中呈颗粒状分布,见图1(b);ALP 酶组织化学反应呈蓝紫色,主要分布于黏膜上皮细胞的顶部,固有层中亦有少量分布,见图1(c);ACP 酶组织化学反应呈棕黄色,主要分布于固有层,部分黏膜上皮细胞的基部亦有少量分布,见图1(d);ATPase 酶组织化学反应呈棕黑色,主要分布于黏膜上皮细胞的纹状缘,固有层亦有少量分布,见图1(e)。
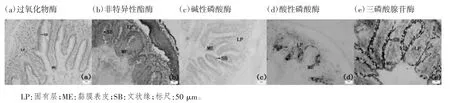
图1 鲫肠道黏膜5 种重要酶的组织化学染色
2.2 锌离子对鲫肠道黏膜5 种重要酶活性的影响
经光密度分析,不同浓度的锌离子(Zn2+)作用下鲫肠道黏膜5 种重要酶活性见表1。由表1 可见,随c(Zn2+)的增高,POX 活性呈减弱趋势。当c(Zn2+)≤2×10-4mol/L 时,对POX 活性无显著影响(P>0.05),当c(Zn2+)≥2×10-3mol/L,POX 活性被极显著抑制(P<0.01);在c(Zn2+)为2×10-5mol/L时,NSE 活性极显著增强(P<0.01),当c(Zn2+)≥2×10-4mol/L 时,NSE 活性被极显著抑制(P<0.01);当c(Zn2+)为2×10-5mol/L 时,对ALP 活性无显著影响(P>0.05),当c(Zn2+)≥2×10-4mol/L 时,ALP 活性呈减弱趋势,其中c(Zn2+)为2×10-4mol/L 时差异显著(P<0.05),c(Zn2+)≥2×10-3mol/L 时差异极显著(P<0.01);当c(Zn2+)≥2×10-5mol/L 时,ACP 活性被极显著抑制(P<0.01),且随c(Zn2+)升高ACP活性减弱;当c(Zn2+)为2×10-5mol/L 时,ATPase 活性极显著增强(P<0.01),当c(Zn2+)≥2×10-4mol/L时,ATPase 活性被极显著抑制(P<0.01)。

表1 不同浓度Zn2+作用下鲫肠道黏膜5 种重要酶活性①
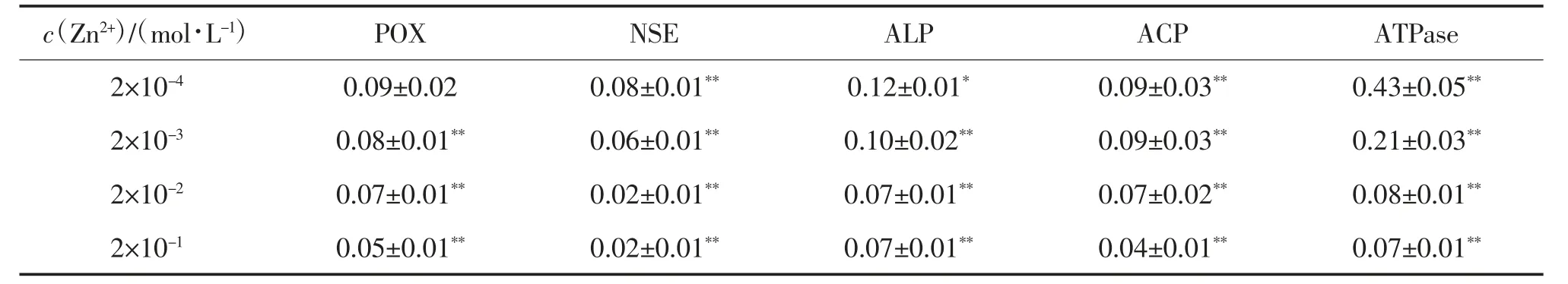
续表
2.3 镍离子对鲫肠道黏膜5 种重要酶活性的影响
经光密度分析,不同浓度镍离子(Ni2+)作用下鲫肠道黏膜5 种重要酶活性见表2。由表2 可知,POX 活性随c(Ni2+)的升高呈先增强后降低的趋势。当c(Ni2+)为2×10-5mol/L 时,POX 活性极显著增强(P<0.01),当c(Ni2+)≥2×10-2mol/L 时,POX 活性被极显著抑制(P<0.01);当c(Ni2+)为2×10-5mol/L 时,NSE 活性显著增强(P<0.05),当c(Ni2+)≥2×10-2mol/L时,NSE 活性被极显著抑制(P<0.01);当c(Ni2+)为2×10-5mol/L 时,对ALP 和ACP 活性无显著影响(P>0.05),当c(Ni2+)≥2×10-4mol/L,ALP 和ACP 活性均逐渐降低,且与对照组差异均极显著(P<0.01);c(Ni2+)为2×10-5mol/L 时,ATPase 活性极显著增强(P<0.01),当c(Ni2+)≥2×10-3mol/L 时,ATPase 活性被极显著抑制(P<0.01)。
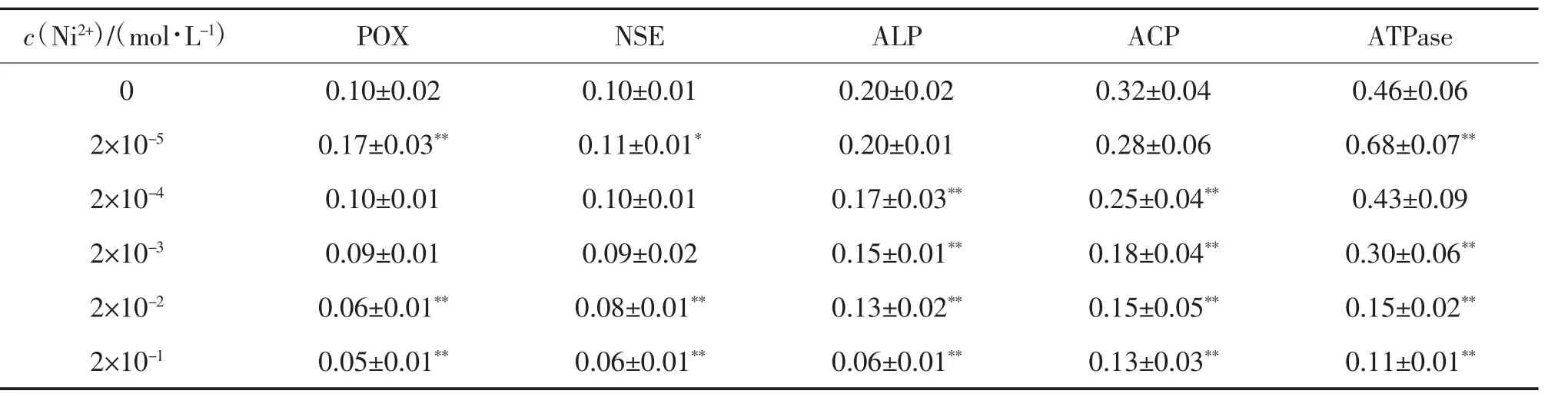
表2 不同浓度Ni2+作用下5 种重要酶活性①
3 讨论
鱼类的胃和肠道是消化和吸收的主要器官,参与离子、水和营养物质的运输和吸收[10-11]。其中肠道酶活性对营养物质的吸收至关重要,已有研究证明,温度、pH 值及饲料添加剂等[12-14]均对鱼类酶活性有影响。因此,通过探讨Zn2+和Ni2+对肠道酶活性的影响,有助于增进对鱼类的毒理认识。
3.1 过氧化物酶(POX)
过氧化物酶是过氧化物酶体的标志酶,是一类氧化还原酶,可催化过氧化氢分解,氧化酚类、胺类和烃类化合物,消除其对机体的毒性作用[15-16]。刘树青等[17]研究表明,POX 具有减少自由基对正常细胞的损伤作用,可以清除细胞生理代谢过程中产生的活性氧,从而提高机体的解毒功能和防病抗病能力。陈剑兴等[18]的研究表明,镉对POX 活性具有毒物兴奋效应,即低浓度激活高浓度抑制的现象,这与本研究结果相一致。本研究显示,低浓度Zn2+对POX 活性无显著影响(P>0.05),但低浓度Ni2+对POX 活性有显著促进作用(P<0.05);而高浓度的Zn2+和Ni2+则对POX 活性均具显著抑制作用(P<0.05)。可见,高浓度的Zn2+和Ni2+会通过抑制POX的活性,降低机体解毒功能和防病抗病能力。
3.2 非特异性酯酶(NSE)
非特异性酯酶属于水解酶类,参与大部分脊椎动物包括鱼类,对脂肪酸和甘油酯类物质的消化和吸收[19],对鱼类获取能源物质有重要作用[20]。NSE 在低浓度Zn2+或Ni2+处理下活性增强,但随着离子浓度的增加,酶活性减弱,表明低浓度的Zn2+和Ni2+对NSE 活性有促进作用,高浓度的Zn2+和Ni2+会抑制NSE 活性,这与铅对栉孔扇贝(Azumapecten farreri)NSE 活性的影响结果一致[21]。可见,在低浓度Zn2+或Ni2+作用下会增强NSE 活性,促进机体消化吸收营养物质来获取能源,抵抗重金属离子的胁迫作用。但高浓度Zn2+和Ni2+会抑制NSE 活性,从而阻碍机体对能源物质的获取,对机体产生毒害作用。
3.3 碱性磷酸酶(ALP)
碱性磷酸酶是在肠上皮细胞中,对磷化物以及其他物质的消化、吸收和转运起着重要作用的酶类,其活力大小可以反映细胞对钙、磷以及其他营养物质的吸收能力[22]。本研究结果表明,Zn2+和Ni2+对鲫肠道黏膜上的ALP 活性有抑制作用,且抑制效果随浓度的升高而增强,与镉对鲫肠ALP 的抑制作用相一致[23]。王秋颖等[22]研究表明,钙、磷供应不足,对动物的影响主要表现为骨结构异常、软骨病、食欲降低、生长迟缓、生产性能下降等。因此,当Zn2+和Ni2+超标时会抑制ALP 活性,从而阻碍鲫的磷循环和物质吸收转运,影响鲫的生长发育。
3.4 酸性磷酸酶(ACP)
酸性磷酸酶是溶酶体中的标志酶,与细胞内蛋白质的消化吸收和转运有关,胞饮作用也被认为是硬骨鱼类吸收和消化蛋白质的一种途径[24-25]。本研究结果表明,ACP 活性随Zn2+和Ni2+浓度的升高而降低,与镉对鲫肠ACP 活性和铅对鲫肝胰ACP活性的影响结果一致[23,26]。可见,当Zn2+和Ni2+浓度升高会抑制ACP 活性,阻碍肠道细胞对蛋白质的吸收与利用。
3.5 三磷酸腺苷酶(ATPase)
三磷酸腺苷酶是一类催化ATP 水解的酶并伴随能量的释放,一般存在于组织细胞膜及细胞器膜上,维持细胞膜内外的离子梯度差,保证各种代谢活动能量的供给[27]。在鲫肠道中,ATPase 主要是对营养物质的消化和吸收提供能量。本研究结果表明,在低浓度Zn2+或Ni2+作用下,ATPase 活性增强,但在高浓度下酶活性被抑制,与铜和镉对鲫肝胰脏ATPase 活性的影响及NiSO4(硫酸镍)对大鼠(Rattus norregicus)心肝肾ATPase 的影响结果相一致[28-29]。刘存岐等[30]在金属离子对中国对虾(Penaeus chinensis)幼体内ATPase 活性的影响研究中发现,ATPase 活性的高低和对虾的生长速度快慢呈现出极大的一致性,表明ATPase 活性会直接影响生物机体的生存能力。因此当水环境中的Zn2+和Ni2+含量过高时会抑制ATPase 的活性,同样会对鲫健康状态和生存产生负面影响。
Zn2+和Ni2+对5 种酶活性的影响均具有一定的剂量-效应关系。水体中Zn2+和Ni2+含量超标,会抑制鲫肠道黏膜中重要酶的活性,阻碍机体抗病和消化吸收营养物质的能力,从而影响其生长和发育。本研究结果也表明,鲫肠道黏膜中重要酶活性的高低,可以作为反映水体Zn2+与Ni2+污染的指示指标。

