二氧化碳浓度对不育系和可育系水稻颖花关闭的影响
黄友明,曾晓春
(宜春学院 生命科学与资源环境学院,江西 宜春 336000)
【研究意义】在水稻生产尤其是在杂交水稻制种中,颖花关闭同颖花开放一样是非常重要的过程,都直接影响着水稻种子的产量和质量。水稻抽穗开花期,不可避免地会遭遇各种逆境胁迫,如高温、干旱、雨淋、机械损伤、病害、虫害、盐害和干热风等,严重影响开放颖花的开闭;不育系颖花普遍存在闭颖慢、开闭历时过长、关闭不严、甚至不闭颖等现象。导致结实率降低、裂颖率升高和子房发育异常出现子粒畸形,严重降低种子产量和质量[1]。通过选择花时相近的不育系和恢复系配组、选育开花习性良好的不育系、采取科学合理的栽培与化学调控技术措施,杂交水稻制种中父母本花时不遇的问题已得到相当程度的解决。然而,水稻杂交制种中不育系开放颖花的关闭障碍又成为目前生产上新的瓶颈和“卡脖子”问题,严重降低杂交种子的产量和杂种质量。因此,研究水稻颖花关闭启动因子、影响因素、关闭机理以及物理化学调控方法势在必行。【前人研究进展】要调控水稻颖花关闭,就必须对颖花开闭运动过程有清晰的认识。水稻颖花开闭和植物气孔开闭类似,都属于膨胀性运动;它们都由细胞的膨压变化引起;在一天的特定时间发生,存在一定的节律性;一定程度上都响应诸如机械损伤、光强或温度的变化等外来刺激[2]。黄友明等[3]研究发现,水稻颖花的开闭运动经历了内外颖夹角逐渐增大期(开颖)、内外颖最大夹角保持期(颖花开放)、内外颖夹角逐渐缩小期(闭颖)和内外颖夹角最小期(颖花关闭)4个截然不同的阶段。这种明确的划分可知“开颖”和“闭颖”是既相对独立又互相联系的不同过程。受植物叶片内CO2分压与气孔开闭关系的启发[4-5],王忠等[6]研究发现,水稻成熟颖花开放前,呼吸增强,颖腔内CO2浓度达5%左右。若把稻穗置于5%以上的CO2气体或浸没于pH5.6的CO2水溶液,成熟颖花将迅速开放。由于CO2对花丝伸长、柱头外露、花药开裂及花粉活力均无显著影响,故CO2促进水稻成熟颖花开放技术已应用于杂交水稻制种,能显著提高异交结实率和产量[2,7-8]。
【本研究切入点】成熟颖腔内CO2浓度升高是启动颖花开放的重要因子。然而内外颖开裂后颖腔内CO2浓度迅速降低,颖腔内低浓度CO2是颖花关闭的启动信号吗?如果继续维持颖腔内较高浓度CO2,是否抑制颖花关闭呢?【拟解决的关键问题】在对水稻颖花开闭运动认识以及CO2对成熟颖花开放效应研究的基础上,本文拟开展CO2浓度对水稻颖花关闭影响的研究。
1 材料与方法
1.1 供试材料和试剂
以可育水稻赣早538、萍恢141、华占和不育系水稻珍汕97A、博优A、岳4A 为材料(均为生产上广泛使用,且不育系材料颖花闭合慢,大量颖花关闭不严,甚至不关闭,裂颖现象非常严重),常规栽培管理于宜春学院基地(地力1 级,土壤剖面结构为A-P-W-C,水型为潴育型,粘壤土,电力排灌良好;有机质3.5%,全氮0.22%,有效磷7.6 mg/kg,速效钾96 mg/kg,阳离子交换量19.5 cmol(+)/kg,pH6.8)。CO2空气混合气由盛富莱锐锋气体有限公司提供。
1.2 处理方法
1.2.1 处理装置 试验装置(图1)由分离式的底座和玻璃罩组成,底座四周设凹槽,能与玻璃罩的4 个面缘盖住时相吻合。玻璃罩由厚度为9 mm的普通玻璃制成,长、宽、高分别为40,25,50 cm的长方体,其底面不封玻璃,可盖在底座上,进气口设置在玻璃罩窄面距下边3 cm 处,出气口则设在进气口的对侧面距上边3 cm处,进气口和出气口都安装阀门。试验时先把稻穗插入盛清水的三角瓶中,再把三角瓶置于底座上,盖好玻璃罩,然后底座上的凹槽注清水密封。连接充气口与15.5 Mpa,40 L 的储气钢瓶,调节气压3.5 Mpa,气流1 L/min,打开充气口和出气口阀门。

图1 CO2浓度对水稻颖花关闭的影响试验装置Fig.1 Testing apparatus for the influences of CO2 concentration on spikelets closure in rice
1.2.2 处理方法 水稻颖花的开闭受环境因子影响较大,顾蕴洁等[9]研究发现,35~40 ℃的温度,含量大于5% CO2的气体和饱和CO2的水溶液能显著促进开颖,低温、呼吸抑制剂抑制颖花开闭。黄友明等[3]也研究发现,水稻已开颖花的关闭存在温度“三基点”效应,35~40 ℃最适于颖花关闭,高于45 ℃或低于20 ℃对颖花关闭均不利。因此在水稻抽穗开花盛期选择日平均气温30 ℃以上,且日平均相对湿度65% RH 以上的晴天进行试验。于稻株长势基本一致的田块,试验前1~2 d 观察颖花开闭习性,确定颖花开放时间。试验当天,在颖花开放前约10 min,随机剪取长势基本一致的成熟稻穗(穗顶部少许颖花已开闭,中下部颖花在试验当天会大量开闭且完全抽出的稻穗),迅速插入盛清水的三角瓶中,每瓶3 穗,再将三角瓶置于上述装置底座上,每装置3 瓶即9 穗为1 个样本,然后迅速盖好玻璃罩,同时底座上的凹槽注满清水密封。待内外颖开裂后(喷施1 mmol/L MeJA 使成熟颖花集中开放,但MeJA 对颖花关闭无影响)立即连接充气口与15.5 Mpa 40 L 的储气钢瓶,调节气压3.5 Mpa,气流1 L/min,打开充气口和出气口阀门。试验分0%、0.03%、2%、5%、10%和15%CO2空气混合压缩气6 个处理。0% CO2处理即试验装置内放置1 个盛50 mL、10% NaOH 溶液的100 mL 烧杯,再充压缩空气;0.03% CO2处理即试验装置内充压缩空气;2% CO2处理即试验装置内充2% CO2空气混合压缩气,以下处理类推。分3 d 重复试验3 次。
1.3 颖花关闭率动态及开闭历时的测定
闭颖率动态:以每处理的9个稻穗作为观察统计对象,从当天开放的颖花关闭第1朵时开始(0 min),每30 min 累计统计当天开放颖花的关闭总数,直到当天开放颖花不再关闭为止。以各时间点累计关闭的颖花总数占试验当天开放颖花总数的百分数(%)为颖花关闭率。
颖花开闭历时:从内外颖始裂到内外颖夹角不再缩小所经历的时间为颖花开闭历时。同样以每处理的9 个稻穗作为观察统计对象。随机选择试验当天开放的颖花50 朵,观察记录内外颖始裂和内外颖夹角不再缩小的时刻。计算出单朵颖花开闭历时以及50朵颖花开闭历时的平均值。
1.4 颖花开闭过程中颖花胞间CO2浓度、气孔导度和蒸腾速率的变化
采用便携式AS.02-LCI-SD 光合仪[选择窗口面积为5.8 cm2的窄叶室,设置CO2浓度为385 µL/L,光通量密度为800~1 000 µmol/(m2·s),温度为34~38 ℃的闭路],分别独立测试开颖前1.0 h、开颖前0.5 h、内外颖开裂时、内外颖夹角最大时、内外颖合拢时和闭颖后0.5 h 6个时间点的完整颖花。每个时间点分别取10 朵颖花作为一个样本,单层平整排满叶室,测定颖花胞间CO2浓度(Ci)、气孔导度(Gs)和蒸腾速率(Tr)。试验重复3次。
1.5 数据分析
颖花关闭率、开闭历时、Ci、Gs和Tr均以3 次重复试验的平均值采用Excel 软件制作成柱形图,并对重复试验作标准误差分析。颖花开闭历时、Ci、Gs和Tr经F检验后用SSR法对各平均值进行多重比较,作出统计推断,比较结果用标记字母法表示,标注在柱形图的上端,小写字母a、b、c 表示差异显著(P<0.05),大写字母A、B、C表示差异极显著(P<0.01)。
2 结果与分析
2.1 CO2对可育水稻颖花关闭的效应
图2L、图3L 和图4L 分别显示可育水稻赣早538、萍恢141 和华占内外颖刚开裂的颖花经不同浓度CO2处理后,颖花关闭率均随时间延长而增大。在当天开放的颖花关闭第1朵后30 min和60 min,颖花关闭率差异非常明显,均是5% CO2处理最高。到90 min 时,赣早538 颖花关闭率,虽仍为5% CO2处理最高,但各处理间差异不大;萍恢141和华占颖花关闭率,5%、10%、15% CO2处理均达到100%,其他处理也接近100%,差异不大。到了120 min时,各处理间无差异,颖花关闭率均为100%。
图2R、图3R 和图4R 分别显示可育水稻赣早538、萍恢141 和华占颖花平均开闭历时。较0% CO2处理,2%、5%、10%、15% CO2处理赣早538,颖花平均开闭历时依次缩短15.08,25.81,24.04,24.71 min,分别达19.82%、33.92%、31.60%和32.48%。处理萍恢141 依次缩短11.37,23.56,21.35,21.51 min,分别达14.63%、30.31%、27.47%和27.67%。处理华占依次缩短14.24,22.11,18.83,21.91 min,分别达17.76%、27.58%、23.48%、27.33%。颖花平均开闭历时经F检验后,均为P<0.01。各试验材料0%和0.03% CO2处理间均无差异显著性,5%、10%、15% CO2处理间也均无差异显著性,对于赣早538 和萍恢141 颖花平均开闭历时,5%、10%、15% CO2处理均极显著短于2% CO2处理,而2% CO2处理又极显著短于0%和0.03% CO2处理,而对于华占颖花平均开闭历时,5%和15% CO2处理均极显著短于2% CO2处理,10% CO2处理显著短于2% CO2处理,而2% CO2处理又极显著短于0%和0.03% CO2处理。

图2 CO2浓度对水稻赣早538颖花关闭的影响Fig.2 Influence of CO2 concentration on spikelet closure in fertile rice of Ganzao 538

图3 CO2浓度对水稻萍恢141颖花关闭的影响Fig.3 Influence of CO2 concentration on spikelet closure in fertile rice of Pinghui 141

图4 CO2浓度对水稻华占颖花关闭的影响Fig.4 Influence of CO2 concentration on spikelets closure in fertile rice of Huazhan
表明2%~15% CO2处理可加快赣早538、萍恢141 和华占已开颖花的关闭进程,缩短颖花开闭历时,对颖花关闭起促进效应,此效应的最佳浓度为5%。
2.2 CO2对不育系水稻颖花关闭的效应
图5L、图6L和图7L分别显示不育系水稻珍汕97A、博优A 和岳4A 内外颖刚开裂的颖花经不同浓度CO2处理后,颖花关闭率均随时间延长而逐渐增大和随时间延长各处理间的差异逐渐缩小,但即使到最后仍然均达不到100%。不同试验材料和不同处理之间,在各观测时间点的颖花关闭率高低排序略微有些差别:对于珍汕97A,5% CO2处理一直最高,然后依次是10%、15%和2% CO2处理,而0%和0.03% CO2处理之间差异不明显,均较前述处理要低;对于博优A,除60 min 观测时间点外,也是5% CO2处理最高;对于岳4A,除60 min和90 min观测时间点外,也是5% CO2处理最高。
图5R、图6R 和图7R 分别显示不育系水稻珍汕97A、博优A 和岳4A 颖花平均开闭历时。较0% CO2处理,2%、5%、10%和15% CO2处理珍汕97A,颖花平均开闭历时依次缩短19.3,40.1,30.2,29.7 min,分别达12.00%、24.94%、18.78%和18.47%;处理博优A 依次缩短38,72.8,54.5,56.4 min,分别达18.88%、36.16%、27.07%和28.02%;处理岳4A 依次缩短20.1,50.7,33.5,31.4 min,分别达11.11%、28.03%、18.52%和17.36%。颖花平均开闭历时经F检验,珍汕97A 和岳4A 各处理间0.01<P<0.05,博优A 各处理间P<0.01。统计分析得出:对于珍汕97A,0%和0.03% CO2处理间无差异显著性,5%、10%和15% CO2处理间也无差异显著性,但5%、10%和15% CO2处理的颖花开闭历时均极显著短于2% CO2处理,而2% CO2处理又极显著短于0%和0.03% CO2处理。对于博优A 和岳4A,0%和0.03% CO2处理间无差异显著性,10%和15% CO2处理间也无差异显著性,但5% CO2处理极显著短于10%和15% CO2处理,10%和15% CO2处理极显著短于2% CO2处理,而2% CO2处理又极显著短于0%和0.03% CO2处理。
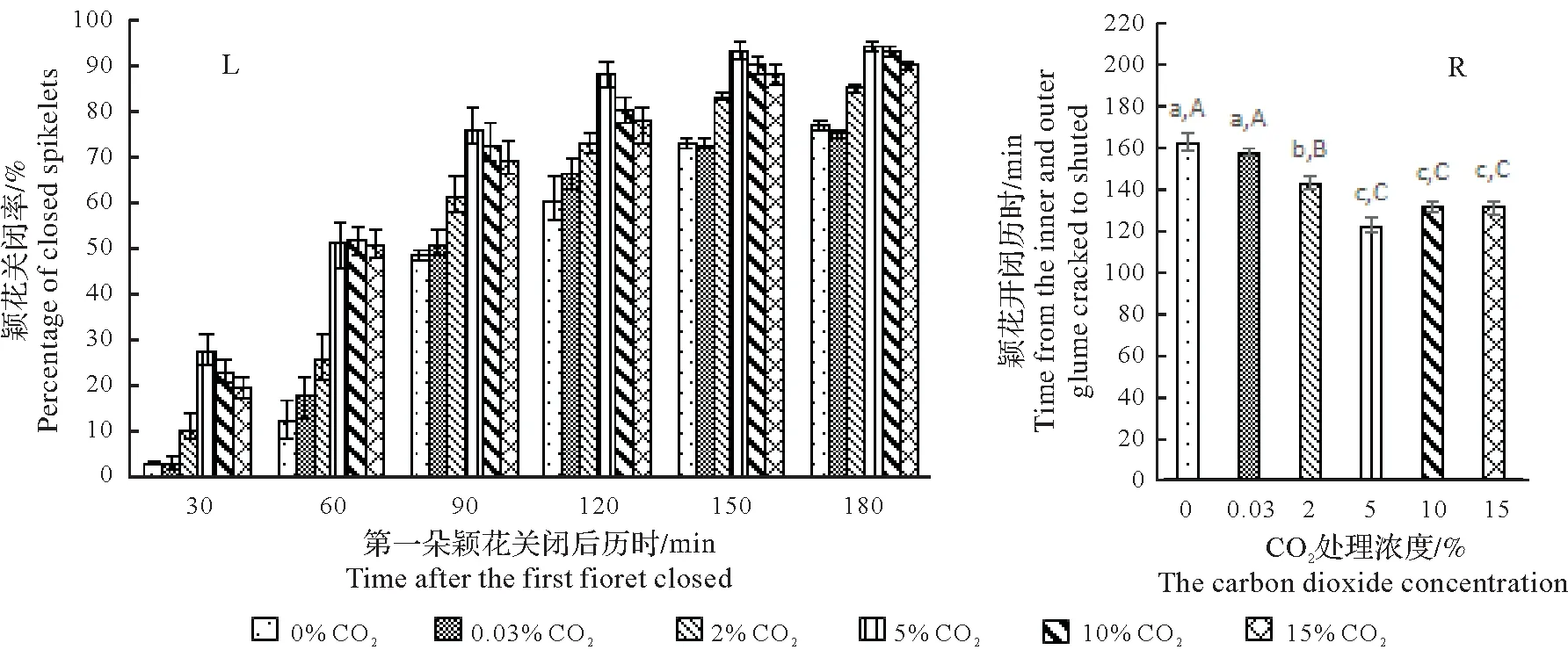
图5 CO2浓度对不育系水稻珍汕97A颖花关闭的影响Fig.5 Influence of CO2 concentration on spikelets closure in sterile rice of Zhenshan 97A

图6 CO2浓度对不育系水稻博优A颖花关闭的影响Fig.6 Influence of CO2 concentration on spikelets closure in sterile rice of Boyou A

图7 CO2浓度对不育系水稻岳4A颖花关闭的影响Fig.7 Influence of CO2 concentration on spikelets closure in sterile rice of Yue 4A
表明CO2处理可加快不育系水稻珍汕97A、博优A 和岳4A 已开颖花的关闭进程,提高颖花关闭率,缩短颖花开闭历时,对颖花关闭起促进效应,此效应的最佳浓度为5% CO2。
2.3 颖花开闭过程中颖花胞间CO2浓度、气孔导度和蒸腾速率的变化
颖花开闭过程中颖花胞间CO2浓度、气孔导度和蒸腾速率的测定,颖花取样参照预备试验结果进行:萍恢141开颖前1.0 h和开颖前0.5 h的丝颖比[花丝(含花药)长度与颖腔长度之比]分别约为0.70和0.73,从内外颖开裂到其夹角最大(约23.7°)经历约4.3 min,并持续最大夹角约11.5 min。珍汕97A开颖前1.0 h和开颖前0.5 h 的丝颖比分别约为0.76 和0.83,从内外颖开裂到其夹角最大(约28.6°)经历约7.8 min,并持续最大夹角约23.2 min。
图8L 和图8R 分别显示萍恢141 和珍汕97A 颖花自然开闭过程中颖花胞间CO2浓度(Ci)的变化,对各时间点Ci值进行F检验,均符合0.01<P<0.05。
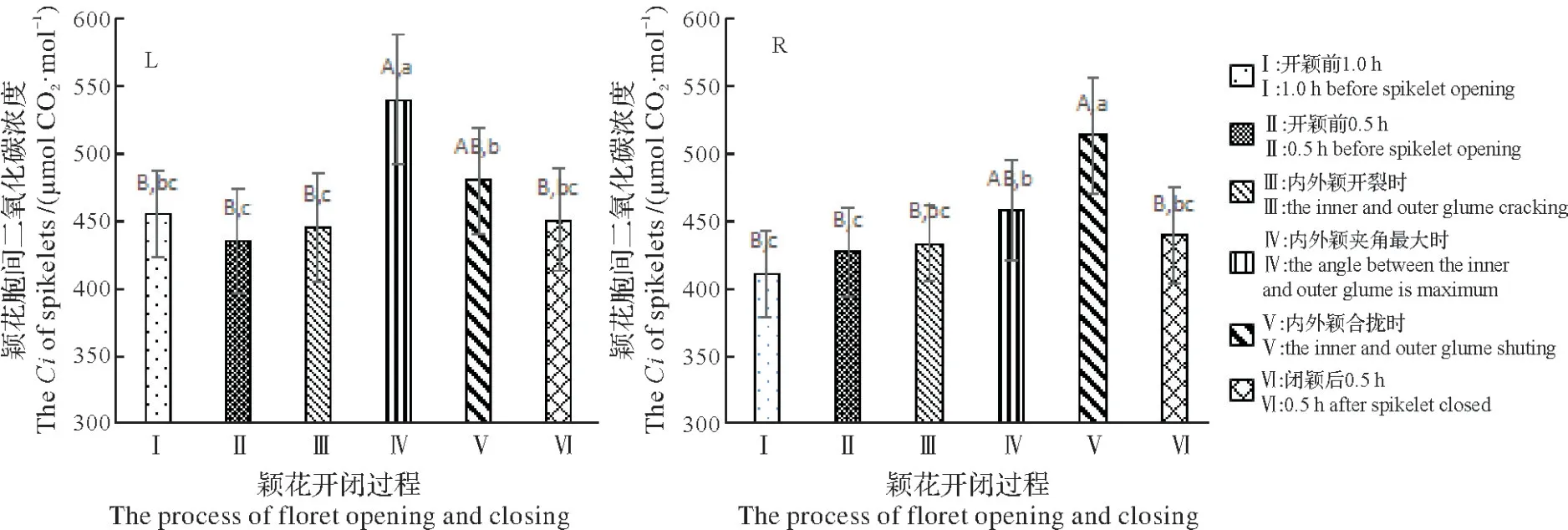
图8 颖花开闭过程中颖花胞间CO2浓度的变化Fig.8 The variation of spikelet Ci in the process of spikelets opening and closing
萍恢141颖花Ci值从开颖前0.5 h至内外颖夹角最大时逐渐增大,然后逐渐降低;内外颖夹角最大时Ci值最大,较内外颖开裂时高21.27%,较内外颖合拢时高12.59%;内外颖夹角最大时Ci极显著高于开颖前1.0 h、开颖前0.5 h、内外颖开裂时和闭颖后0.5 h,显著高于内外颖合拢时。珍汕97A 颖花Ci值从开颖前1.0 h 至内外颖合拢时逐渐增大,然后降低;内外颖夹角最大时Ci值较内外颖开裂时高5.72%,较内外颖合拢时低10.78%;内外颖合拢时Ci极显著高于开颖前1.0 h、开颖前0.5 h、内外颖开裂时和闭颖后0.5 h,显著高于内外颖夹角最大时。
图9L 和图9R 分别显示萍恢141 和珍汕97A 颖花自然开闭过程中颖花气孔导度(Gs)的变化,对各时间点Gs值进行F检验,均符合P<0.01。萍恢141Gs值从开颖前1.0 h至内外颖开裂时逐渐降低,但在内外颖夹角最大时急剧升高并达最高,然后又逐渐降低,在内外颖合拢时达最低,闭颖后0.5 h又略有上升并达到稳定;内外颖夹角最大时Gs值较内外颖开裂时升高52.63%,较内外颖合拢时高81.25%;开颖前1.0 h和内外颖夹角最大时的Gs值,彼此之间无差异显著性,但显著和极显著高于其他时间点。珍汕97AGs值从开颖前1.0 h至内外颖开裂时逐渐降低,而在内外颖夹角最大时又突然升得很高,之后又降低;内外颖夹角最大时Gs值较内外颖开裂时升高40.24%,较内外颖合拢时高47.44%;开颖前1.0 h、开颖前0.5 h 和内外颖夹角最大时之间以及内外颖开裂时、内外颖合拢时和闭颖后0.5 h之间均无差异显著性,但前者极显著高于后者。

图9 颖花开闭过程中颖花气孔导度的变化Fig.9 The variation of spikelet Gs in the process of spikelets opening and closing
图10L 和图10R 分别显示萍恢141 和珍汕97A 颖花自然开闭过程中颖花蒸腾速率(Tr)的变化,对各时间点Tr值进行F检验,均符合0.01<P<0.05。萍恢141Tr值在内外颖开裂之前变化不大,但在内外颖夹角最大时急剧升高,然后又逐渐降低并在内外颖合拢时达相对稳定;内外颖夹角最大时Tr值较内外颖开裂时高39.62%,较内外颖合拢时高14.91%;开颖前1.0 h、开颖前0.5 h 和内外颖开裂时彼此之间无差异显著性,内外颖夹角最大时、内外颖合拢时和闭颖后0.5 h 彼此之间无差异极显著性,但后者极显著高于前者。珍汕97ATr值在内外颖夹角最大时达最高,其他时间点Tr值变化不大;内外颖夹角最大时Tr值较内外颖开裂时高32.18%,较内外颖合拢时高13.14%;开颖前1.0 h、开颖前0.5 h、内外颖夹角最大时、内外颖合拢时和闭颖后0.5 h 彼此之间无差异极显著性,开颖前1.0 h、开颖前0.5 h、内外颖开裂时和内外颖合拢时彼此之间也无差异极显著性,但内外颖夹角最大时和闭颖后0.5 h 时均显著和极显著高于内外颖开裂时。
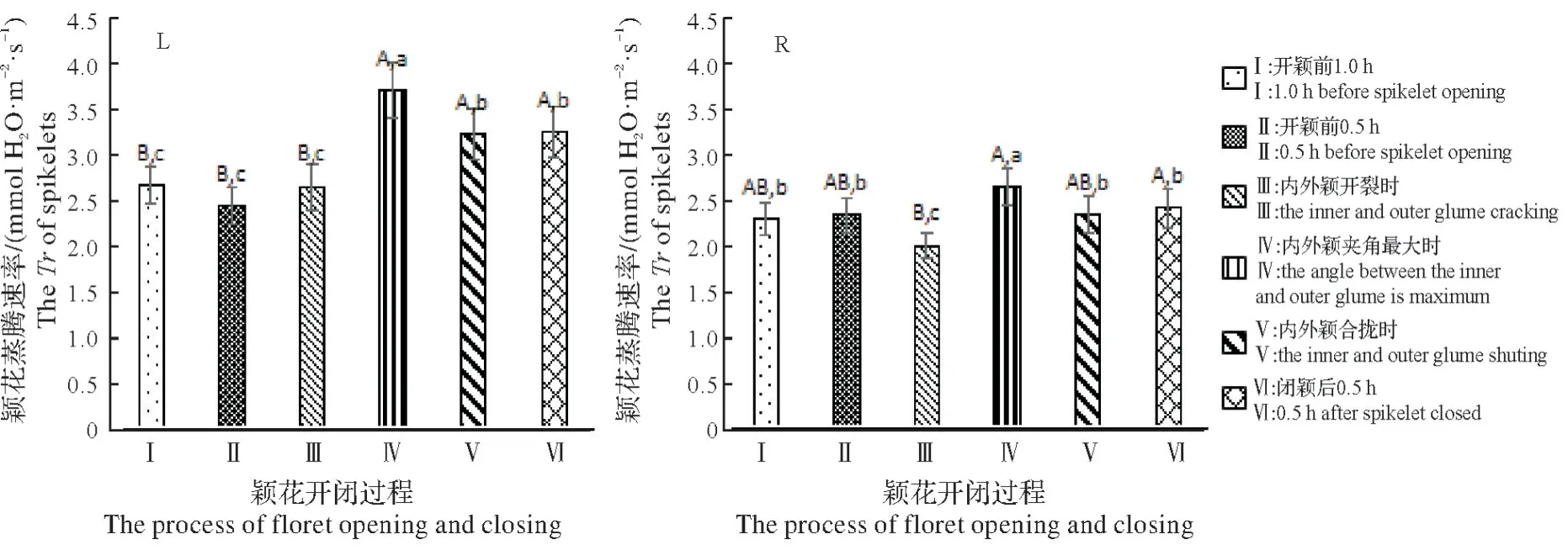
图10 颖花开闭过程中颖花蒸腾速率的变化Fig.10 The variation of spikelet Tr in the process of spikelets opening and closing
3 小结与讨论
本研究采用3 个可育和3 个不育水稻为材料,发现内外颖开裂后,如果仍然维持颖腔内较高浓度的CO2,不但不抑制颖花关闭,反而促进颖花关闭。可育水稻各材料之间、不育系水稻各材料之间在颖花关闭率和颖花开闭历时上均无明显区别,但可育与不育系水稻之间在颖花关闭率、开闭历时、Ci、Gs和Tr上却存在非常明显的差异。可育水稻在内外颖夹角最大时Ci值也最大,且极显著高于内外颖开裂时,提示高浓度的CO2可能是颖花关闭的重要因素。不育系水稻Ci最大值出现在内外颖合拢时,较可育水稻滞后,这可能就是导致不育系水稻颖花关闭慢,开闭历时长的重要原因。可育水稻和不育系水稻比较,颖花最大Gs和Tr值均出现在内外颖夹角最大时,但前者各时间点的Gs和Tr值均非常明显的要高于后者。
水稻已开颖花的关闭是一个与呼吸作用有关需要消耗能量的主动过程[8]。开颖时,小穗呼吸增强,ATP 含量增高[10]。由于不育系稻穗的呼吸强度、H2O2酶活性和颖花ATP 含量均比保持系稻穗要低,故表现出不育系水稻开颖慢,闭颖也慢。不育系水稻花药败育,呼吸速率低,颖腔内CO2浓度难以提高可能是其开颖不整齐的主要原因,外源CO2能显著加速不育系大量颖花整齐开放[11]。何永明等[12]认为不育系水稻开颖不集中、花时分散和延迟的另一个重要原因可能是缺乏花药发育信号的调控。不育系水稻颖花开放对CO2和JA 的强烈响应就证明了这一点[8,13]。CO2和JA 是诱导颖花开放的重要信号物质,而雄蕊又是水稻颖花器官中合成这2种信号分子的主要部位[10,14-15],不育系因雄蕊败育,从而颖花开放对外源CO2和JA 的响应比可育系更强烈。本研究结果尤其是外源CO2提高不育系水稻颖花关闭率揭示CO2可能也是诱导颖花关闭的重要信号物质。
Ci大小取决于叶周空气CO2浓度、叶片气孔导度、叶肉导度和叶肉细胞光合特性等。Ci与光合速率可能存在正相关、负相关和不相关的关系,但与呼吸速率呈现正相关关系[16]。空气中的CO2可以通过气孔进入叶肉细胞间隙,并溶解于液相中,在光能作用下发生光合作用,植物体内的水蒸气也可以通过气孔蒸腾到大气中。Gs的大小导致Ci增减,引起Tr升降。水稻颖花与叶片有很大的差别,颖花上没有气孔,缺乏气体进出的主要门户,但在内外颖基部的浆片上有皮孔和角质层,它们是颖花内腔和颖花细胞气体进出的途径。受皮孔和角质层结构和数量的限制,经此途径进出的气体速度较慢,数量有限,所以颖花Tr较叶片低得多,故颖花Ci的大小主要受颖花呼吸速率的影响。本研究测到颖花Ci值在内外颖夹角最大时出现较明显的高峰,显示此时呼吸速率可能较高,这对需要消耗能量的颖花关闭过程来说非常有利,提示内外颖夹角最大时高的Ci可能是颖花关闭的启动因子。不育水稻颖花关闭进程慢,开闭历时长可能与其颖花Ci极值后置且偏低有关[11,13]。
导致不育系水稻颖花关闭进程慢、开闭历时长、关闭不严、裂颖现象严重的原因可能还与其小穗轴和浆片的微管结构有关。王忠等[17-18]研究发现,每一浆片中有15~20 条小维管束,每一小维管束中具有1~5列导管、2~4列筛管和10个左右的小型薄壁细胞;小型薄壁细胞的细胞质浓,细胞器多,富含线粒体;大型和小型薄壁细胞间的胞间连丝丰富。这为浆片快速吸水和失水以及物质迅速转运所需的通道和能量提供了便利。野败型不育系稻穗开颖迟、闭颖慢的原因与其浆片中维管束数目少、导管和维管束薄壁细胞不发达有关[19]。
有趣的是,水稻颖花开闭和植物气孔开闭都对CO2和ABA 刺激敏感[20]。叶内CO2浓度低,引起保卫细胞渗透势下降,气孔张开;反之,气孔关闭[6]。研究表明,ABA 通过增加胞质Ca2+的浓度,间接地激活K+、Cl-流出和抑制K+的流入,降低保卫细胞的膨压,导致气孔关闭[21-22]。研究还认为CO2诱导开颖是由于CO2能引起浆片细胞壁酸化和糖转运体(OsSUTs)活化[23]。如果CO2只是引起浆片细胞壁酸化导致酸生长的话,那IAA 对颖花开放怎么会无促进效应呢?要深入探讨CO2对水稻颖花开闭的机制,还需从浆片内源CO2(或CO2水溶液)对颖花开闭的效应,CO2对浆片细胞水势和相关离子通道的影响,以及影响浆片CO2(或CO2水溶液)浓度升降的相关酶活性和相关蛋白基因的表达等方面去研究。
CO2气体在大田农业生产上的应用有诸多不便,如压缩气体的安全性导致包装、运输和使用方式都受到到极大限制,以及气体在大田使用时会迅速稀释导致效果不明显等。把气态CO2固化成干冰,虽可大大改善其包装、运输和使用的方式,但也只能局限在一定的密闭环境(如大棚或温室)内使用;把气态CO2溶解于水中制成CO2水溶液,以喷雾的方式在大田喷洒于颖花上,使用时准确把握使用浓度和酸碱度,选择良好天气和适当添加表面吸附剂等,则可能是最佳的使用方式,这有待于进一步研究。试验过程中对离体稻穗的剪取、搬运和置进试验装置等不可避免会受到如气候和触碰等因素的影响;试验装置对稻株高度和剪穗长度的限制也可能对结果产生不利影响;所以加强母体稻穗大田试验、选择合适高度的水稻材料、改进试验装置等研究也很有必要。
致谢:胡天星、龙启石和钟冬等同学对研究给予了帮助,谨致谢意!

