利用酵母双杂交系统筛选本氏烟中与RGSV P5互作的蛋白
熊桂红,胡昱颛,吴祖建
(1.江西农业大学 农学院/江西省薯芋生物学重点实验室,江西 南昌 330045;2.福建农林大学 植物病毒研究所,福建 福州 350002)
【研究意义】水稻草状矮化病毒(Rice grassy stunt virus,RGSV)是纤细病毒属(Tenuiviruses)的重要成员,于1963年在菲律宾首次发现,随后蔓延至南亚、东南亚、东亚等地[1]。我国台湾、福建、广东等东南沿海地区先后发现该病害,并逐渐成为水稻上的一种毁灭性病害[2-3]。近年该病害在越南等地爆发流行并给粮食产量造成巨大损失[4-5]。针对该病害的防治,目前未发现理想的抗病品种,且RGSV 的致病机制也还不清楚,尚未找到有效防治措施。因此筛选与RGSV 互作的寄主蛋白,不仅有利于解析病毒致病和寄主抗病毒等分子机制,而且将为RGSV 的防控提供新的策略。【前人研究进展】水稻感染RGSV 后主要表现植株严重矮化,分蘖增多,似杂草丛生状、后期叶片上会出现不规则形的暗褐色病斑,病株不抽穗或结实率低等症状,一旦感染,很难治愈[5-6]。RGSV 通过褐飞虱以增殖型持久性方式进行传播[7]。RGSV 全基因组包含6条ssRNA,采用双义编码策略共编码12个蛋白[8]。有研究[9-10]发现,P2和P5是该病毒的沉默抑制子,且P5 的沉默活性比P2 强。P5 能够自身互作,也能与P3 互作增强病毒的致病性[9]。植物病毒的复制、组装、运动、致病、症状形成等生物学过程都需要蛋白质的相互作用才能完成。例如,RRSV的沉默抑制子Pns6 筛选水稻cDNA 文库获得互作蛋白,且Pns6 与延伸因子OseEF1A 互作,招募、转运OseEF1A 至病毒基质处并帮助病毒在寄主体内增殖与复制[11]。水稻条纹病毒NSvc4 与叶绿体相关蛋白NbGAPDH、NbPsbQ1互作,敲除NbGAPDH-A 或NbPsbQ1均可促进RSV 感染[12]。水稻条纹病毒的运动蛋白NSvc4筛选本氏烟cDNA 文库获得互作蛋白,NSvc4 与烟草NbMIP1 家族蛋白互作抑制NSvc4 自噬降解,维持自身稳定性[13]。南方水稻黑条矮缩病毒编码的P1 蛋白是一个致瘤基因,P1 能够与植物成视网膜瘤蛋白(PBR)互作诱发细胞增生并产生瘤状突起[14]。因此研究植物病毒与寄主的互作具有非常重要的意义。筛选互作蛋白最常用、简便的方法是酵母双杂交技术,该技术不仅可以用来验证已知蛋白间的互作关系,还可以利用已知蛋白筛选与之互作的未知蛋白,有利于推测和研究互作蛋白的功能[15]。【本研究切入点】目前关于RGSV 与寄主互作鲜有报道,且RGSV 多数蛋白的功能尚不清楚。鉴于植物病毒与寄主互作的重要性,本研究拟从本氏烟cDNA文库中筛选与RGSV沉默抑制子P5互作的寄主蛋白。【拟解决的关键问题】利用酵母双杂交技术筛选文库获得与P5 互作的本氏烟蛋白,分析互作蛋白的功能,为解析RGSV的致病机制奠定基础,并为RGSV的防治提供新的方法。
1 材料与方法
1.1 试验材料
本氏烟酵母cDNA 文库、酵母菌株Y2H Gold、载体pGADT7、pGBKT7、pGADT7-T、pGBKT7-53、pGBKT7-Lam、大肠杆菌DH5α 由本实验室保存;酵母双杂交营养缺陷型培养基二缺SD/-Leu/-Trp、四缺SD/-Ade/-His/-Leu/-Trp、X-α-gal、Carrier DNA 购自Clontech(美国)公司;DNA聚合酶2×EasyPfu PCR Super-Mix、克隆载体pEASY-blunt Zero Cloning 购自全式金生物技术(北京)股份有限公司;植物总RNA 提取试剂盒、反转录试剂盒Fast Quant RT Kit、酵母质粒提取试剂盒购自天根生化科技(北京)有限公司;限制性内切酶BamHI、NdeI、T4-DNA连接酶购自NEB(美国)公司;
1.2 试验方法
1.2.1 RGSVP5基因的扩增和诱饵载体pGBKT7-P5的构建 利用植物总RNA 提取试剂盒提取感染RGSV 水稻的总RNA。以RNA 为模板反转录合成cDNA。根据RGSVP5基因序列(GeneBank:AF290947.1)设计用于酵母双杂交的引物:BD-P5-F:GGAATTCcatatgATGTCTGGCATGAATTC,BDP5-R:CGggatccCTAGACTCTAACGTAATCTG,分别加入NdeI、BamHI 酶切位点。PCR 反应体系为:ddH2O 19 µL、2×EasyPfu PCR SuperMix 25 µL、Forward/Reverse Primer(10 µmol/L)2 µL、cDNA 模板2 µL。PCR 反应程序为:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸120 s,35 个循环后,72 ℃延伸5 min。对扩增产物进行琼脂糖凝胶电泳及胶回收。回收的目的片段及酵母诱饵载体pGBKT7 用限制性内切酶NdeI 和BamHI 进行酶切。回收酶切产物并与T4-DNA 连接酶连接后转化大肠杆菌DH5α 感受态细胞。将培养的单克隆送至测序公司测序,测序正确的克隆命名为pGBKT7-P5并提取质粒。
1.2.2 诱饵载体的毒性及自激活检测 利用PEG/LiAc 法将诱饵质粒pGBKT7-P5和空载体pGBKT7 分别转化Y2H Gold 感受态细胞,涂布在SD/-Trp 平板上,30 ℃培养2~3 d,观察菌落的生长情况,若pGBKT7-P5在SD/-Trp 平板上的生长速度比对照pGBKT7慢或者不长,说明诱饵蛋白对酵母菌有毒性,反之没有毒性。将pGBKT7-P5与空载体pGADT7共转化Y2H Gold感受态细胞,同时转化阳性对照pGADT7-T/pGBKT7-53 和阴性对照pGADT7-T/pGBKT7-Lam,分别涂布在SD/-Trp/-Leu 平板上,30 ℃培养2~3 d。挑取单菌落画线于SD/-Ade/-His/-Leu/-Trp/X-α-gal 平板上,培养3~5 d,观察酵母菌的生长状况和显色情况,若P5 蛋白有自激活活性,那么pGBKT7-P5/pGADT7能在SD/-Ade/-His/-Leu/-Trp/X-α-gal上生长并显色;反之没有自激活。
1.2.3 酵母cDNA 文库的筛选 挑取含诱饵载体pGBKT7-P5的酵母单菌落制备感受态细胞。取50 µL本氏烟cDNA文库质粒,采用醋酸锂法将文库质粒转化到酵母感受态细胞中并涂布在SD/-Leu/-Trp平板上,30 ℃培养箱培养5~7 d长出单菌落。挑取单菌落溶于无菌水,稀释混匀后依次划线在SD/-Ade/-His/-Leu/-Trp 和SD/-Ade/-His/-Leu/-Trp/X-α-gal 培养基上培养,观察菌落生长状态和显色反应,筛选阳性菌落。
1.2.4 酵母质粒提取及序列分析 挑取SD/-Ade/-His/-Leu/-Trp/X-α-gal培养基上蓝变菌落接种于5 mL SD/-Leu/-Trp 液体培养基中,30 ℃ 220 rpm/min 培养2 d 后提取酵母质粒。以酵母质粒为模板,利用pGADT7载体的通用引物进行PCR 扩增。PCR 反应体系和程序同1.2.1。电泳后检测文库插入片段的大小。将酵母质粒转化到大肠杆菌DH5a 感受态细胞中进行培养,提取质粒并测序。对测序结果进行分析,用软件EditSeq分析插入序列的大小、编码框顺序、氨基酸的大小。将分析后的氨基酸序列输入NCBI数据库中进行序列比对,分析cDNA插入片段的完整性,寻找同源基因的序列信息,获得序列的基因注释和基因编号。
2 结果与分析
2.1 RGSV P5基因的扩增及酵母表达载体的构建
提取水稻毒株的总RNA,利用引物BD-P5-F/R进行RT-PCR扩增,获得一条大小约为600 bp的特异性条带,符合预期片段大小(576 bp)(图1-A)。将P5基因克隆到pEASY-blunt Zero 载体上,测序结果表明成功获得该基因。利用限制性内切酶NdeI和BamHI对该质粒进行酶切回收后连接到酵母诱饵表达载体pGBKT7 上,利用相同限制性内切酶对重组质粒进行双酶切验证,结果表明成功构建诱饵质粒pGBKT7-P5(图1-B)。

图1 RT-PCR扩增P5基因(A)和诱饵载体pGBKT7-P5(B)的酶切鉴定Fig.1 The amplication of P5 gene and digestion of pGBKT7-P5
2.2 pGBKT7-P5自激活及毒性检测
将诱饵载体pGBKT7-P5、pGBKT7(空对照)分别转化到Y2H Gold 感受态细胞中,比较两者在SD/-Trp 培养基上的生长情况,发现两者菌落均为白色,且生长情况无明显差异,含pGBKT7-P5的酵母未比空对照生长缓慢,表明P5 蛋白对酵母菌没有毒性(图2-A,图2-B)。将诱饵质粒pGBKT7-P5与捕获载体pGADT7 共转化到Y2H Gold 中,同时分别转化阳性和阴性对照,比较3 组含重组质粒的酵母在SD/-Leu/-Trp 和SD/-Ade/-His/-Leu/-Trp/X-α-gal 培养基上的生长和显色情况,发现3 组酵母菌均能在SD/-Leu/-Trp 培养基上生长(图2-C),但仅阳性对照可在SD/-Ade/-His/-Leu/-Trp/X-α-gal 上生长并显色(图2-D)。说明P5没有自激活活性,可用于酵母互作验证及文库筛选。

图2 诱饵载体pGBKT7-P5的毒性和自激活检测Fig.2 Detection of toxicity and auto-activation of pGBKT7-P5
2.3 文库筛选与互作蛋白的鉴定
将本氏烟cDNA 文库质粒转化到含诱饵载体pGBKT7-P5的酵母感受态细胞中,转化产物涂布到SD/-Leu/-Trp、SD/-Ade/-His/-Leu/-Trp 和SD/-Ade/-His/-Leu/-Trp/X-α-gal 培养基上进行依次筛选,得到15个生长良好且显蓝色的菌落(图3)。将这15个菌落分别挑至SD/-Leu/-Trp 液体培养基培养2 d 后提取质粒。以酵母质粒为模板,利用pGADT7 载体的通用引物进行PCR 扩增(图4)。将PCR 扩增条带大于500 bp,且条带单一的质粒转化大肠杆菌并送至测序公司测序。对所得的测序结果先利用EditSeq 软件进行序列分析,确定插入文库中的序列大小、编码框顺序和氨基酸大小。将分析后的氨基酸序列在NCBI 数据库中进行Blast 分析,最后获得7个与RGSV P5互作的寄主蛋白,分别为线粒体孔蛋白(mitochondrial outer membrane protein porin,VDAC)、ADP 核糖基化因子GTP 水解酶激活蛋白(ADP-ribosylation factor GTPase-activating protein,ArfGAP)、囊泡突触结合蛋白(synaptotagmin-1-like)、延伸因子1a(elongation factor 1-alpha,NbeEF1A)、脯氨酸合成酶共转录的细菌同源蛋白(Proline synthase co-transcribed bacterial homolog protein-like)、非特征蛋白质C9orf78(uncharacterized protein C9orf78 isoform X2)和一种未知蛋白(表1)。

表1 与RGSV P5互作的7个候选蛋白Tab.1 Seven candidate proteins that interacted with P5 of RGSV

图3 SD/-Ade/-His/-Leu/-Trp/X-α-gal培养基筛选与P5互作的阳性克隆Fig.3 Screening positive clones by SD/-Ade/-His/-Leu/-Trp/X-α-gal interacting with P5
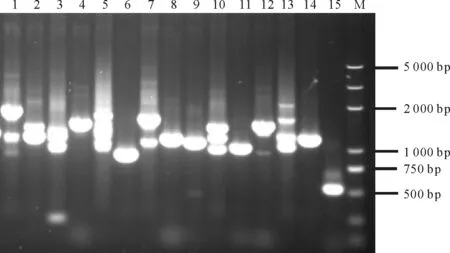
图4 阳性克隆的检测Fig.4 PCR detection of positive clones
3 结论与讨论
水稻草状矮化病是水稻上发生严重的病毒病,至今无有效的防治方法。研究水稻草状矮化病毒与寄主的互作,为深入解析RGSV 病毒的致病机制,为水稻草状矮化病毒的防治奠定基础。本研究成功筛选到了7 个与RGSV P5 互作的寄主蛋白,它们都具有重要的生物学功能,可能参与寄主抗病防御、病毒复制、运动和致病等过程。
植物病毒的侵染会诱导寄主抗病毒RNA 沉默,而绝大多数的植物病毒能编码RNA 沉默抑制子抑制沉默。许多病毒的沉默抑制子陆续被鉴定。如RSV 编码的P2、NS3 蛋白均具有RNA 沉默抑制活性,P2与水稻OsSGS3 互作干扰水稻的RNA 沉默途径,NS3 通过自身互作抑制RNA 沉默,从而对抗宿主防御[16-18]。瓜类褪绿黄化病毒(CCYV)的RNA1 编码的P22 蛋白是一个局部RNA 沉默的抑制因子[19]。豌豆轻型褪绿病毒(PMCV)编码的P0 蛋白具有沉默抑制子活性,P0 促进AGO1 的降解以抑制RNA 沉默[20]。柑橘黄花叶病(CMBV)具有6 个开放阅读框,而其中的ORFI 被鉴定具有RNA 沉默抑制活性[21]。P5 是RGSV 的沉默抑制子,能够抑制寄主对病毒的沉默[9]。因此本试验以P5蛋白为诱饵,筛选本氏烟酵母cDNA文库,以期获得互作的寄主蛋白,为该病毒防治提供策略。
本试验成功筛选到了7 个与RGSV P5 互作的寄主蛋白,分别为VDAC、ArfGAP、Syt-2、eEF1A、C9orf78、PROSC 和一种暂无注释蛋白。VDAC 是电压依赖性阴离子通道蛋白,存在于真核生物线粒体外膜上,具有高度保守性[22]。VDAC 在调控线粒体与细胞质之间的代谢物质流动、ATP 合成和细胞死亡中具有重要的作用[23-25]。有研究[26]表明VDAC 参与抗逆、植物防御等,且受多种胁迫的诱导表达。如水稻VDACs1-3受到渗透、NaCl和干旱胁迫上调表达。烟草线粒体孔蛋白NtVDAC1和NtVDAC2受非寄主菌菊苣假单细胞菌(Pseudomonas cichorii)的诱导表达,将该基因抑制或沉默,降低烟草对非宿主菌的抗性,表明VDAC 参与了对非宿主病原体的防御和bax 介导的细胞死亡[27]。VDAC 与P5 互作可能在植物抗病中发挥重要的作用。eEF1A 是一个转录延伸因子,有很多研究表明eEFA1 在负链RNA 病毒的复制中发挥重要作用,促进病毒翻译、复制、侵染等过程。Komoda 等[28]发现加入eEF1a 抑制剂会降低番茄斑萎病毒(TSWV)的RNA 合成活性,降低TSWV 的侵染,表明eEF1A 在TSWV 的RNA 合成中起着重要作用。沉默烟草eEF1a 基因家族的一个分支能显著抑制TSWV 的积累和症状的发展,也表明eEF1A 基因有利于TSWV 的发生[29]。eEF1A-a1、eEF1A-a5 与TSWV NSm 蛋白互作可能参与病毒的复制[30]。推测RGSV 与eEF1A的互作也可能参与病毒的复制。
Syt 是一个广泛存在于神经和内分泌细胞内的分泌囊泡上的蛋白质家族[31]。在动物中,Syt 不仅可以调节囊泡与靶膜的融合过程,调控神经递质和激素的释放,还能够调节细胞的蛋白质与膜的转运[32]。拟南芥的SYTA 蛋白能够调节胞吞和改变胞间连丝促进病毒的胞间运动[33-34]。例如SYTA 与芜菁脉明病毒(TVCV)的运动蛋白MP 互作,MP 将内质网上的SYTA 招募到胞间连丝上,MP、SYTA 和TVCV 共同形成复制复合体,有利于病毒的运动[35]。P5 与囊泡突触蛋白Syt-2 互作可能参与病毒的胞间运动。
ArfGAP 是一种囊泡运输调节因子,在膜转运中发挥着重要的作用[36]。Zhang 等[37]从水稻中克隆了1 个ArfGAP 基因OsAGAP,并推测OsAGAP 通过调控水稻中的囊泡运输,影响生长素的极性运输。烟草的1 个GAP 蛋白NbRabGAP1 参与了竹子花叶病毒(Bamboo mosaic virus,BMV)的胞间运动[38]。红三叶草坏死花叶病毒(RCNMV)的复制蛋白P27 可以与Arf1 互作并在内质网上形成大的点状结构。利用Arf1 的交换因子的抑制剂会破坏病毒复制复合体的组装及P27 介导的内质网重构,影响RCNMV 的复制[39]。推测P5 与ArfGAP 的互作参与病毒的复制和运动。由此可见,研究RGSV P5 与寄主蛋白的互作具有重要的生物学意义。本研究为解析寄主抗病和RGSV 致病的分子机制提供理论基础,为RGSV 的防治提供参考。
致谢:江西省教育厅基金项目(GJJ170293)同时对本研究给予了资助,谨致感谢!

