4种天然产物对福寿螺肝脏和头足酶活性的影响
岑小凤,李晶晶
(广西卫健委全生命周期健康与保健研究重点实验室/广西环境暴露组学与全生命周期健康重点实验室/桂林医学院公共卫生学院,广西 桂林 541199)
【研究意义】福寿螺(Pomacea canaliculata)隶属于瓶螺科(Ampullariidae)福寿螺属,原产于南美洲亚马逊河流域,是世界性恶性入侵物种[1]。在2003 年被我国国家环保总局将其列入首批入侵我国的16 种外来物种的“黑名单”[2]。福寿螺取食容易,导致田间水稻幼苗死亡,并因其繁殖快、繁殖量大等特点给水稻等农作物种植和生态环境带来严重危害和影响[3-4]。除此之外,福寿螺还是人类广州管圆虫(Angiostrongylus cantonensis)自然感染或实验室感染的中间宿主,该线虫的幼虫能侵犯人体中枢神经系统,引发嗜酸性粒细胞增多性脑膜脑炎或脑膜炎[5-6]。关于福寿螺的防治方法主要有物理防治、化学防治以及生物防治法[7],化学防治仍是主要的防治手段,但缺乏安全性好、杀螺效果佳的防螺药物。虽有较多的文献报道植物提取物对福寿螺的杀灭效果,但较少研究涉及其有效成分对福寿螺的杀螺活性和作用机制的研究[8]。【前人研究进展】目前,对植物源杀螺剂的作用机理研究主要集中在酶活性方面,包括能量代谢相关酶、转氨酶、神经信号传导酶、磷酸酶以及氧化应激相关酶[9-15]。近年来,蛋白组学和转录组学技术被用于研究福寿螺的抗药机制和免疫保护机制。牟希东等[16]利用iTRAQ 蛋白质组技术发现,杀螺剂四聚乙醛会引起氨基酸、赖氨酸等代谢紊乱、破坏细胞结构组成和肌肉收缩,引起免疫应答,造成细胞凋亡和神经毒性。Yu等[17]通过蛋白组学分析表明,齐墩果酸的胁迫导致福寿螺肝脏葡萄糖代谢、能量合成和蛋白质合成的中断,并触发了一系列分子通路,其中包含许多参与免疫过程的关键蛋白。Xiong等[18-20]利用转录组学技术分析发现,脂多糖干预后福寿螺氧化反应和解毒作用相关基因表达的显著上调。槲皮素(quercetin)、木犀草苷(luteoloside)、芹菜素(apigenin)和香草酸(vanillic acid)均为多酚类化合物,在植物中含量丰富。国内外对这4种化合物的生物活性研究主要在抗癌、抗肥胖、抗糖尿病、抗菌、抗炎和抗氧化等药理活性[21-24]。【本研究切入点】在前期研究[25]中笔者首次报道了白肉榕叶乙醇提取物对福寿螺的毒杀活性,以及牛耳枫叶甲醇提取物的抑菌活性和杀虫活性,并从上述两种提取物中分离鉴定出包括香草酸、芹菜素、槲皮素和木犀草素[26-27]在内的10余种化合物。然而,除槲皮素外,这些化合物对福寿螺的毒杀作用至今未见研究报道,其杀螺作用机理仍不清楚。【拟解决的关键问题】本研究旨在研究槲皮素、木犀草苷(木犀草素衍生物)、芹菜素和香草酸胁迫对福寿螺的存活率,福寿螺肝脏中谷丙转氨酶(glutamic-pyruvic transaminase,ALT/GPT)、谷草转氨酶(glutamic-oxalacetic transaminase,AST/GOT)活性,福寿螺头足中乙酰胆碱酯酶(acetylcholinesterase,AChE)、一氧化氮合酶(nitric oxide sythase,NOS)活性的影响,并通过RT-qPCR 技术测定福寿螺肝脏和头足中相关基因的表达量,初步探讨其作用机理,以期从中寻找具有开发潜力的植物源杀螺剂先导化合物。
1 材料与方法
1.1 试验材料
供试福寿螺:采自广西农业科学院桂北分院桂林市农业科学院。采集的福寿螺用自来水清洗干净其表面后,投放入到装有去氯水的容器中,于室温(25±2)℃,湿度(60%±5%)条件下饲养7 d后,选用螺壳表面无损伤、大小一致的福寿螺用于试验研究。
试剂及仪器:芹菜素、香草酸、槲皮素和木犀草苷标准品,纯度均≥98%,北京鼎国昌盛生物技术有限责任公司;茶皂素原粉(60%),中国农科院茶叶研究所;BCA 蛋白浓度测定试剂盒(增强型),碧云天生物技术有限公司;ALT/GPT 试剂盒、AST/GOT 试剂盒、AChE 试剂盒、NOS 试剂盒购于南京建成生物工程中心;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)以及原肌球蛋白(tropomyosin,TM)引物,广州维伯鑫生物科技有限公司;Trizol Reagent,美国ambion 公司;Thermo RevertAid First Strand cDNA Sythesis Kit、ABI PowerUPTMSYBRTMGreen Master Mix,美国Thermo Fisher Scientific 公司;其余试剂为国产分析纯。101A-1E 型电热恒温鼓风干燥箱,上海实验仪器有限公司;L600台式低速自动平衡离心机,湖南湘仪实验室仪器开发有限公司;Varioskan LUX User Manual Chinese 酶标仪、NanoDrop 2000、实时荧光定量PCR 仪,美国Thermo Fisher Scientific公司;分析天平,上海精科天美科学仪器有限公司。
1.2 方法
1.2.1 4 种天然产物溶液的配置 分别准确称取一定量的槲皮素、木犀草苷、芹菜素和香草酸,用适量甲醇溶解后加入去氯水配制成100 mg/L 的溶液(甲醇含量不超过2%),以相同含量的甲醇去氯水做空白对照。
1.2.2 福寿螺室内毒杀活性测定 参照WHO 室内药剂浸泡法[28],选择口径大小相近的福寿螺,随机分为6组,分别为空白组、茶皂素组(对照药剂)、槲皮素组、木犀草苷组、芹菜素组和香草酸组。用烧杯盛放500 mL药液,每杯放入20头幼螺,放入菜叶作为其食物,杯口用纱布封口以防其逃逸。施药后24 h观察和记录福寿螺死亡情况。实验开始时首先挑选出已经明显开口死亡的福寿螺个体,对于一直都紧闭螺壳的福寿螺个体,可以选择洗去表面药物后放于清水中,浮上水面或者悬浮于水中30 min 后,用镊子尖端轻轻插进厣甲与螺壳间隙无任何反应的则为死螺[28]。观察后及时记录福寿螺的死亡个数,并计算福寿螺的校正死亡率。
1.2.3 福寿螺肝脏和头足酶活性的测定 在药剂处理24 h后随机取6只活福寿螺,去壳后取出福寿螺的肝脏和头足部分,用滤纸吸干福寿螺组织表面的水分,存置于-80 ℃储存备用。分别称取0.5 g福寿螺肝脏和头足组织,按福寿螺组织质量1∶9 的比例,加入0.9%的生理盐水,肝脏组织用微量电动匀浆器于4 ℃匀浆,头足组织采用20 mL 玻璃器研磨,将两者待测组织匀浆离心分离(4 ℃,3 500 r/min,15 min),然后取上清液采用BCA 蛋白浓度测定试剂盒测定福寿螺肝脏和头足中蛋白质浓度,参照试剂盒说明书分别测定福寿螺肝脏中的ALT/GPT、AST/GOT的酶活性,以及头足中AChE、NOS的酶活性。
1.2.4 福寿螺肝脏和头足中基因相对表达量的测定 参照Trizol 操作说明书提取福寿螺组织中的RNA,然后用NanoDrop 2000 测定RNA 的浓度和纯度,使用逆转录试剂盒将RNA 逆转录为cDNA,作为RT-qPCR 模板。设计特异性引物,选择a-tubulin 作为内参基因,每个样品的内参及目的基因做3 个复孔。RT-qPCR 反应体系为:1 µL cDNA 模板,上下游引物各0.5 µL(10 µmol/L),SYBR Green Master Mix 12.5 µL,dd 水10.5 µL,总体积25 µL。PCR 反应程序:50 ℃初始变性2 min,95 ℃变性2 min,95 ℃ 15 s,60 ℃ 15 s,72 ℃ 1 min,共40 个循环。相对定量采用2-△△Ct法,其中△△Ct=(Ct目的基因,槲皮素组-Ct内参基因,槲皮素组)-(Ct目的基因,空白组-Ct内参基因,空白组)。
1.3 数据分析
采用Excel 2010 和SPSS 25.0 进行数据处理和统计分析。计量资料使用“平均数±标准差”表示。多组间采用One-Way ANOVA 进行差异分析,方差检验齐性用LSD 法,方差不齐性用Games-Howell 法检验;两组间采用独立样本T检验。以P<0.05表示有统计学意义。
2 结果与分析
2.1 4种化合物对福寿螺的毒杀作用
槲皮素、木犀草苷、芹菜素和香草酸处理后的福寿螺死亡情况见表2。在100 mg/L 浓度下,处理24 h后,槲皮素的杀螺活性最好,福寿螺死亡率达到45%,其次为木犀草苷27.3%和芹菜素23.5%,最后为香草酸12.0%。

表2 4种化合物对福寿螺死亡率的影响Tab.2 Effects of four compounds on the mortality rate of P.canaliculata
2.2 4种化合物对福寿螺肝脏两种转氨酶活性的影响
如图1所示,与空白相比,槲皮素、木犀草苷、芹菜素、香草酸处理后,福寿螺肝脏中的ALT/GPT 酶活性均显著下降(P<0.05),分别降低了72.9%、58.9%、66.8%、66.5%。而福寿螺肝脏中AST/GOT 酶活性均显著高于空白组(P<0.05),分别升高了115.5%、103.8%、70.5%和88.2%。
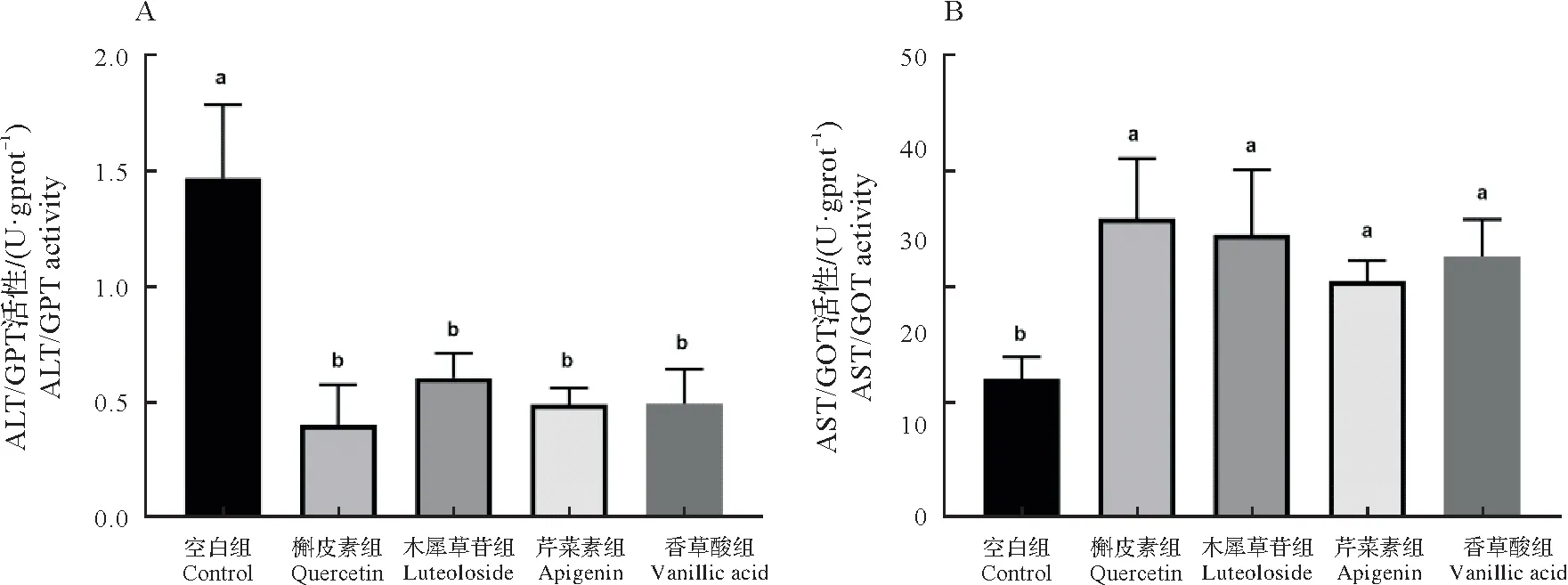
图1 4种化合物对福寿螺肝脏ALT/GPT(A)、AST/GOT(B)酶活性的影响Fig.1 Effects of four compounds on the activities of ALT/GPT(A)and AST/GOT(B)in the liver of P.canaliculata
2.3 4种化合物对福寿螺头足两种酶活性的影响
槲皮素、木犀草苷、芹菜素、香草酸处理后,与空白相比,福寿螺头足中AChE 酶活性分别下降了43.9%、29.6%、24.8%和42.2%,均显著低于空白组(P<0.05)。福寿螺头足中NOS 酶活性显著下降(P<0.05),分别比空白组降低了55.9%、38.8%、37.9%和30.2%(图2)。

图2 4种化合物对福寿螺头足AChE(A)、NOS(B)酶活性的影响Fig.2 Effects of four compounds on the enzyme activities of AChE(A)and NOS(B)in the head-foot of P.canaliculata
2.4 槲皮素处理后福寿螺肝脏SOD、CAT、IDH的mRNA相对表达量
如图3所示,与空白组相比,槲皮素处理下福寿螺肝脏中SOD、CAT的相对表达量显著升高(P<0.05),而IDH的相对表达量显著降低(P<0.05)。
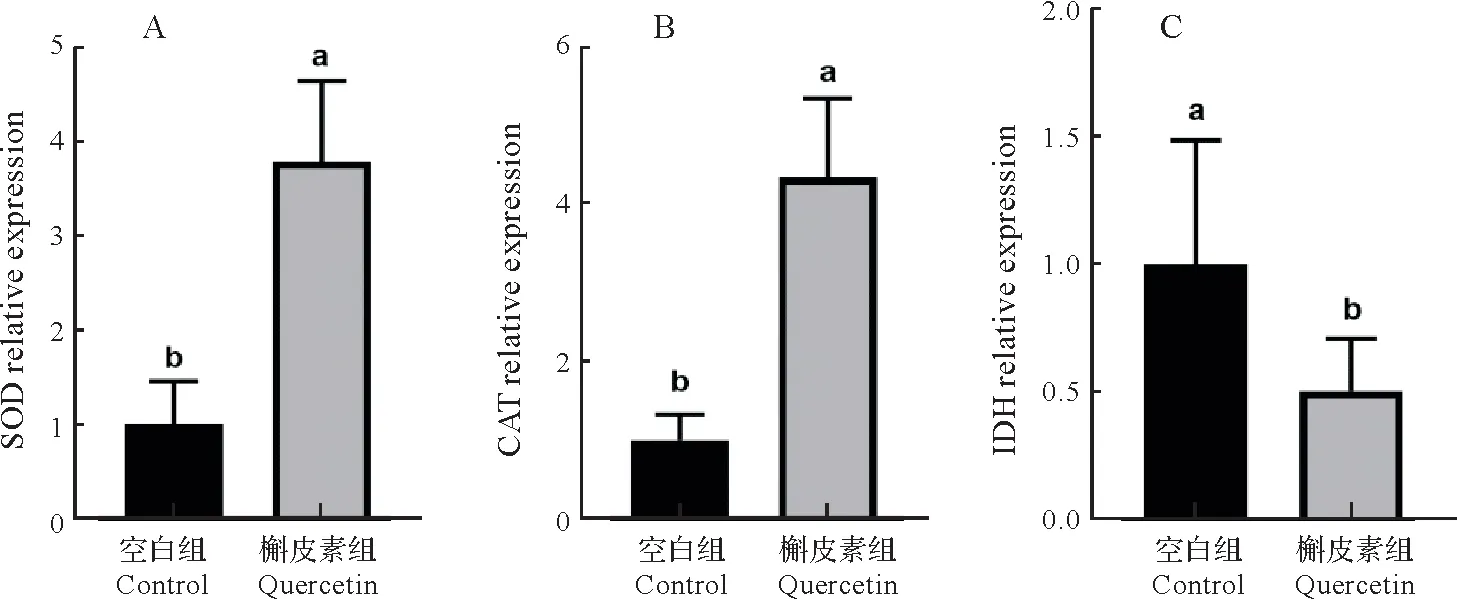
图3 槲皮素对福寿螺肝脏SOD、CAT、IDH相对表达量的影响Fig.3 Effects of quercetin on relative expression levels of SOD,CAT and IDH in the liver of P.canaliculata
2.5 槲皮素处理后福寿螺头足SOD、CAT、TM的mRNA相对表达量
图4可见,槲皮素处理后,与空白组相比,福寿螺头足中SOD的相对表达量显著升高(P<0.05),而TM的相对表达量显著降低(P<0.05)。

图4 槲皮素对福寿螺头足SOD、CAT、TM相对表达量的影响Fig.4 Effects of quercetin on relative expression levels of SOD,CAT and TM in the head-foot of P.canaliculata
3 讨论与结论
肝脏是福寿螺解毒的重要器官,其解毒过程涉及到ALT/GPT和AST/GOT这两种重要的转氨酶,这两种转氨酶与蛋白质代谢密切相关[29]。其中ALT/GPT 还涉及能量产生的相关途径,尤其是三羧酸循环,AST/GOT 酶活性的高低与肝细胞损伤严重程度呈正相关[30]。本研究中经槲皮素、木犀草苷、芹菜素和香草酸4种天然产物处理后,福寿螺肝脏中ALT/GPT 酶活性均显著降低,而福寿螺肝脏中AST/GOT 活性均显著升高。其趋势与鱼腥草生物碱[31]、白头翁皂苷[32]和槟榔碱[33]对钉螺的杀螺实验结果一致。说明4 种化合物可能通过影响福寿螺肝脏的蛋白质和能量代谢而致其死亡。
福寿螺头足位于螺体的前端,集中着大量的神经元,是最先接触到药液的组织,也是受损最严重的部位。乙酰胆碱是生物体中重要的神经递质,AChE 作为水解乙酰胆碱的一种酶,在头足表皮分布较多[7],主要参与神经递质传递和物质代谢,是神经细胞功能和性质的重要指标。在银杏叶提取物[33]、槟榔碱[34],以及氯硝柳胺[35]、灭螺酯[36]等化学杀螺剂处理钉螺后,观察到AChE活性下降。本研究发现,经过4种天然产物处理后,福寿螺头足的AChE 活性明显降低,而AChE 活性降低将会导致水解乙酰胆碱的速度减慢,乙酰胆碱在突触间隙堆积,此时突触后膜会持续性兴奋,导致福寿螺的头足麻痹,外周神经和以神经为主的腺体生理功能紊乱,最终造成螺的死亡[14,37]。
NO 是一种新型神经递质,可作为信号分子参与软体动物的运动调节,是生物体内常见的第二信使[35,38],而NOS 是催化NO 生物合成的唯一限速酶,研究表明[39],当NOS 活性降低时,NO 合成受阻,神经传递受到抑制。本研究结果显示,经过4种天然产物处理后,福寿螺头足中NOS活性下降,与李洪军[40]等使用氯硝柳胺悬浮剂对钉螺的浸杀实验发现NOS 活性受到抑制的结果一致。表明4种天然化合物可能通过干扰神经递质的传递,降低福寿螺肌肉运动能力,使福寿螺头足不能闭合,以增加福寿螺与药剂的接触面积,最终导致福寿螺个体的死亡。
课题组研究发现槲皮素对福寿螺存活率和酶活性的影响最为明显,因此对槲皮素的杀螺作用机制开展进一步研究。SOD 和CAT 可以防止活性氧自由基对机体中生物大分子的氧化损伤,对清除氧化胁迫过程中产生的活性氧自由基起着决定性作用[41],SOD、CAT活性的改变,可以反映生物体在不同胁迫条件下的生理状况[42]。IDH 是三羧酸循环中的限速酶[43],TM 能调控肌钙蛋白复合物和肌动蛋白之间的相互作用,起到调节肌肉收缩的作用[44]。本研究RT-qPCR 检测结果显示,经槲皮素处理后,福寿螺肝脏和头足中的SOD、CAT 的mRNA 表达上调,而肝脏中IDH 和头足中TM 的mRNA 表达水平降低。表明槲皮素能引起福寿螺的氧化应激反应,影响福寿螺正常能量代谢和肌肉运动功能。
天然活性化合物库的分子结构多样性是新药物开发的源泉。据统计,目前已确定具有生物活性的天然产物在20 万种以上,其中有生物活性的植物天然产物有10 万种,占所有天然产物的一半[45]。植物源杀螺药物具有低毒、易降解等优点,利用植物次生代谢产物成功防治有害生物的例子很多,如印楝素、鱼藤酮、烟碱等植物源农药已市场化很多年,在田间广泛使用。然而,目前已成功推广应用的植物源杀螺药物极少,研究与开发新的植物源杀螺剂,具有极其广阔的市场前景。槲皮素、木犀草苷、芹菜素和香草酸是广泛存在于植物的根、茎、叶中。在前期筛选的植物中,白肉榕和牛耳枫都具有开发成为植物源农药的潜力,笔者从中分离出了与这些植物防治效果一致的活性化合物,开发高效安全的杀螺药物可能性很大。
综上所述,本研究结果表明槲皮素、木犀草苷、芹菜素和香草酸可以降低福寿螺肝脏中ALT/GPT 的活性,升高AST/GOT 的活性,影响福寿螺肝脏组织的正常生理功能;同时抑制福寿螺头足神经系统中AChE、NOS的酶活性,影响福寿螺头足的正常神经递质传导。RT-qPCR 测定结果表明,经槲皮素处理后福寿螺肝脏中SOD、CAT 酶的mRNA 表达量和头足中SOD 酶的mRNA 表达量上升,肝脏中IDH 酶和头足中TM 的mRNA 表达量下降。这些为4种天然产物在防治福寿螺方面的应用提供了一定的实验依据,但其具体作用机制仍有待进一步研究。

