王台产卵育王技术对西方蜜蜂蜂王质量的影响
黎长龙,刘一博,王守程,何旭江,2*,刘光楠,袁 芳
(1.江西农业大学 蜜蜂研究所,江西 南昌 330045;2.江西省蜜蜂生物学与饲养重点实验室,江西 南昌 330045;3.江西省石城县农业农村局,江西 赣州 342700;4.江西省养蜂研究所,江西 南昌 330052)
【研究意义】蜜蜂是重要的授粉昆虫,为全球85%以上农作物授粉,在维护生态平衡和粮食安全方面发挥着重要作用[1-3]。同时,蜜蜂也是重要的经济昆虫,为人类提供营养丰富的蜂产品[4]。然而,2006年以来全球各大洲均出现“蜂群衰竭失调症(Colony collapse disorder,CCD)”,导致大量蜜蜂离奇死亡,其中蜂王质量下降是主要因素之一[5-6]。近年来,蜜蜂又面临着过冬时期高死亡率的问题。北美地区蜂群数据统计显示,其冬季损失率已经高达48%[7]。我国虽然没有出现CCD 和越冬蜂高死亡率现象,但蜂王质量也有不断下降的迹象。如今,杀虫剂、气候变化以及寄生虫和疾病的传播等,也威胁着蜜蜂的生存与繁衍[8]。因此,如何提高蜂王质量,提升蜂群的生存与繁衍能力已成为养蜂业的焦点问题。培育优质的蜂王对养蜂业发展具有重要意义。正鉴于此,本研究通过开发并应用王台产卵育王技术培育优质蜂王,并对该技术所培育蜂王的质量进行评估。【研究进展】蜜蜂蜂王专职产卵,它是蜂群中唯一生殖器官发育完全的具有繁育能力的雌性个体,是整个蜂群的核心,在蜂群发展中具有决定性的作用[9-10]。而前人研究发现,蜜蜂群势的强弱除了受外界环境条件影响,蜂王质量的优劣也会对蜂群产生重要影响[11-12]。蜂王质量的高低对蜂群的生长与发展非常重要,它决定了后代蜂群的生存能力、免疫能力,以及蜂群的产量和蜂产品质量[13]。从1568 年Nickel Jacob 利用自然王台成功育王,到1888 年Doolittle[14]总结育王经验并著《科学育王法》,蜜蜂人工移虫育王技术在全球范围内得到广泛传播与应用。这种传统的育王方式是利用移虫针移取工蜂巢房中的小幼虫(1~2 d)至王台培育蜂王。然而,有研究表明,蜂王浆所含成分如糖类、维生素、氨基酸、蛋白质和核酸等方面均与工蜂浆不同,且蜂王幼虫比工蜂幼虫获得更多的食物[15-20]。本团队前期研究发现,利用工蜂巢房卵所培育的F2 蜂王质量显著高于人工移虫育王所培育的F2 蜂王,且与发育、繁殖与免疫相关基因的甲基化水平会发生明显改变[21]。易瑶等[22]报道了人工移虫育王不仅会降低蜂王质量,其引起的甲基化变化还可以累代遗传。最新研究表明,蜜蜂蜂王会在王台中产更大更优质的卵,所培育的蜂王初生重等指标也显著高于工蜂巢房卵和工蜂幼虫培育的蜂王[23]。本团队前期基于蜂王在王台中产更大更优卵的生物学特性,研发了蜜蜂王台产卵育王技术及设备[24]。【本研究切入点】蜜蜂的育王方式不同对蜂王发育和质量的影响也不同,从而影响整个蜂群的生长与繁衍。某些蜜蜂育王技术,例如通过人工移取工蜂巢房幼虫的方式培育蜂王,会显著降低蜂王的质量[21-22]。与此同时,通过检测蜂王的形态指标、卵巢管数等生理指标和关键基因表达等分子指标来评估蜂王的质量,可较好地评估蜜蜂育王技术的优劣性。本团队前期研发了蜜蜂王台产卵育王技术,但尚未对该技术所培育的蜂王质量水平进行有效评估。【拟解决的关键问题】研究拟利用形态学分析、组织切片技术和实时荧光定量qRT-PCR 技术,比较分析蜜蜂王台产卵育王和人工移虫育王技术所培育蜂王的发育水平、繁殖性能和免疫能力等方面进行评估,为该技术在蜜蜂优质育种中的应用提供科学基础,在保护蜜蜂这种重要的授粉昆虫和促进养蜂业发展方面具有重要意义。
1 材料与方法
1.1 试验蜂群
本研究共选取了6 群群势较强(10 足脾)的西方蜜蜂(Apis mellifera),均来自江西农业大学蜜蜂研究所的饲养蜂群。
1.2 试验器材与试剂
1.2.1 试验主要器材 DHI 型恒温恒湿培养箱(中国上海埃开仪器设备有限公司),ME204 型电子分析天平(瑞士METTLER TOLEDO 公司),WSI 型蜜蜂形态指标测定系统(中国重庆奥特光学仪器有限公司),OPTPro 型体式显微镜(中国重庆奥特光学仪器有限公司),TP1020 型自动组织脱水机(德国徕卡公司),HistoCore Arcadia H 型包埋机(德国徕卡公司),HistoCore Arcadia C 型冷凝机(德国徕卡公司),Model RM2245 型石蜡切片机(德国徕卡公司),KD-H 型摊片机(中国浙江科迪仪器设备有限公司),KD-P 型烘片机(中国浙江科迪仪器设备有限公司),Autostainer XL 染色器具(德国徕卡公司),DP80 型显微镜(中国奥林巴斯有限公司),AG R404A 型离心机(德国艾本德生命科技公司),T100 型反转录仪器(美国伯乐公司),QuantStudio⑤型qRT-PCR 仪器(美国赛默飞世尔科技公司),蜡盘,解剖针,手术剪,尖口镊子,铁质、塑料包埋盒,载玻片与盖玻片,中性树脂,载玻片和盖玻片,计数器,移液枪,灭菌枪头,96 孔荧光定量板以及封口膜等。
1.2.2 试验试剂 4%多聚甲醛固定液,无水乙醇,二甲苯,石蜡,伊红染液,苏木精染液,R6734 型RNA 提取试剂盒(美国Omega公司),巯基乙醇,RR047A反转录试剂盒(北京宝日医生物技术有限公司),RR420A型荧光定量试剂盒(北京宝日医生物技术有限公司)。

图1 王台产卵育王设备与蜂王全景图Fig.1 The physical panorama of queen and queen-cell egg laying device
1.3 王台产卵育王设备
采用本团队前期研发的蜜蜂王台产卵育王技术及方法进行优质蜂王培育试验[24]。
1.4 育王方式
1.4.1 王台产卵育王 参考袁芳等[25]试验方法,先将产卵器与王台等喷洒50%糖水,放入蜂群中清理1 d。然后把蜂王关入产卵器,控制在王台区域产卵。待F1蜂王在王台内产卵后,将王台转移至育王框上,放入已调整出哺育区域的继箱中培育F2 蜂王。记录王台产卵率。产卵率=产卵数/王台总数×100%;幼虫接受率=幼虫存活数/产卵总数×100%;出房率=处女王出房数/产卵总数×100%,试验重复3次。
1.4.2 人工移虫育王 参考庞倩等[26]试验方法,以2 日龄(孵化后48 h)的工蜂幼虫作移虫育王,移入和王台产卵育王相同的王台,并与王台产卵育王的王台放置在一起培育F2蜂王,以此作对照组。
1.5 蜂王数据测定
1.5.1 初生质量的测定 蜂王出房后会因进食和水分丧失等出现体质量变化,且蜂群内蜂王出房时为方便取样与测取数据,所以试验时在蜂王出房的前一天,将育王框或封盖王台等,转移至恒温恒湿培养箱。每隔30 min观察F2 蜂王出房情况,在F2蜂王出房半小时内利用分析天平称取蜂王初生质量。试验组和对照组各测定8只F2蜂王。
1.5.2 形态指标测定 参考Reeves 等[27]试验方法,利用蜜蜂形态指标测定系统分别测定两种F2 蜂王前翅长和前翅宽、后翅长和后翅宽、胸长和胸宽等形态指标。两组蜂王个体形态和卵巢切片样品测定各含8个生物学重复。
1.6 卵巢切片、染色及观察计数
参考改进甘海燕等[28],陈品素等[29],卢凤兰等[30]试验方法,取材:F2 蜂王出房并培育3 d 后(卵巢发育较好),解剖显微镜下进行解剖,取其腹部,并除去卵巢之外的消化道、中肠以及蜜囊等。
固定:将蜂王躯体装入盛有1 mL 4%多聚甲醛固定液的1.5 mL EP 管内,常温状态下4 h 或者4 ℃状态下12 h。经此固定后,蜂王卵巢表现为聚拢状,借助尖镊能稳定取出。根据Jackson[31]关于蜜蜂卵巢管数的标准测定方法,将右侧卵巢转移至塑料包埋盒中。为防止卵巢在下一个试验环节中从塑料包埋盒漏出,在卵巢外周裹一层纱布,保护卵巢不丢失,脱水时的蜡液也能透入包埋盒。
脱水:将处理好的塑料包埋盒放置在自动组织脱水机内,进行脱水处理。
包埋:经自动组织脱水机处理后的卵巢,转移至包埋机。将卵巢垂直包埋在铁质包埋盒中,以获得清晰的卵巢管横截面。盖上塑料包埋盒另一半(底部),然后迅速放入冷冻机中进行冷凝。待温度降下之后,分离塑料包埋盒底座与铁质包埋盒,此时的包埋样品可放置在4 ℃冰箱保存。
切片:石蜡组织块安置在切片机上,调整刀片角度以及刀片与蜡块的距离,切取7~9 µm 的切片。然后用镊子夹取切片,正面平铺在40 ℃的摊片机水面中进行加温摊片,使切片完全展开。直至切取到在显微镜下能清晰见到卵巢管的切片,而后在42 ℃的烘干机中烘干3 h。
染色并封片:烘干后带有卵巢切片的载玻片,经过HE染色程序处理。取出载玻片,并滴树脂进行盖玻片封片,以防止二甲苯挥发导致切片组织颜色变黑。
封片在通风机下通风1 d,并静置3 d后,在显微镜下观察F2蜂王右侧卵巢形态组织并拍照计数。
1.7 基因水平检测
1.7.1 RNA 提取 参考Deng 等[32]试验方法,取两种F2 蜂王的头部。分别放入EP 管,每管1 个头,放入液氮迅速冷冻处理和保存。两组蜂王各含3 个生物学重复。根据Omega 公司的RNA 提取试剂盒指导方法提取样品总RNA:每管样品加入350 µL 的GTC-buffer(1 mL 的buffer 中加入20 µL 的巯基乙醇),研磨捣碎,匀浆。将DNA结合柱套入2 mL离心管中,把裂解液转移到柱子,13 000 r/min离心1 min,滤液用于RNA 提取。向滤液中加入0.5 倍体积的无水乙醇,涡旋15 s 混匀,然后转移到RNA 结合柱的管中,13 000 r/min 离心1 min。再将结合柱套入新的收集管,加入500 µL 的RNA Wash BufferⅠ,13 000 r/min离心1 min,弃滤液。结合柱重新套回收集管,加入500 µL 的RNA Wash Buffer Ⅱ,13 000 r/min 离心1 min,弃滤液,然后重复此步骤1 次。RNA 结合柱套回收集管,14 000 r/min 离心空甩柱子2 min。将RNA 结合柱套入新的1.5 mL 离心管中,加入40 µL 提前水浴加热至70 ℃的DEPC-treated water,室温孵育5 min。室温下离心1 min,然后将离心下去的DEPC-treated water 吸取上来并打回结合柱,重复洗脱,提高RNA提取产量,获得样品总RNA。
1.7.2 反转录 参考Deng等[33]试验方法,选用Takara 反转录试剂盒,并建立20 µL 体系进行反转录。先去除基因组DNA反应1(42 ℃,2 min;表1),在冰上配制以下反应混合液,加入RNA样品。进行反转录反应2(37 ℃,15 min;85 ℃,5 s;表1),同样在冰上配制以下反应混合液,加样然后按照反应条件进行即可获得cDNA。
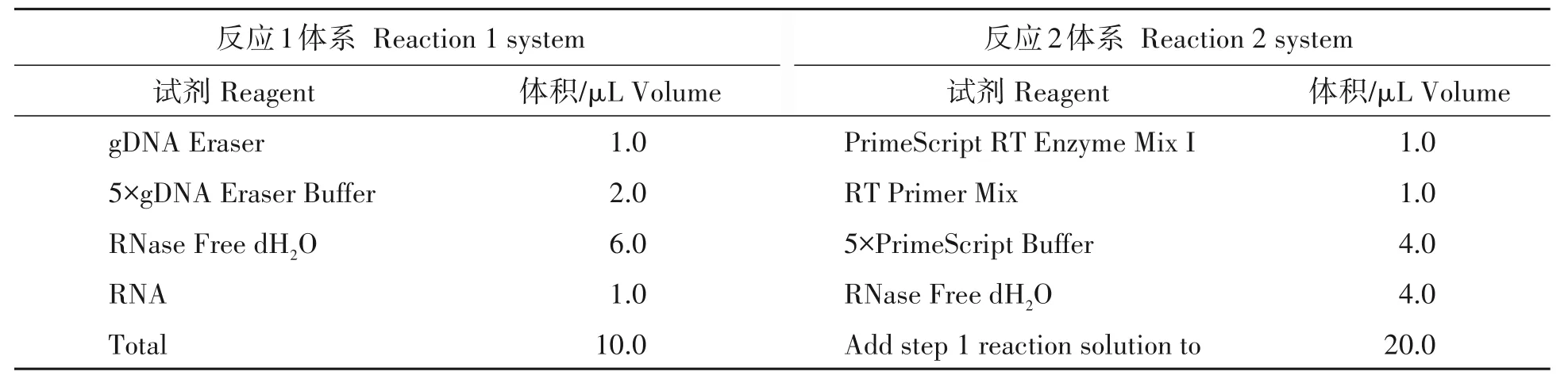
表1 反转录试验的反应液体系Tab.1 Reaction fluid system for reverse transcription experiments
1.7.3 基因引物设计选取 根据参考文献[34-38]选取Antimicrobial peptide gene defensin-1(Defensin1)、Juvenile hormone acid methyltransferase(Jhamt)、Honey bee hexamerin110(Hex110)和Cytochrome P450 monooxygenase(CYP)家族中的CYP9Q1。Defensin1基因反映蜜蜂的免疫能力[34],Jhamt基因被证实与蜂王的级型分化有关[35],Hex110基因影响蜂王的卵巢发育[36],CYP9Q1基因则关系到蜜蜂解毒性能[37-38]。因此试验选择这4 种基因进行荧光定量分析。在NCBI 上查询相关基因编号和基因序列,各基因编号分别为Defensin1:LOC 406143;Jhamt:LOC 724216;Hex110:LOC 551648;CYP9Q1:LOC410492。以GAPDH(LOC410122)为内参基因,在Primer 5 软件上设计引物序列(表2),由上海生工生物工程股份有限公司合成。
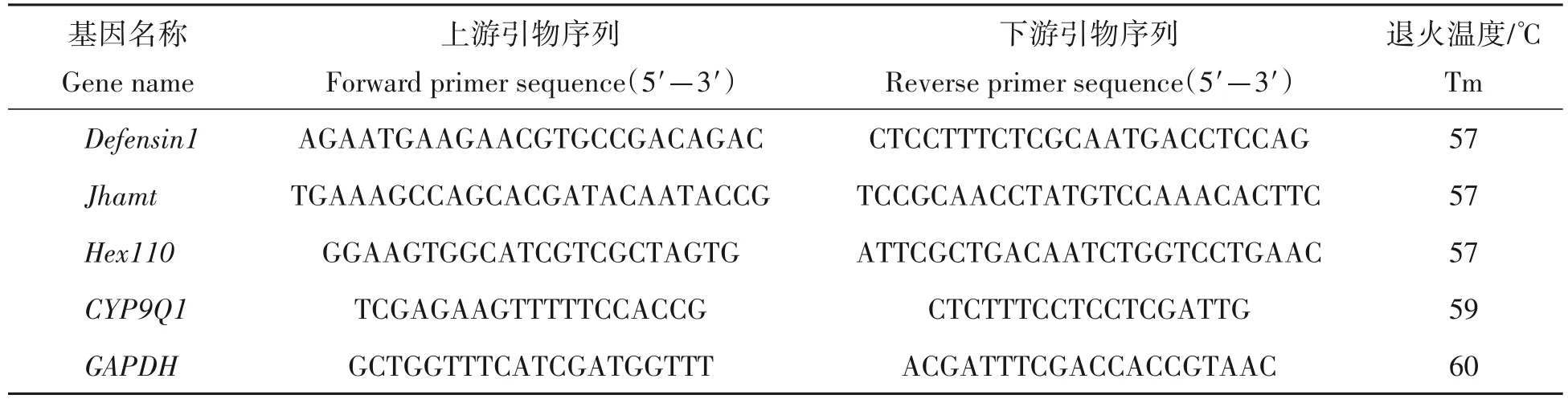
表2 实时荧光定量PCR的各基因引物信息Tab.2 Primer sequences of each gene in quantitative real-time PCR
1.7.4 qRT-PCR 反应条件 荧光定量反应体系如表3所示,PCR扩增反应条件:95 ℃预变性5 min;94 ℃变性2 min,60 ℃退火45 s,72 ℃延伸15 s,循环40 次;72 ℃终延伸10 min。RT-qPCR 试验每组样品含7 个生物学重复,并且每个cDNA样品进行3次技术重复。

表3 实时荧光定量qRT-PCR的反应液体系Tab.3 Reaction fluid system in quantitative real-time PCR
1.8 数据处理
基因相对表达量数据使用2-ΔΔCT进行计算,其中Defensin1、Jhamt、Hex110和CYP9Q1作为目的基因,GAPDH为内参基因。相对表达量以及卵巢管数等各项测定数据在检验其为正态分布后,采用STATVIEW分析软件中的ANOVA分析和Fisher’s PLSD方法检验进行方差分析,P<0.05为差异显著。
2 结果
2.1 王台产卵育王与人工移虫育王的幼虫接受率与出房率
表4表明,蜜蜂王台产卵育王的蜂王接受率随幼虫日龄的增长而下降。王台产卵育王的幼虫接受率与处女王出房率均显著低于人工移虫育王(P<0.05)。
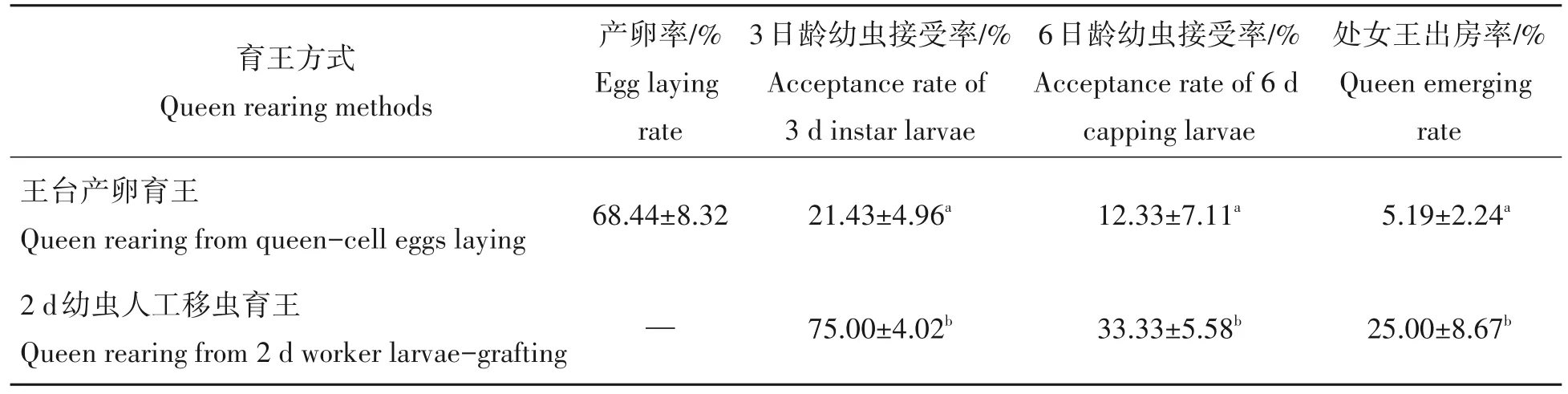
表4 王台产卵与人工移虫育王的王台幼虫接受率与出房率Tab.4 The acceptance and emerging rates of queen cells from the queen-cell egg laying and 2 d worker larva-grafting
2.2 王台产卵育王与人工移虫育王方式蜂王的初生重比较
图2 表明,利用蜜蜂王台产卵育王所培育的F2 蜂王初生质量(249.03±19.02)g 显著高于人工移虫育王(221.76±18.59)g的蜂王(P<0.05)。
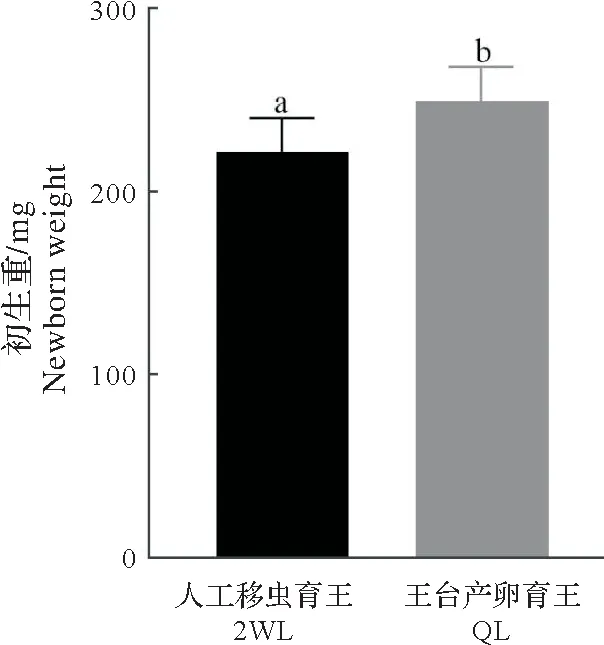
图2 王台产卵与人工移虫育王蜂王的初生重比较Fig.2 Comparison of newborn weight of queens from the queen-cell egg laying and 2d worker larva-grafting
2.3 王台产卵育王与人工移虫育王方式蜂王的形态指标比较
图3所示,王台产卵育王F2代蜂王的前翅长和后翅长显著长于人工移虫育王F2代蜂王(P<0.05),而前翅宽、后翅宽、胸长和胸宽则没有显著差异(P≥0.05)。
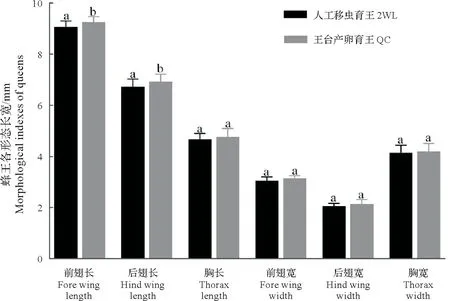
图3 王台产卵与人工移虫育王蜂王的形态指标比较Fig.3 Comparison of morphological indexes of newly emerged queens from the queen-cell egg laying and 2 d worker larva-grafting
2.4 王台产卵育王与人工移虫育王的卵巢管数比较
图4所示,王台产卵育王的F2代蜂王右侧卵巢的卵巢管数(164.80±12.70)显著高于人工移虫育王的F2代蜂王(137.25±13.35,P<0.05)。
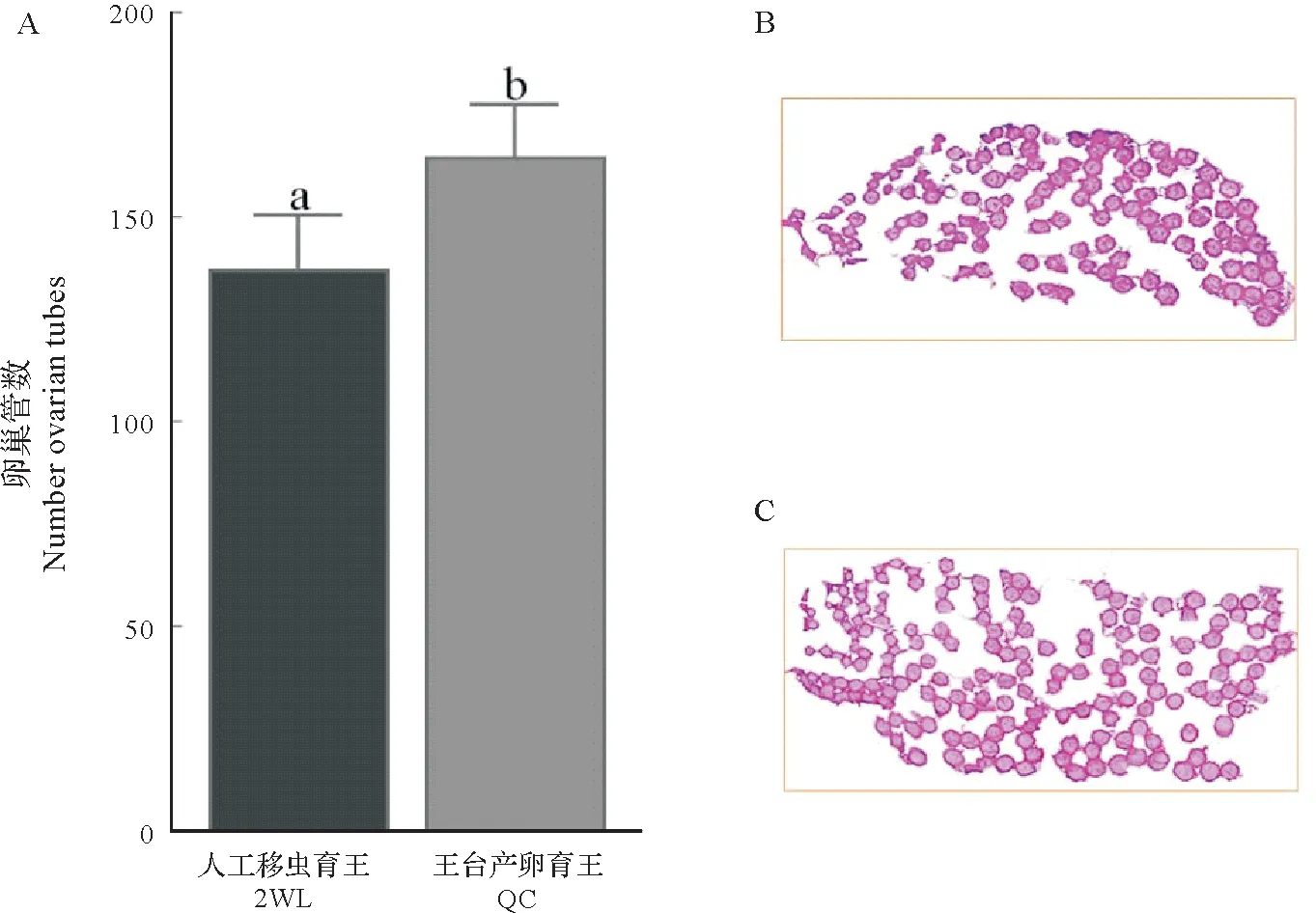
图4 王台产卵与人工移虫育王蜂王的右卵巢管数比较Fig.4 The ovariole number(right side ovary)of queens from the queen-cell egg laying and 2 d worker larva-grafting
2.5 王台产卵育王与人工移虫育王蜂王的4种基因表达量比较
图5 所示,Defensin1、Jhamt与Hex110基因在王台产卵育王F2 代蜂王的表达量显著高于人工移虫育王F2代蜂王(P<0.05),而CYP9Q1基因表达量则差异不显著(P≥0.05)。
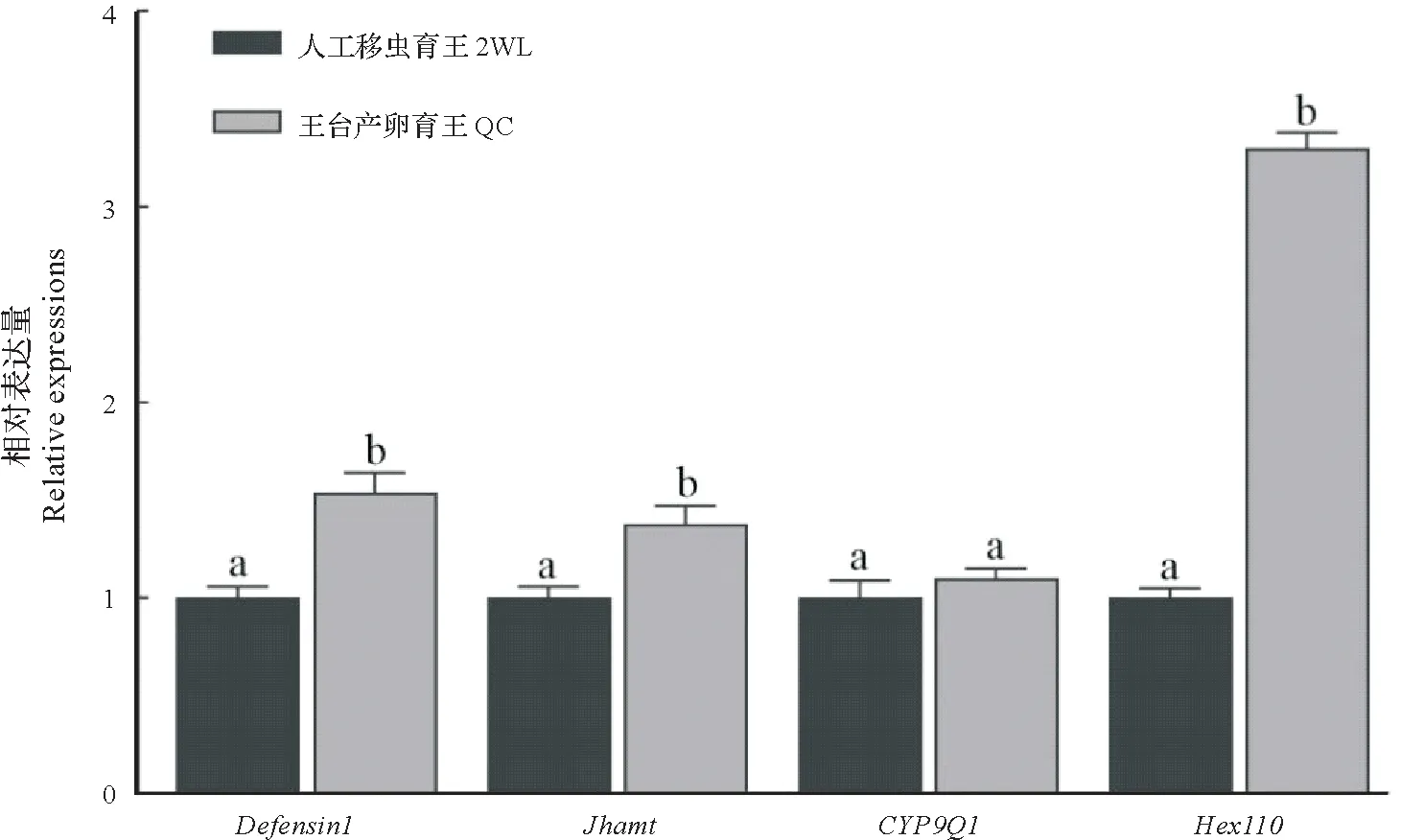
图5 王台产卵与人工移虫育王蜂王的4种基因表达量比较Fig.5 The expression of four genes in queens from the queen-cell egg laying and 2 d worker larva-grafting
3 讨论与总结
蜂王是影响蜜蜂蜂群生产的首要因素,在养蜂业中起重要作用[39]。尤其是在全球蜜蜂面临着疾病、寄生虫、环境污染等诸多挑战的情况下[5-6,8],如何培育出高质量的蜂王显得尤为重要。本研究在前期开发的蜜蜂王台产卵育王技术基础上,对该技术所培育蜂王的个体发育、繁殖性能和免疫能力等方面进行了评价和分析。结果表明,蜜蜂王台产卵技术培育的蜂王初生重、前翅长和后翅长均显著高于人工移虫育王技术培育的蜂王(图2、图3),王台产卵育王蜂王右侧卵巢的卵巢管数显著多于人工移虫育王蜂王(图4)。这是因为蜜蜂的母体效应,王台中的卵含有更丰富的营养物质,有利于蜂王幼虫的发育成长[22-23]。蜂王卵巢管数是评价蜂王生殖能力的一个重要指标,卵巢管数目越多,则越有利于其性成熟,增加产卵数量,同时也会使封盖子脾面积增大[40]。因此,采用蜜蜂王台产卵育王技术可以显著地改善蜂王的个体发育和生殖性能。
此外,Defensin1基因是反映蜜蜂免疫能力的关键基因,其多肽可以对抗革兰氏阳性细菌感染[34]。结果显示,人工移虫育王培养的蜂王中,Defensin1基因的表达水平相对较低,而在王台产卵育王的F2 蜂王中,该基因的表达水平相对高,表明王台产卵育王F2 蜂王的免疫功能更加强大,防御系统更加完善。Jhamt基因则被证实与蜂王的级型分化有关,它的主要作用是防止变态发育和调节生殖成熟[35]。试验结果显示,Jhamt基因表达量在王台产卵育王的F2 蜂王中含量更高,证明其细胞分化机理更成熟。而Hex110基因主要作用是储备幼虫向成虫发育时所需的氨基酸物质,前人研究证实该基因家族是影响蜂王卵巢发育的关键基因[36]。而本研究的结果表明王台产卵育王F2代蜂王具有比对照组蜂王更多的卵巢管数,这极可能与其体内高表达的Hex110等关键基因相关。试验结果发现参与蜜蜂解毒相关功能的CYP9Q1基因[37-38]则未出现明显的差异表达,说明王台产卵育王技术对蜂王解毒相关的能力可能没有潜在影响。总之,本研究发现3 个关键基因(Defensin1、Jhamt、Hex110)在王台产卵育王的蜂王体内表达显著高于人工移虫育王培育的蜂王(图5),表明王台产卵育王技术培育的蜂王在个体发育、生产性能及其免疫能力等方面,均优于人工移虫育王。
然而,蜜蜂王台产卵育王的接受率显著低于人工移虫育王(表4)。这可能与蜂王的产卵特性有关。蜂王在繁殖季节在自然王台中产约10~20 个受精卵,培育后代蜂王[41]。本研究中,蜂王在塑料王台中产卵欲望较低,且王台中产受精卵的数量极可能会受到蜂群限制。同时,试验中还发现,季节对蜂王的王台产卵特性也有较大的影响。因此,蜂王在王台中产卵的内在机制与生物学特性仍需进一步深入研究,进而提高蜜蜂王台产卵育王的接受率。
利用先进的方法培育优质蜂王是促进蜂群健康和养蜂业发展的重要保证。然而,沿用了上百年的人工移虫育王技术不断地降低蜂王的质量,逐渐暴露出了各种弊端,对蜜蜂这一重要的授粉昆虫的生存与繁衍带来诸多不利影响[21-22]。本团队研发的蜜蜂王台产卵技术充分利用了蜜蜂的母体效应对蜂王发育的促进作用。利用王台中高质量的受精卵培育蜂王可显著提高蜂王的质量,其个体发育水平、繁殖性能和免疫力等均显著优于人工移虫育王所培育的蜂王。为培育优质、高产和抗病力强的高质量蜂王提供了技术支持。如能长期利用该技术进行优质蜂王的培育,将可扭转人工移虫育王对蜜蜂带来的不利影响,从而不断促进蜜蜂蜂群的健康与发展。该育王技术可广泛应用于蜜蜂育种与生产领域,不断提高蜂群的生存与繁衍能力,以及抵御诸多环境挑战的能力,为促进养蜂业的发展提供技术支持,同时在保护和利用蜜蜂这一宝贵的资源方面具有重要意义。

