锁阳儿茶素生物合成途径相关基因的分析
张倩倩,李冰圳,王智,冯晓宇,姬佳诚,陈贵林
(1内蒙古大学 生命科学学院,内蒙古 呼和浩特 010020;2内蒙古自治区中蒙药材规范化生产工程技术研究中心,内蒙古 呼和浩特 010020;3牧草与特色作物生物学教育部重点实验室,内蒙古 呼和浩特 010020)
锁阳(Cynomoriumsongaricum),为锁阳科、锁阳属、多年生的全寄生草本植物,又名铁棒槌、地毛球、乌兰高腰(蒙语),是中药和蒙药中的常用药物,具有补肾阳、益精血之功效,常用于治疗阳痿精虚、大便燥结等[1]。近年研究结果表明,锁阳具有多种药理活性,如抗肿瘤、抗氧化、抗病毒等[2-5]。锁阳广泛分布于我国内蒙古、新疆、甘肃、青海、宁夏等地区[6]。我国分布的锁阳多寄生于蒺藜科(Zygophyllaceae)白刺属植物的根部。
黄酮类化合物是普遍存在于植物中的一类次生代谢物,也是药用植物锁阳中的重要活性成分,具有抗氧化、抗炎等多种生理功能[7-8]。黄酮类化合物的合成是苯丙烷代谢途径的1个分支,经多种酶催化合成,如苯丙氨酸解氨酶(Phenylalamineammonia-lynsey,PAL)、肉桂酸羟化酶(Cinnamate4-hydroxylase,C4H)和查尔酮合酶(Chalconesynthase,CHS)等。儿茶素是由黄酮代谢途径合成,具有重要的药理活性,可以作为锁阳的指标性成分[9-10]。
锁阳在自然条件下的繁殖率不高,在种子脱落后会经历持续的沙埋过程,并在适宜的生长条件下完成锁阳种子萌发、吸器发育及器官形成等几个生长发育阶段,通常需要4—6年才能完成从寄生到出土的过程[11-12]。不同生育期锁阳中鞣质、淀粉和蛋白质等营养成分的含量呈现出不同的变化趋势[13-14]。无霜期、全年日照时数和年平均蒸发量等环境因子对锁阳有效成分的积累也具有明显影响[15]。此外,有研究表明结实期是蒽醌类和三萜的最佳收获期,类黄酮化合物则在出土前期含量最高[16]。锁阳的代谢组学数据表明,肉质茎和花序之间有280种差异代谢物,花序中黄酮醇和黄烷酮等化合物更丰富[17]。
目前,关于锁阳的研究主要集中在药理活性等方面,尚未完成基因组测序,对于其儿茶素生物合成途径的研究更是未见报道。锁阳肉质茎是其主要的入药部位,锁阳花序则被丢弃,造成了资源的极大浪费。因此,本研究利用转录组技术,对不同发育阶段的锁阳不同部位中黄酮类生物合成途径相关基因进行分析,以揭示儿茶素生物合成的分子机制。本研究为濒危药用植物锁阳生物功能基因的挖掘及利用提供了理论基础,对于锁阳资源的综合利用及其采收期的确定具有重要意义。
1 材料与方法
1.1 植物材料
在内蒙古自治区鄂尔多斯市杭锦旗独贵塔拉镇(E 108°74′,N 39°84′)采集锁阳。选择锁阳2个发育阶段的不同部位作为试验材料,即未成花锁阳的茎上端(Cy-1)和茎下端(Cy-2),以及成花锁阳的花序(Cy-3)、茎上端(Cy-4)和茎下端(Cy-5),见图1。每组样本3个生物学重复。将锁阳去除须根后用蒸馏水洗净,用干净的毛巾吸干其表面水分后,放置于-80 ℃超低温冰箱内保存。上述样品中,一部分用于转录组测序,另一部分用于儿茶素含量的测定。
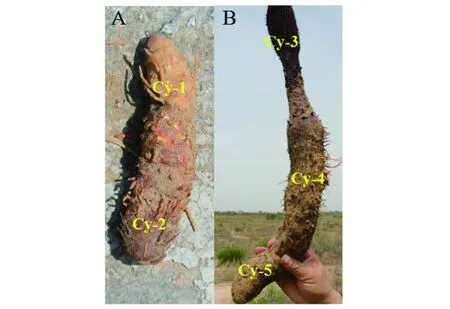
图1 锁阳的不同发育阶段以及不同部位Figure 1 Different developmental stages and different parts of C. songaricum注:A是未成花;B是成花后。Cy-1是茎上端;Cy-2是茎下端;Cy-3是花序;Cy-4是茎上端;Cy-5是茎下端。
1.2 文库构建及测序
使用pBIOZOL试剂盒提取锁阳总RNA。cDNA文库构建及测序由华大基因完成。通过Illumina HiSeqTM 2000测序平台,得到Raw reads,经筛选过滤获得Clean reads。使用TGICL和Trinity软件进行组装,形成Unigene[18-19]。
1.3 基因功能注释及表达量分析
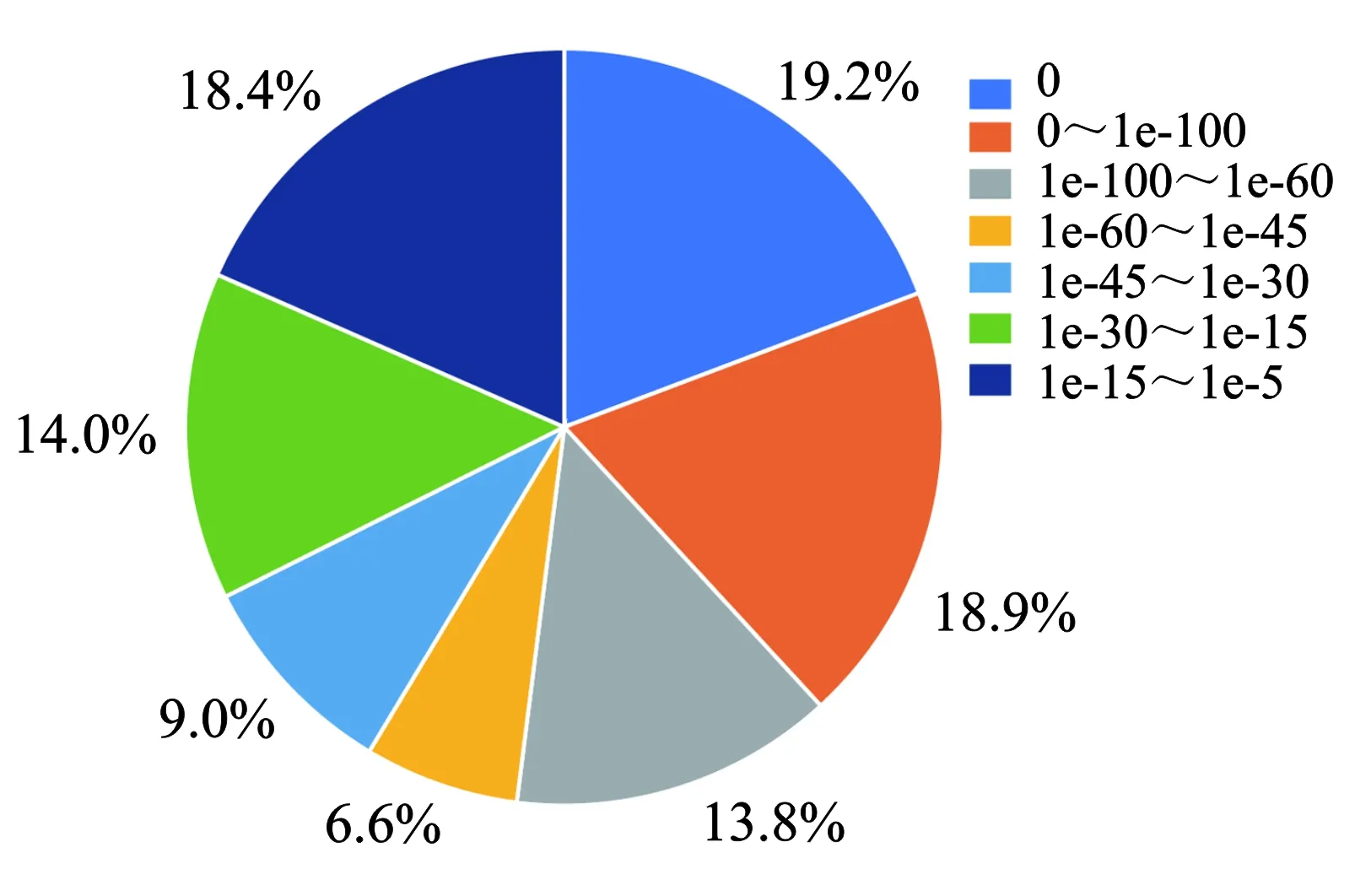
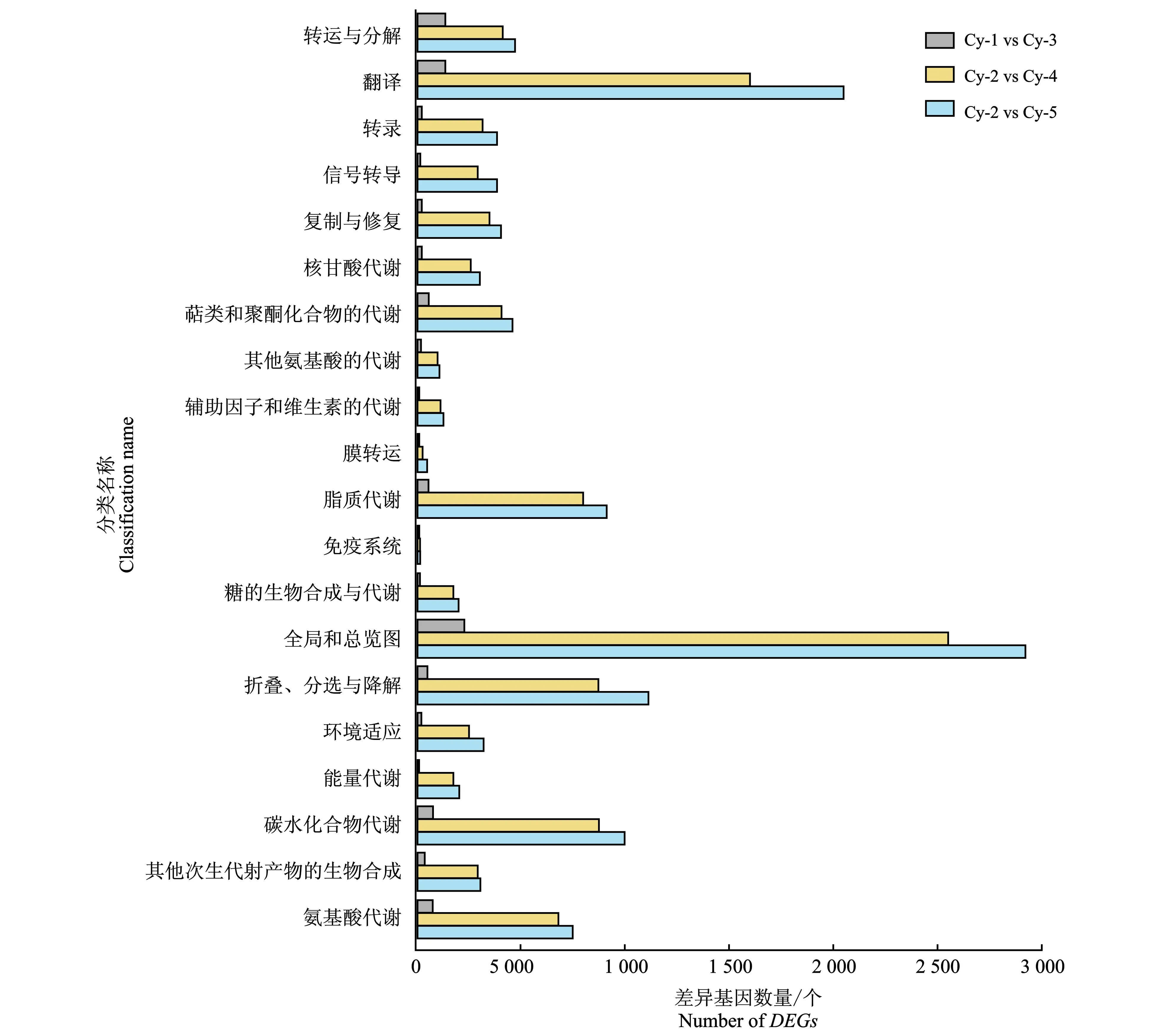
将Unigene序列比对到数据库Nt、Nr、KEGG、COG和Swiss-Prot,根据条件E-value 使用软件SOAP和FPKM (Fragments per kb per million fragments)值计算Unigene的表达量。对错误发现率(False discovery rate,FDR)≤0.001且倍数差异在2倍以上的基因进行差异表达分析[20]。 1.4.1 色谱条件 岛津Prominence LC-20A高效液相色谱仪(日本)测定,色谱柱:ODS柱(C18,250 mm×4.6 mm,5 μm),流动相为0.04 mol/L枸橼酸溶液-N, N二甲基甲酰胺-四氢呋喃(50∶4∶1),流速为1.0 mL/min,柱温为35 ℃,进样量为20 μL,检测波长为280 nm[9,21]。 1.4.2 标准曲线制作 称取儿茶素标准品适量,加50%甲醇配制成164 μg/mL对照品溶液,进样量依次为1、4、8、12、16、20 μL。依照上述色谱条件测定。以峰面积为纵坐标,进样量为横坐标,绘制标准曲线,回归方程为y=107 108x-105 6.4,R2=0.999 8。 1.4.3 供试品溶液 将锁阳粉末过100目筛,称取0.8 g置于250 mL圆底烧瓶中,加入100 mL的95%乙醇回流提取40 min,过滤,取滤液。将残渣加入100 mL 95%乙醇再次回流提取20 min,过滤,合并滤液,减压浓缩蒸干,加50%甲醇溶解并定容到25 mL容量瓶中,过0.45 μm滤膜,待测[21]。每个处理重复3次。 使用软件SPSS 19.0进行数据分析,运用单因素方差分析(ANOVA)比较不同处理间的差异显著性(P<0.05),采用EXCEL统计数据和绘图。 对未成花锁阳的茎上端(Cy-1)、茎下端(Cy-2)以及成花锁阳的花序(Cy-3)、茎上端(Cy-4)和茎下端(Cy-5)进行Illumina测序,分别得到52 665 054条、55 323 034条、54 656 940条、54 272 468条、52 882 120条Clean reads。转录组测序和组装数据,见表1。 表1 测序和组装数据的总结Table 1 Summary of the sequencing and assembly 由表1可知,组装后在各样本中分别获得51 360、77 540、62 181、75 830、86 702个Unigenes,共获得106 626个Unigenes。获得序列的Q20值均大于98%,GC含量均大于46%。通过BLAST分析后,分别有59 547、46 362、32 466、33 609、21 040、39 939个Unigenes在Nr、Nt、Swiss-Prot、KEGG、COG和GO数据库获得注释。 锁阳Unigene 在Nr数据库的注释结果,见图2。 (a)序列相似度分布图 由图2可知,有41.4%的Unigenes的同源性较低(le-45 将筛选出来的差异表达基因(DEGs)进行GO分析,共有318 909个差异基因得到注释,锁阳不同发育阶段、不同部位之间的差异基因数量不同。在生物学过程分类中,注释到较多基因的词条主要有“细胞过程(Cellular process)”“代谢过程(Metabolic process)”“单一生物过程(Single-organism process)”等;在细胞组分分类中,与“细胞(Cell)”“细胞器(Organelle)”“细胞部分(Cell part)”“膜(Membrane)”等相关的基因较多;在分子功能分类中,注释到较多基因的词条主要包括“催化活性(Catalytic activity)”“结合(Binding)”“转运活性(Transporter activity)”等,与“结构分子活性(Structural molecule activity)”相关的基因数量也较多。结果表明,这些途径在锁阳发育过程中发挥着重要作用。 锁阳各部位中差异表达基因的数量及其表达情况,见图3。 图3 锁阳中差异表达基因的数量Figure 3 Number of differential expressed genes in C. songaricum 由图3可知,通过比较同一发育阶段的不同部位(Cy-1 vs Cy-2、Cy-3 vs Cy-4、Cy-3 vs Cy-5、Cy-5 vs Cy-4)和同一部位不同发育阶段(Cy-5 vs Cy-2、Cy-4 vs Cy-2)的DEGs表达量发现,在Cy-1 vs Cy-2、Cy-3 vs Cy-4和Cy-3 vs Cy-5中,下调基因数量均高于上调基因数量,而在其他样本中均表现为上调基因数量高于下调基因数量。在Cy-5 vs Cy-2、Cy-4 vs Cy-2中上调和下调表达的基因数量均较多,且在Cy-1 vs Cy-2、Cy-3 vs Cy-4中较少。与其他样本相比,Cy-3 vs Cy-1、Cy-4 vs Cy-2、Cy-5 vs Cy-2中的上调基因数量较多,说明与出土前相比,锁阳在出土后大量基因表达上调。结果表明,在锁阳的不同发育阶段,茎中的基因表达量始终较高,且成花锁阳的整体基因表达量比未成花锁阳高。 锁阳不同发育阶段的差异表达基因在KEGG中的通路注释情况,见图4。 图4 基于KEGG通路分析锁阳不同发育阶段的差异表达基因Figure 4 Analysis of differential expressed genes in different developmental stages of C. songaricum based on KEGG pathway 由图4可知,将差异表达基因进行KEGG通路分析,对于不同发育阶段来说,各组样本均在“全局和总览图”中的DEGs最多,主要包括次生代谢产物的生物合成,此外,翻译过程、氨基酸代谢、碳水化合物代谢、脂质代谢以及折叠、分选与降解途径也注释到较多的差异基因。各组样本之间注释到较多基因的通路大体相同,只在数量上有差异,Cy-5 vs Cy-2中注释到的基因数量最多,Cy-1 vs Cy-3中注释到的基因数量最少。结果表明,锁阳在不同发育阶段中,次生代谢产物的生物合成、翻译过程、氨基酸代谢、碳水化合物代谢等过程十分活跃,对锁阳的生长发育起着重要作用。 锁阳不同部位的差异表达基因在KEGG中的通路注释情况,见图5。 图5 基于KEGG通路分析锁阳不同部位的差异表达基因Figure 5 Analysis of differential expressed genes in different parts of C. songaricum based on KEGG pathway 由图5可知,同一发育阶段不同部位的通路注释结果显示,各组样本在“全局和总览图”中注释到的DEGs最多,其次是翻译、脂质代谢和碳水化合物代谢。Cy-3 vs Cy-4和Cy-3 vs Cy-5中DEGs较多,且主要富集在“全局和总览图”中,而Cy-1 vs Cy-2和Cy-5 vs Cy-4中DEGs较少,说明在成花锁阳的花序和茎之间的差异表达基因较多,次生代谢产物的生物合成、翻译和脂质代谢等过程十分活跃,而在未成花锁阳和成花锁阳的茎之间注释到的差异表达基因较少。结果表明,在锁阳生长发育过程中,次生代谢产物的生物合成、翻译过程、氨基酸代谢等过程十分活跃,且在锁阳同一发育阶段的不同部位之间代谢过程也有差异。 锁阳黄酮类生物合成途径相关的差异基因的表达量,见图6。 图6 与锁阳黄酮类生物合成途径相关的差异基因的表达量Figure 6 Expression of differential genes related to flavonoid biosynthesis pathway in C. songaricum注:热图块从左到右分别表示Cy-1,Cy-2,Cy-3,Cy-4,Cy-5;红色表示表达量相对增加;绿色表示表达量相对降低。 由图6可知,在本研究中,共筛选出20个与黄酮类生物合成途径相关的差异表达基因,包括1个苯丙氨酸解氨酶基因(Unigene1091_ALL)、1个肉桂酸-4-羟化酶基因(Unigene37878_ALL)、2个4-香豆酸-辅酶A连接酶基因(Unigene26993_ALL、Unigene5468_ALL)、2个查尔酮合酶基因(Unigene10860_ALL、Unigene33900_ALL)、1个查尔酮异构酶基因(Unigene10157_ALL)、4个黄烷酮3-羟化酶基因(Unigene1305_ALL、Unigene34429_ALL、Unigene37419_ALL、Unigene7591_ALL)、4个类黄酮3’-羟化酶基因(Unigene14231_ALL、Unigene31016_ALL、Unigene33968_ALL、Unigene7941_ALL)、1个二氢黄酮醇还原酶基因(Unigene5884_ALL)、2个无花色素还原酶基因(Unigene4993_ALL、Unigene5270_ALL)、1个无色花青素双加氧酶基因(Unigene10888_ALL)和1个黄酮醇合成酶基因(Unigene37498_ALL)。在本研究中,苯丙氨酸解氨酶基因PAL和肉桂酸-4-羟化酶基因C4H在锁阳整个发育阶段的表达量均较高,2个查尔酮合酶基因CHS在整个发育阶段的表达趋势恰好相反,即在锁阳各部位中的表达量均较低。2个4-香豆酸-辅酶A连接酶基因4CL在锁阳不同发育阶段的表达模式不同,分别在出土前和出土后表达量较高。查尔酮异构酶基因CHI在Cy-1、Cy-2和Cy-3中的表达水平较高,在Cy-5中的表达量最低。黄酮醇合成酶基因FLS在未成花锁阳中的表达量较低,在成花锁阳中较高。而二氢黄酮醇还原酶基因DFR和无花色素还原酶基因LAR在未成花锁阳中的表达量较高,在成花锁阳中较低,且在花序中表达量较高,在茎中较低。结果表明,与黄酮类生物合成途径相关的基因在锁阳不同发育阶段和不同部位中的表达水平有所不同,可能与锁阳的生长发育过程有关。 锁阳各样本之间的儿茶素含量差异,见图7。 图7 锁阳中的儿茶素含量Figure 7 Catechin content in C.songaricum注:不同字母表示锁阳不同部位之间在0.05水平有显著性差异(P<0.05)。 由图7可知,对锁阳中儿茶素含量进行测定后发现,在未成花锁阳中,Cy-1的儿茶素含量最高,达到5.74 mg/g。与Cy-1相比,Cy-2的儿茶素含量显著减少了30.66%。在成花锁阳中,Cy-3的儿茶素含量最低,值为2.28 mg/g。与Cy-3相比,Cy-5中的儿茶素含量显著增加了19.30%,Cy-4的儿茶素含量增加了12.72%。结果表明,在所有样本中,未成花锁阳茎上端的儿茶素含量最高,成花锁阳花序的儿茶素含量最低,未成花锁阳中的儿茶素含量显著高于其他样本。在不同发育阶段,锁阳茎中的儿茶素含量始终比花序中高;在锁阳的不同部位,未成花锁阳中的儿茶素含量均比成花锁阳的高。这与之前的转录组数据中儿茶素合成相关基因DFR和LAR的表达量变化规律一致。 转录组测序技术在植物生长发育调控、胁迫响应以及不同器官的形态建成方面得到了广泛研究[22-24]。本研究利用转录组测序分析了成花和未成花锁阳的花序和茎在发育过程中的差异,结果表明,大量差异基因富集在次生代谢产物的生物合成和代谢、氨基酸代谢、碳水化合物代谢等途径中,说明这些是锁阳生长发育过程中的重要代谢途径。 在锁阳的不同发育阶段,茎中的基因表达量始终较高,这可能是由于锁阳在生长发育过程中其药效成分在茎中大量积累,KEGG通路注释结果也表明,锁阳次生代谢产物的合成十分旺盛[14]。成花锁阳的整体基因表达量较未成花锁阳高,这一结果可能与其出土后的开花和结实等过程有关[25-26]。锁阳不同器官中的儿茶素含量也具有明显差异。其中,未成花锁阳茎上端中的儿茶素含量最高,茎下端次之,而成花锁阳花序中含量最低,茎上端和茎下端的含量相对较高,与前人的研究结果相似[14]。锁阳在中药中为去花序入药,这是因为茎中的儿茶素含量较高,去花序入药保证了锁阳中较高的药效成分含量;在蒙药中则以全草入药,因为锁阳花序中仍然存在一定含量的儿茶素,本研究结果证实了这2种不同入药方式的正确性。 儿茶素是由苯丙氨酸解氨酶PAL和肉桂酸-4-羟化酶C4H等酶催化合成的黄酮类化合物,主要存在于茶树等天然植物中[27]。一些研究表明,儿茶素的积累与植物的储能和抗逆有关,儿茶素通过其羟基提供电子来清除活性氧,从而在抵御氧化应激方面发挥着关键作用[28-29]。在本研究中,苯丙氨酸解氨酶基因PAL和肉桂酸-4-羟化酶基因C4H在锁阳整个发育阶段的表达量均较高,保证了锁阳在生育期内次生代谢产物合成与积累的起始,而黄酮醇合成酶基因FLS在未成花锁阳中的表达量较低,在成花锁阳中较高,这与前人的研究结果一致[27]。作为锁阳中重要的活性成分,儿茶素在锁阳的整个发育阶段都会积累,但其含量在不同发育阶段存在差异。在锁阳的不同部位,未成花锁阳中的儿茶素含量均比成花锁阳高,且在成花锁阳花序中含量最低,之前的研究也有类似结果[21]。基因DFR和LAR的表达水平与儿茶素含量的变化规律相似,但在成花锁阳花序中的表达水平大于茎。有研究表明,基因DFR和LAR的调控与茶树中总儿茶素含量紧密相关,其表达量随儿茶素含量的增加而增加[30-31]。因此,基因DFR和LAR可能对锁阳儿茶素的合成起着重要的调控作用。在黄酮类生物合成途径中,FLS与DFR可能对底物存在竞争性利用,FLS在成花锁阳的花序中表达活跃,改变了儿茶素的合成途径,可能是导致花序中儿茶素含量降低的原因[32]。 本研究通过Illumina HiSeqTM 2000技术对未成花锁阳的茎上端(Cy-1)、茎下端(Cy-2)以及成花锁阳的花序(Cy-3)、茎上端(Cy-4)和茎下端(Cy-5)进行了测序,成功构建了锁阳的转录组文库,并对黄酮类化合物生物合成相关基因的表达进行了分析。共获得106 626个Unigenes,通过BLAST分析后,在各样本中分别有59 547、46 362、32 466、33 609、21 040、39 939个Unigenes在Nr、Nt、Swiss-Prot、KEGG、COG和GO数据库获得注释,共有318 909个差异基因在GO得到注释。在锁阳的不同发育阶段,茎中的基因表达量始终较高,且成花锁阳的整体基因表达量比未成花锁阳高。将筛选到的318 909个差异表达基因进行KEGG通路注释分析,各组样本在“全局和总览图”中注释到的差异表达基因最多,其次是翻译、脂质代谢和碳水化合物代谢,锁阳同一发育阶段的不同部位之间代谢过程也有差异。共筛选出20个与黄酮类生物合成途径相关的差异表达基因,黄酮醇合成酶基因FLS在未成花锁阳中的表达量较低,在成花锁阳中较高。而二氢黄酮醇还原酶基因DFR和无花色素还原酶基因LAR在未成花锁阳中的表达量较高,在成花锁阳中较低。在所有样本中,未成花锁阳茎上端的儿茶素含量最高,成花锁阳花序的儿茶素含量最低,且未成花锁阳中的儿茶素含量均比成花锁阳高,这与DFR和LAR表达量的变化规律一致,说明DFR和LAR对锁阳儿茶素的合成起着重要的调控作用。本研究为濒危药用植物锁阳次生代谢的研究、锁阳资源的综合利用及其最佳采收期的确定提供了参考。1.4 儿茶素含量测定
1.5 数据统计分析
2 结果与分析
2.1 测序数据的整体评估及基因的功能注释
2.2 差异表达基因的GO分类
2.3 差异表达基因的分析


2.4 黄酮类生物合成相关基因的表达分析

2.5 儿茶素含量分析

3 讨论与结论
3.1 讨论
3.2 结论

