油莎豆耐盐性评估及盐胁迫下幼苗根系转录组学分析
王会伟 张向歌 李春鑫 许欣然 胡海燕 朱雅婧 王 艳 张新友
河南省农业科学院经济作物研究所, 河南郑州 450002
土壤盐渍化已成为影响植物生长和农业生产的主要非生物胁迫, 是世界范围内主要的环境问题之一[1-3]。我国土壤盐渍化形势十分严峻, 各类盐渍化土壤总面积达到约0.99亿公顷, 约占全国土地面积的1/3[4]。盐渍化土壤中盐分过多, 会产生盐害作用,严重影响农作物的生长及产量[5]。由于缺乏适宜种植的耐盐性作物品种, 大面积的盐渍化土壤无法有效利用, 对我国农业生产造成巨大损失, 甚至会影响到我国的经济发展和粮食安全。
油莎豆(Cyperus esculentus)是一种优质、高产、综合利用价值高的油、粮、牧、饲多用新型经济作物。原产北非及地中海沿岸一带, 广泛栽培于西班牙、意大利、南非、南美、前苏联等地; 1960年由中国科学院植物研究所从保加利亚引入我国试种成功, 近年来在我国新疆、内蒙古、广西、湖南、湖北、河北、河南等地已开始种植[6-8]。油莎豆单位面积产油量是大豆的4~5倍、油菜的2~3倍; 油莎豆油清亮醇香, 不饱和脂肪酸总量达80%以上, 是已知植物油中“维生素E含量之王”, 油质优良; 油莎豆淀粉和糖分的含量超过50%, 是优质酿酒原料,豆粕可替代粮食作为酿酒原料[7]。大力发展油莎豆产业不仅能有效缓解食用油巨大消费需求和有限自给率的主要矛盾, 还可以部分缓解酿酒产业大量消耗原粮的问题。油莎豆以茎豆无性繁殖为主, 适应性强, 耐旱、耐涝、耐贫瘠、耐盐碱, 具有在盐渍化土壤上种植的潜力[8], 有望成为一种盐渍化土壤改良和边际土地利用的优良作物。因此, 开展油莎豆耐盐特性和耐盐分子机制的研究具有重要意义。
盐胁迫主要破坏植物细胞内离子稳态和平衡,产生渗透胁迫和离子毒害[9]。其次, 当过多的盐离子进入植物体内, 会影响酶的活性以及蛋白的功能等,使细胞内活性氧(reactive oxygen species, ROS)水平会急剧增加; 如果ROS不能被及时清除, 将诱导细胞膜发生脂过氧化作用, 产生大量的终产物丙二醛(malondialdehyde, MDA), 同时破坏细胞膜结构, 对植物造成各种次生毒害[10]。为了应对盐胁迫, 植物尤其是耐盐性植物激活了多种耐受机制, 减少吸收、增加外排或者将盐离子区隔化在液泡中以降低其在细胞质中的浓度[11]; 同时还会增加某些渗透调节物如可溶性糖(soluble sugar, SS)、脯氨酸(proline,Pro)和甜菜碱(glycine betaine, GB)的合成, 调节细胞渗透平衡[12]; 另外, 植物还有ROS清除系统, 增强超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)等活性, 清除过量积累的ROS, 减少次生氧化毒害[13]。
植物抵抗盐胁迫而产生的各种生理生化反应涉及到一系列的相关基因[14]。不同植物对于盐胁迫的耐受程度不同, 其根本原因在于其是否具备相关基因、相关基因是否表达以及相关基因表达是否过量。高通量RNA测序分析(RNA-seq)是一种功能强大的全基因组转录谱鉴定和差异基因表达分析技术, 已被广泛用于检测多种植物在盐胁迫下的基因表达,如在大麦[15]、甘薯[16]、油菜[17]和拟南芥[18]等植物中,鉴定出一系列的耐盐相关基因。这些研究表明, 大量的耐盐相关基因参与了氧化还原、渗透调节、离子转运和激素信号转导等生物学过程。这些耐盐相关基因的鉴定将进一步为耐盐机制解析奠定基础。
种子萌发和幼苗生长是植物生命的开始, 也是其整个生命周期中最重要、最脆弱的阶段[19-20]。在盐渍化环境中, 植物能否顺利通过幼苗期, 在一定程度上能够反映其耐盐能力[21-22]。盐渍化土壤以含有较高浓度的盐离子尤其是Na+和Cl-为主要特征[23-25], 因而NaCl可作为耐盐性评价的胁迫剂[26-29]。本研究以NaCl溶液模拟盐渍化环境, 通过对油莎豆茎豆萌发和幼苗生长过程中形态指标和生理指标的测定, 了解其耐盐特性, 并借助RNA-seq技术对其耐盐相关基因进行挖掘, 初步解析其中的耐盐机制, 以期为油莎豆在盐渍化土壤的栽培种植和耐盐品种的培育提供参考。
1 材料与方法
1.1 试验材料
供试材料为圆粒型豫油莎2号(Yuyousha 2,YYS2)和长粒型豫油莎3号(Yuyousha 3, YYS3) 2个不同类型的油莎豆品种, 均由河南省农业科学院经济作物研究所选育。
1.2 耐盐性评估
1.2.1 盐胁迫下油莎豆茎豆的发芽率和耐盐指数测定 本研究设置5个不同质量浓度NaCl处理: 0(CK)、0.3%、0.6%、0.9%和1.2%, 模拟盐胁迫。每个油莎豆品种选取大小均匀的茎豆1500粒, 用10%次氯酸钠溶液消毒10 min, 无菌水冲洗干净后备用。将每个品种的300粒茎豆分别放入5个处理中进行浸种(3 d), 每天更换一次相应的处理溶液。将吸涨的茎豆转移至沙土育苗盘(8×16孔)中进行发芽, 每个品种每个处理设3次重复, 每个重复100粒, 每天喷洒一次处理溶液(3 L), 喷洒之前用清水(3 L)喷洒冲洗。沙培7 d后, 观察与统计茎豆发芽情况, 测定发芽率和耐盐指数。发芽率(%)=(n/N)×100, 公式中:n为最终正常发芽数,N为供试茎豆总数; 耐盐指数(%)=(处理发芽率/对照发芽率)×100。
1.2.2 盐胁迫下油莎豆幼苗生长发育观察 将以上5个处理溶液作为培养液, 选取沙培7 d后对照中长势一致的油莎豆进行水培培养, 每个品种每个处理设3次重复, 每个重复15株。培养3 d后, 观察幼苗生长情况, 测量所有幼苗的苗高和根长。幼苗苗高为茎豆芽眼以上至顶部叶尖的长度; 幼苗根长为茎豆芽眼以下最长根的长度。
1.2.3 盐胁迫下发油莎豆幼苗根系生理指标测定
将以上水培(5个处理溶液)培养3 d的油莎豆幼苗根系(相同处理下每个重复的15株混样)用液氮速冻, 并于-80℃保存备用。参考《现代植物生理学实验指南》, 采用试剂盒(南京陌凡生物科技有限公司)测定各处理幼苗根系的MDA、过氧化氢(H2O2)含量以及CAT、SOD、POD活性; 采用雷氏盐沉淀法测定GB含量; 采用茚三酮比色法测定Pro含量; 采用蒽酮法测定SS含量。在进行以上不同生理指标测定时, 每个处理检测3次重复。
以上试验所需材料均于河南省农业科学院人工气候室进行种植。光照14 h, 30℃; 黑暗10 h, 28℃。各处理中, 3个重复的平均值作为该指标的表型值。利用WPS 2021软件进行数据整理和计算, 利用IBM SPSS 25软件进行各个性状的多重比较分析,采用最小显著性差异法(LSD)在5%水平上进行显著性判定。
1.3 转录组学分析
1.3.1 RNA提取与测序 根据耐盐性评估结果,选取耐盐性好的NaCl处理下(包括对照)的油莎豆根系进行总RNA提取(TaKaRa RNA提取试剂盒), 每个处理3个重复(上述-80℃保存备用样品)。利用琼脂糖凝胶电泳分析RNA降解程度, Qubit荧光计精确定量RNA浓度, 以及Agilent 2100 Bioanalyzer检测RNA完整性。质检合格后, 通过Oligo (dT)磁珠富集总RNA中带有polyA结构的mRNA, 采用离子打断的方式, 将mRNA打断到长度300 bp左右的片段, 以此构建mRNA文库。基于Illumina HiSeq测序平台, 对这些文库进行150 bp双末端测序, 数据量约为6 Gbp。
1.3.2 转录本拼接及功能注释分析 采用Cutadapt去除测序原始数据(Total Reads)中3′端带接头的序列以及低质量读数, 获得质控后读数(Clean Reads)。由于油莎豆目前没有参考基因组信息, 需要从头(De Novo)组装转录本。利用Trinity软件对Clean Reads进行De Novo拼接组装, 得到转录本。提取每个基因下最长的转录本作为该基因的参考序列, 称为非冗余基因(Unigene)。基于 NR (NCBI nonredundant protein sequences)、Swiss-Prot、GO (Gene Ontology)、KEGG (Kyoto Encyclopedia of Genes and Genome)数据库对Unigene进行比对功能注释分析。
1.3.3 基因差异表达分析 利用转录组表达定量软件RSEM, 以Unigene转录本序列为参考, 分别将每个样品的Clean Reads比对到参考序列上。然后统计每个样品比对到每一个基因上的Reads数目, 并计算每个基因的FPKM值(即表达量)。基于FPKM值,计算Pearson相关系数, 检验各处理重复样品间表达水平的相似性。采用DESeq对各处理间基因表水平达进行差异分析, 筛选差异表达基因(Differentially expressed gene, DEG)的条件为: 表达差异倍数|log2Fold Change| > 1, 显著性P< 0.05。
1.3.4 加权基因共表达网络分析 加权基因共表达网络分析(Weighted gene co-expression network analysis, WGCNA)能够快速地筛选出与样本特征相关的基因共表达模块。将各处理幼苗根系相关差异显著的生理指标作为样本特征值进行WGCNA, 筛选出盐胁迫下生理指标变异显著相关的基因共表达模块。随后, 对模块基因和差异表达基因进行Venn分析, 筛选出共有基因, 作为潜在的耐盐相关基因。
1.3.5 GO富集分析 基于潜在的耐盐相关基因的GO term, 对每个term的基因列表和基因数目进行计算, 然后通过超几何分布方法计算P值, 筛选出耐盐相关基因显著富集的GO term (与整个基因组背景相比,P< 0.05)。根据GO富集结果(分子功能MF), 通过Rich factor、FDR值和富集到此GO Term上的基因个数来衡量富集的程度。Rich factor越大,表示富集的程度越大。FDR一般取值范围为0~1, 越接近于零, 表示富集越显著。
2 结果与分析
2.1 不同浓度NaCl胁迫对油莎豆茎豆萌发的影响
在不同浓度NaCl胁迫下, 随着NaCl浓度的升高, 油莎豆茎豆的发芽速度及发芽率呈逐渐下降趋势(图1-A, B)。在0.3% NaCl浓度下, 豫油莎2号(Yuyousha 2, YYS2)和豫油莎3号(Yuyousha 3, YYS3)茎豆的发芽率分别为94.33%和88.33%, 略低于CK(96.33%和92.67%); 在0.6% NaCl浓度下, YYS2和YYS3茎豆的发芽率分别为75.30%和69.67%, 均较CK呈现明显地下降, 但均超过了50%; 在0.9% NaCl浓度下, 发芽率急剧下降, YYS2为44.67%、YYS3为31.67%, 均低于50%; 在1.2% NaCl浓度下, 茎豆发芽受到严重抑制, 发芽率进一步降低, YYS2和YYS3茎豆的发芽率分别仅为31.67%和15.33%。同时, 对不同浓度NaCl胁迫下的茎豆耐盐指数进行分析, 从0.3%到1.2%的NaCl浓度下, 油莎豆茎豆的耐盐指数逐渐下降, YYS2茎豆的耐盐指数依次为97.92%、78.20、46.37%和32.87%, YYS3茎豆的耐盐指数依次为95.32%、75.18%、34.17%和15.92%(图1-B), 可以看出在0.3%和0.6% NaCl浓度下油莎豆茎豆的耐盐指数相对较高。表明, 油莎豆具有一定的耐盐能力, 在0.3%和0.6% NaCl浓度下受到的盐胁迫伤害不明显, 茎豆发芽率下降程度相对较小;在0.9%和1.2% NaCl浓度下受到的盐胁迫伤害明显,已经严重影响发芽率。

图1 不同浓度NaCl胁迫对油莎豆茎豆萌发的影响Fig. 1 Effects of different NaCl concentrations on germination ofCyperus esculentustubersA: 不同浓度NaCl胁迫下油莎豆茎豆的萌发形态。B: 不同浓度NaCl胁迫下油莎豆茎豆的发芽率及耐盐指数。标尺为2 cm。YYS2: 豫油莎2号; YYS3: 豫油莎3号。A: germination morphology ofCyperus esculentustubers under NaCl stress with different concentrations. B: the germination rate and salt tolerance index ofCyperus esculentustubers under NaCl stress with different concentrations. Bar: 2 cm. YYS2: Yuyousha 2; YYS3:Yuyousha 3.
2.2 不同浓度NaCl胁迫对油莎豆幼苗生长的影响
由图2可知, NaCl胁迫对油莎豆幼苗的生长具有抑制作用, 随着NaCl浓度增大, 油莎豆幼苗的根长和苗高受到的影响越明显。在0.3%、0.6%、0.9%、1.2% NaCl浓度下, 苗高和根长显著小于对照(P<0.05); 并且, 随着NaCl浓度增大, 幼苗的苗高和根长受抑制程度逐渐增加(表1)。相对而言, 在0.3%和0.6% NaCl浓度下幼苗的苗高和根长均显著大于在0.9%和1.2% NaCl浓度下幼苗的苗高和根长(0.6%NaCl浓度下YYS3的根长除外), 而且在0.3%和0.6% NaCl浓度下幼苗叶片没有出现明显的枯黄现象(图2-A, B), 表明油莎豆在0.6% NaCl浓度以下幼苗生长受到的影响相对较小, 而在0.9% NaCl浓度以上幼苗生长受到严重抑制。

图2 不同浓度NaCl胁迫对油莎豆幼苗生长的影响Fig. 2 Effects of different NaCl concentrations on seedling growth ofCyperus esculentusA: 不同浓度NaCl胁迫下YYS2幼苗生长特征。B: 不同浓度NaCl胁迫下YYS3幼苗生长特征。标尺为5 cm。YYS2: 豫油莎2号; YYS3:豫油莎3号。A: the characteristics of seedling growth of YYS2 under NaCl stress with different concentrations. B: the characteristics of seedling growth of YYS3 under NaCl stress with different concentrations. Bar: 5 cm. YYS2: Yuyousha 2; YYS3: Yuyousha 3.

表1 NaCl胁迫对两个油莎豆品种幼苗苗高和根长的影响Table 1 Effects on seedling height and root length of twoCyperus esculentusvarieties under NaCl stress
2.3 NaCl胁迫下油莎豆幼苗根系生理指标变化分析
盐胁迫下, 植物幼苗根系会直接、快速地产生一些列的生理变化, 包括胁迫毒害反应(如MDA、H2O2)以及渗透调节(如SS、GB、Pro)、抗氧化酶防御(如SOD、POD、CAT)等。对不同浓度NaCl胁迫下油莎豆幼苗根系的MDA、H2O2、SS、GB、Pro、SOD、POD、CAT进行测定。随着NaCl浓度升高, 膜受损程度指标物MDA和氧化胁迫物H2O2含量逐渐增加; 与CK相比, 0.3%和0.6%NaCl浓度下MDA和H2O2含量增加幅度较小, 0.9%和1.2% NaCl浓度下MDA和H2O2含量急剧增加(图3-A, B)。随着NaCl浓度升高, 渗透调节物SS、GB和Pro均表现出先增后减的趋势(图3-C~E)。相比之下, 不同NaCl浓度下SS含量变化程度较小(图3-C); GB和Pro含量在0.3%和0.6% NaCl浓度下大幅度增加, 而在0.9%和1.2% NaCl浓度下又均呈现出现下降趋势(图3-D,E)。同样, 随着NaCl浓度升高, 抗氧化酶SOD、POD、CAT的活性呈现出先增后减的趋势, 在0.6%NaCl浓度下3种酶的活性达到最高(图3-F~H)。表明, 油莎豆幼苗根系在0.3%和0.6% NaCl浓度胁迫下, 膜受损程度指标物MDA和氧化胁迫物H2O2含量增加较少, 而渗透调节物GB和Pro的含量迅速增加, 以及抗氧化酶SOD、POD、CAT的活性大幅度提高, 在一定程度上缓解盐胁迫毒害反应而具有较好的耐盐性。另外, YYS2和YYS3之间除MDA外其他生理指标均存在显著性差异, YYS2根系中Pro的含量和POD的活性在不同NaCl浓度胁迫下均高于YYS3, 而H2O2、SS的含量和CAT的活性则相反,表明2个油莎豆品种之间耐盐能力存在差异。

图3 不同浓度NaCl胁迫下油莎豆幼苗根系生理指标变化Fig. 3 Variation of physiological indexes ofCyperus esculentusroots under different NaCl concentrations*表示指标在YYS2和YYS3之间存在显著差异(P< 0.05)。YYS2: 豫油莎2号; YYS3: 豫油莎3号。* represents significant difference atP< 0.05. YYS2: Yuyousha 2; YYS3: Yuyousha 3.
2.4 NaCl胁迫下油莎豆幼苗根系转录组测序
油莎豆在0.3%和0.6% NaCl浓度下表现出较好的耐盐性, 并且YYS2耐盐指数略高于YYS3。为从转录水平分析油莎豆耐盐性的内在分子机制, 本研究对0 (CK)、0.3%和0.6% NaCl浓度下YYS2的幼苗根系进行了高通量转录组测序。所得数据经质量评估及过滤后, 各样品的Q20和Q30均在97%和93%以上; Clean reads 的比对率均在92.0以上(表3)。通过对Clean reads从头组装和注释分析, 共获得30,191个具有注释信息的Unigene (表3), 并以此计算每个基因的表达量。另外, 对样品间基因表达量进行相关性分析, 结果显示各处理重复样品之间相关系数较高(图4)。表明, 本研究中转录组测序数据质量较高、样品间重复性较好, 适用于进一步分析。

图4 重复样品间基因表达量的相关性分析Fig. 4 Correlation analysis of gene relative expression levels among duplicate samples红框表示同一处理下的3个重复。Red box represents three replicates under the same treatment.

表3 转录组测序数据统计分析Table 3 Statistic analysis of transcriptome sequencing data
2.5 NaCl胁迫下差异表达基因的鉴定
以CK为对照, 在0.3% NaCl浓度处理下共产生了2643个差异表达基因, 其中有471个基因上调表达, 2172个基因下调表达; 在0.6% NaCl浓度处理下共产生了3460个差异表达基因, 其中有840个基因上调表达, 2620个基因下调表达(图5-A)。随着NaCl浓度增加, 差异表达基因数目也明显上升, 表明基因表达变异幅度变大。通过Venn分析, 2组之间(0.3% vs CK和0.6% vs CK)鉴定出1926个共有差异表达基因, 其中226个基因上调表达, 1700个基因下调表达(图5-B), 而这些共有的差异表达基因中包含油莎豆耐盐相关基因。
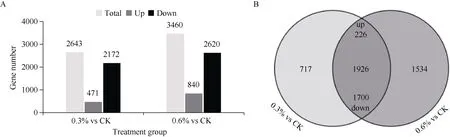
图5 不同浓度NaCl胁迫下基因差异表达分析Fig. 5 Differential relative expression level of genes under different concentrations of NaCl stressA: 不同处理组(0.3% vs CK和0.6% vs CK)差异表达基因数目; B: 不同处理组间差异表达基因的维恩分析。A: the number of DEGs in different treatment groups (0.3% vs CK and 0.6% vs CK); B: Venn analysis of DEGs between different treatment groups.
2.6 基于WGCNA的耐盐相关基因筛选
在0.3%和0.6% NaCl浓度胁迫下, GB、Pro、SOD、POD、CAT积极参与耐盐响应, 在一定程度上能够反映其耐盐能力。基于GB和Pro的含量及SOD、POD、CAT的活性进行WGCNA, 结果鉴定出21个表达高度相关的基因集模块(图6-A), 其中黄色模块(Yellow module)基因与甜菜碱GB、脯氨酸Pro、抗氧化酶SOD、POD、CAT均显著相关, 是与油莎豆耐盐能力紧密关联的基因集。通过Venn分析(图6-B), 从黄色模块基因集中筛选到110个在0.3%和0.6% NaCl浓度胁迫下共有的差异表达基因, 而这些基因可能是油莎豆潜在的耐盐相关基因。

图6 耐盐相关基因的筛选Fig. 6 Screening of salt tolerance-related genesA: 基于超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化物酶(CAT)、甜菜碱(GB)和脯氨酸(Pro)的WGCNA。每行代表一个模块, 每列代表一种性状; 矩形框中上方数字代表模块与性状之间的相关系数, 括号内数字为相应的P值。B: 不同处理间共有的差异表达基因和耐盐相关的黄色模块基因之间的维恩分析。A: the WGCNA based on superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), glycine betaine (GB), and proline (Pro). Each row represents a module and each column represents a trait; the correlation coefficient and the correspondingP-value are shown in each rectangular box. B: Venn analysis between the overlapped DEGs and the salt tolerance-related yellow module genes.
2.7 耐盐相关基因的GO富集分析
根据MF对以上筛选出的潜在耐盐相关基因进行GO富集分析, 发现24个GO terms被显著富集(图7-A), 主要与氧化还原(如GO: 0016688、GO:0033741等)、跨膜转运(如GO: 0015171、GO:0046943等)、几丁质水解(如GO: 0008061、GO:0004568)等相关(图7-A, B)。这些被显著富集的GO Terms共包含了15个显著上调表达基因(图7-B), 其中10个基因与氧化还原相关, 如DN23985_c0_g1编码玉米黄质环氧酶、DN2960_c0_g1编码L-抗坏血酸过氧化物酶、DN8384_c1_g1编码谷胱甘肽转移酶;3个基因与跨膜转运相关, 如DN21785_c1_g1编码赖氨酸-组氨酸转运蛋白、DN6596_c0_g1编码氨基酸转运蛋白; 另外, 1个基因DN14393_c0_g1编码几丁质酶, 1个基因DN4115_c0_g1编码翻译起始因子。这些基因的功能必定与盐胁迫下植物生理生化调节相对应, 盐胁迫下积极响应以提高油莎豆的耐盐能力。

图7 耐盐相关基因的GO富集分析Fig. 7 GO enrichment analysis of salt tolerance-related genesA: 基于MF的GO富集气泡图。B: 显著富集GO terms中所有基因的表达分析及功能注释。A: the bubble diagram of GO enrichment based on MF (molecular function). B: the relative expression level and functional annotation of all genes in significantly enriched GO terms.
3 讨论
植物幼苗期是对外界环境最敏感的阶段, 此时期的耐盐性尤为重要, 是评估耐盐性强弱的关键[30-31]。许多研究均以发芽率、发芽势、发芽指数、苗高、根长等幼苗期性状为重要指标, 进行耐盐性评估[32-34]。本研究为了评估油莎豆的耐盐特性, 分析了不同浓度NaCl胁迫对油莎豆茎豆萌发和幼苗生长的影响。结果发现, 在0.3%和0.6% NaCl胁迫下, 油莎豆发芽率、苗高和根长变化程度相对较小, 盐胁迫伤害不明显; 而在0.9%和1.2% NaCl胁迫下, 其茎豆萌发和幼苗生长受到严重的抑制, 盐胁迫伤害十分明显。
盐胁迫下, 植物细胞内正常的代谢平衡被打破,产生了大量的ROS, 如超氧阴离子(O2܋)、H2O2、羟自由基(HO-)等, 这些ROS直接或间接地启动膜脂过氧化进程, 破坏细胞膜完整性; 而MDA是膜脂过氧化的主要产物, 其含量的高低在一定程度上可以反映膜脂过氧化的程度, 进而间接的反映膜的受损伤程度[35]。因而, 细胞内ROS和MDA含量的变化能够间接地反映盐胁迫下的盐毒害程度以及相应的耐盐性。有研究表明, 耐盐性强的品种具有较强的O2܋和H2O2清除能力, 能够有效减少盐胁迫下ROS积累及细胞膜损伤[36]。本研究中, 在0.3%和0.6%NaCl胁迫下油莎豆幼苗根系的MDA和H2O2含量稍微增加, 而0.9%和1.2% NaCl胁迫下MDA和H2O2含量大幅度增加, 意味着油莎豆根系在0.3%和0.6%NaCl胁迫下能够有效的清除ROS而减少细胞膜损伤, 进而使油莎豆受到的盐胁迫伤害不明显。实际上, 针对盐胁迫带来的危害, 植物(尤其是耐盐性植物)会通过体内一系列的生理生化调节来适应或减弱这些危害而能继续生长, 主要包括渗透调节、ROS清除等[37-39]。同样, 本研究发现油莎豆的耐盐能力与渗透调节物GB和Pro的含量及ROS清除体系抗氧化酶SOD、POD、CAT的活性密切正相关, 在0.3%和0.6% NaCl胁迫下迅速增加, 而在0.9%和1.2%NaCl胁迫下又逐渐降低。综上所述, 油莎豆具有一定的耐盐能力, 有潜力成为一种应用价值巨大的耐盐性作物。另外, 许多研究表明植物耐盐性受基因型控制, 不同基因型品种的耐盐性可能存在显著差异[40-42]。本研究中, 2种不同类型的油莎豆品种(圆粒型YYS2和长粒型YYS3)在不同浓度NaCl胁迫下呈现出一定差异的萌发状态, 如YYS2茎豆萌发过程中的发芽率和耐盐指数始终高于YYS3; 而且, NaCl胁迫下YYS2和YYS3之间许多生理指标均存在显著性差异, 尤其是YYS2根系中Pro的含量和POD的活性显著高于YYS3, 说明YYS2比YYS3具有更强的耐盐性。因而, 可以通过对大量油莎豆资源的耐盐性评估及鉴定, 筛选出耐盐性更强的种质资源, 为油莎豆在不同程度盐渍化土壤中种植提供材料保障。
植物的耐盐性一般由一系列耐盐相关基因调控,盐胁迫下迅速响应, 抵抗盐毒害反应[43]。在0.3%和0.6% NaCl胁迫下, 油莎豆表现出较小的盐毒害反应, 其体内一些耐盐相关基因必然迅速响应, 表达水平发生显著变化。本研究利用RNA-seq技术检测了0、0.3%和0.6%NaCl胁迫下油莎豆根系的基因表达情况。基因差异表达分析显示, 盐胁迫下大量基因下调表达, 可能与胁迫毒害反应相关; 而少量基因呈现上调表达, 可能与耐盐响应相关。WGCNA可以用来鉴定出高度协同变化且与表型密切关联的基因集, 被广泛应用于发育调控机制、生物和非生物胁迫响应机制等研究中关键调控因子的挖掘[44-45]。本研究通过WGCNA鉴定出1个与油莎豆耐盐能力紧密关联的基因集, 并以此从差异表达基因中筛选出110个潜在的油莎豆耐盐相关基因。GO富集显示,这些基因显著富集于氧化还原、跨膜转运、几丁质水解等相关过程, 与大量其他植物盐胁迫相关研究的结果相似[15-18]。
实际上, 大部分耐盐基因与其盐胁迫下生理生化调节对应, 主要包括离子转运相关基因、渗透调节相关基因、抗氧化相关基因等[46-48]。本研究中, 显著富集的GO terms涉及了15个显著上调表达基因,响应盐胁迫。其中,DN23985_c0_g1、DN2960_c0_g1、DN8384_c1_g1分别编码玉米黄质环氧酶、L-抗坏血酸过氧化物酶、谷胱甘肽转移酶, 具有抗氧化作用,能够有效清除细胞内的ROS, 参与抗氧化调节[49-51]。因而可以推断, 盐胁迫下油莎豆L-抗坏血酸过氧化物酶的活性及谷胱甘肽的含量会大幅度增加, 与本研究已检测到活性增加的POD、SOD、CAT协同进行抗氧化调节。其次,DN21785_c1_g1和DN6596_c0_g1二者均编码氨基酸转运蛋白, 可能与细胞内氨基酸积累相关, 而许多研究表明盐胁迫下植物体内一些氨基酸类小分子(如Pro)的积累可以通过渗透调节进而增强耐盐性[52-53]; 与此一致的是, 本研究发现在0.3%和0.6% NaCl胁迫下Pro的含量显著增加。另外,DN14393_c0_g1编码几丁质酶, 而在植物中几丁质酶属于一种防御蛋白, 能够水解几丁质,一旦受到某些胁迫, 酶活性提高, 从而促进了植物对胁迫的响应[54], 在植物的耐盐过程中发挥了重要作用[55-56]。因而, 盐胁迫下这些基因显著上调表达,参与油莎豆相应的抗氧化调节和渗透调节等, 增强其耐盐能力。
4 结论
本研究检测了不同浓度NaCl胁迫下油莎豆茎豆萌发和幼苗生长过程中形态和生理指标的变化,明确油莎豆具有一定的耐盐能力, 在0.6%及以下浓度NaCl胁迫时受到的伤害不明显。基于RNA-seq,通过基因差异表达分析、WGCNA以及GO富集分析, 鉴定到15个可能的油莎豆盐胁迫相关基因, 主要与抗氧化、氨基酸跨膜转运和几丁质水解相关,盐胁迫下显著上调表达从而使油莎豆受到的盐胁迫伤害较小。本研究为油莎豆在盐渍化土壤的种植提供了重要参考, 并为进一步的耐盐分子机制解析和耐盐品种培育奠定了基础。
致谢: 感谢中国农业科学院作物科学研究所李洪杰研究员在本研究试验设计和文章撰写中给予大力帮助。

