艾地苯醌联合奥拉西坦治疗血管性痴呆临床观察*
刘亚林,孟文娟,郭医杰,孔咏梅,张文涛
(河北省邢台市第三医院,河北 邢台 054000)
血管性痴呆(VD)是一种多发于老年群体的记忆、认知功能障碍综合征,因脑部缺血、缺氧、脑血管病变所致[1-2]。我国发病率为1.1%~3.0%,且在不断升高,严重危害患者的身心健康[3]。临床研究表明,VD是唯一可预防与治疗的痴呆性疾病,早期、及时、有效治疗可较好地控制病情进展[4]。奥拉西坦为新型脑代谢改善药物,可促进神经功能恢复,提高记忆与学习能力[5],对VD 有一定疗效,但单用疗效欠佳[6]。艾地苯醌为新型脑保护剂,可改善脑缺血、中枢神经系统损伤及痴呆症状[7-8]。基于此,本研究中探讨了艾地苯醌联合奥拉西坦治疗VD 的临床疗效,以及对患者认知功能、日常生活能力、血清炎性因子和凋亡因子水平的影响。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合VD 诊断标准[9];临床资料完整;入组前1 个月内未接受治疗;营养状况良好,电解质处于稳定状态。本研究方案经医院医学伦理委员会批准(批件号为2017-5),患者及家属均签署知情同意书。
排除标准:既往有抑郁症、精神分裂症;先天认知功能障碍;伴严重肢体障碍、感觉障碍及意识障碍;因脑外伤、帕金森病、阿尔茨海默病等致痴呆或认知障碍;既往有酒精、药物依赖史;对本研究中所用药物存在禁忌证或过敏;合并免疫系统疾病、肿瘤、感染性疾病;发生感染。
病例选择与分组:选取我院2018年1月至2020年5月收治的VD 患者106 例,按随机数字表法分为对照组和研究组,各53 例。两组患者一般资料比较,差异无统计学意义(P >0.05),具有可比性。详见表1。
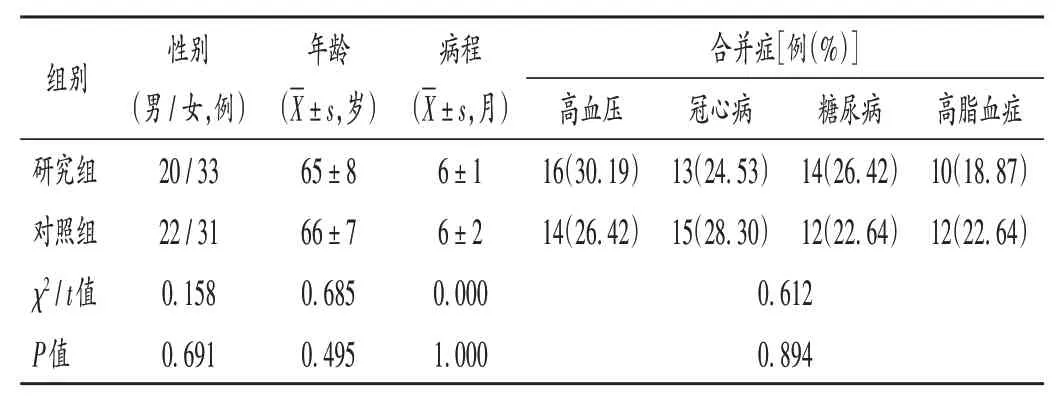
表1 两组患者一般资料比较(n=53)Tab.1 Comparison of the patients' general data between the two groups(n=53)
1.2 方法
所有患者均接受常规基础治疗,包括血压、血糖控制,抗血小板聚集,调脂,稳定斑块,改善循环等。对照组患者在此基础上给予奥拉西坦胶囊(石药集团欧意药业有限公司,国药准字H20031033,规格为每粒0.4 g)口服治疗,每次0.8 g,每天3次。研究组患者在对照组基础上加用艾地苯醌片(深圳海王药业有限公司,国药准字H10970363,规格为每片30 mg)口服治疗,每次30 mg,每天3次。两组患者均连续治疗3个月。
1.3 观察指标与疗效判定标准
认知能力、日常生活能力、痴呆程度:采用简易精神状态检查(MMSE)量表[10]、日常生活能力评定(ADL)量表[11]和临床痴呆评定(CDR)量表[12]评估两组患者治疗前1 d、治疗3 个月后的认知功能、日常生活能力和痴呆程度。其中,MMSE量表包括视空间能力、计算力、注意力、记忆力、定向力及语言能力6 个维度,总分30 分,评分越高,精神状态越好;ADL量表包括2个维度、14个计分条目,采用1~4 分计分法,分值范围14~56 分,评分越高,认知能力和日常生活能力越差;CDR 量表包括记忆、定向力、判断与解决问题、家庭生活与个人爱好、社会事务5个维度,总分0~5分,评分越高,痴呆越严重。
血清学指标:分别于治疗前、治疗后采集患者的空腹静脉血各3 mL,置离心管中,离心(转速为3 000 r/min)10 min,取上清液,采用酶联免疫吸附法检测血清中炎性因子[肿瘤坏死因子- α(TNF - α)、白细胞介素6(IL-6)、C 反应蛋白(CRP)],D-二聚体(D-D),同型半胱氨酸(Hcy)及凋亡因子[血红素加氧酶1(HO-1)、可溶性凋亡相关因子(sFAS)、可溶性凋亡相关因子配体(sFASL)]的水平。试剂盒由上海酶联生物科技有限公司提供,所有操作均严格按说明书进行。
疗效判定:显效,MMSE量表评分升高40%及以上;有效,MMSE 量表评分升高21%~39%;无效,MMSE 量表评分升高不超过20%。总有效=显效+有效。
安全性:记录两组患者治疗期间失眠、食欲不振、头晕恶心等不良反应发生情况。
1.4 统计学处理
采用SPSS 20.00统计学软件分析。计量资料以±s表示,行t检验;计数资料以率(%)表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
结果见表2至表7。
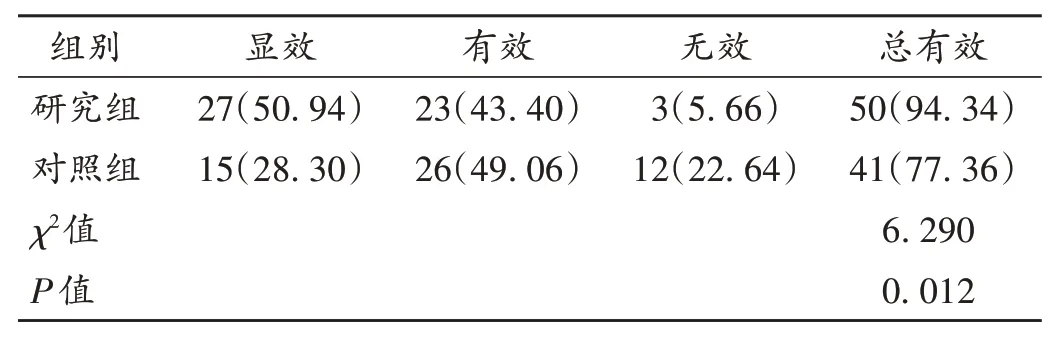
表2 两组患者临床疗效比较[例(%),n=53]Tab.2 Comparison of clinical efficacy between the two groups[case(%),n=53]
表3 两组患者认知能力、日常生活能力、痴呆程度比较(±s,分,n=53)Tab.3 Comparison of cognitive ability,ADL,and dementia degree between the two groups(±s,point,n=53)
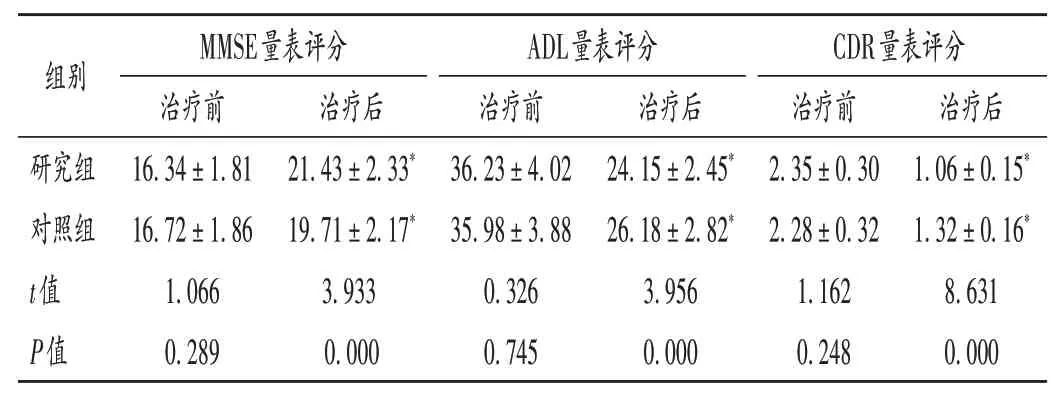
表3 两组患者认知能力、日常生活能力、痴呆程度比较(±s,分,n=53)Tab.3 Comparison of cognitive ability,ADL,and dementia degree between the two groups(±s,point,n=53)
注:与本组治疗前比较,*P <0.05。表4至表6同。Note:Compared with those before the treatment,*P < 0.05 (for Tab.3 - 6).
组别研究组对照组t值P值MMSE量表评分治疗前16.34±1.81 16.72±1.86 1.066 0.289治疗后21.43±2.33*19.71±2.17*3.933 0.000 ADL量表评分治疗前36.23±4.02 35.98±3.88 0.326 0.745治疗后24.15±2.45*26.18±2.82*3.956 0.000 CDR量表评分治疗前2.35±0.30 2.28±0.32 1.162 0.248治疗后1.06±0.15*1.32±0.16*8.631 0.000
表4 两组患者血清炎性因子水平比较(±s,n=53)Tab.4 Comparison of serum inflammatory factor levels between the two groups(±s,n=53)
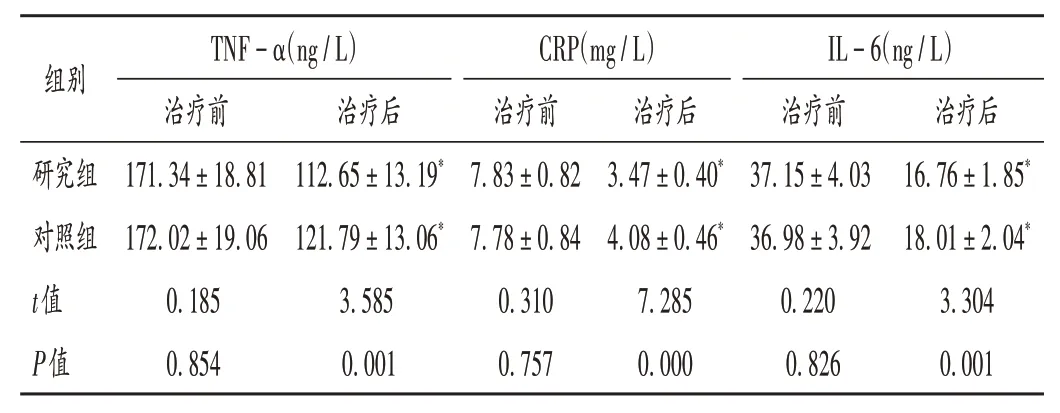
表4 两组患者血清炎性因子水平比较(±s,n=53)Tab.4 Comparison of serum inflammatory factor levels between the two groups(±s,n=53)
组别研究组对照组t值P值TNF-α(ng/L)治疗前171.34±18.81 172.02±19.06 0.185 0.854治疗后112.65±13.19*121.79±13.06*3.585 0.001 CRP(mg/L)治疗前7.83±0.82 7.78±0.84 0.310 0.757治疗后3.47±0.40*4.08±0.46*7.285 0.000 IL-6(ng/L)治疗前37.15±4.03 36.98±3.92 0.220 0.826治疗后16.76±1.85*18.01±2.04*3.304 0.001
表5 两组患者血清Hcy和D-D水平比较(±s,n=53)Tab.5 Comparison of serum Hcy and D - D levels between the two groups(±s,n=53)
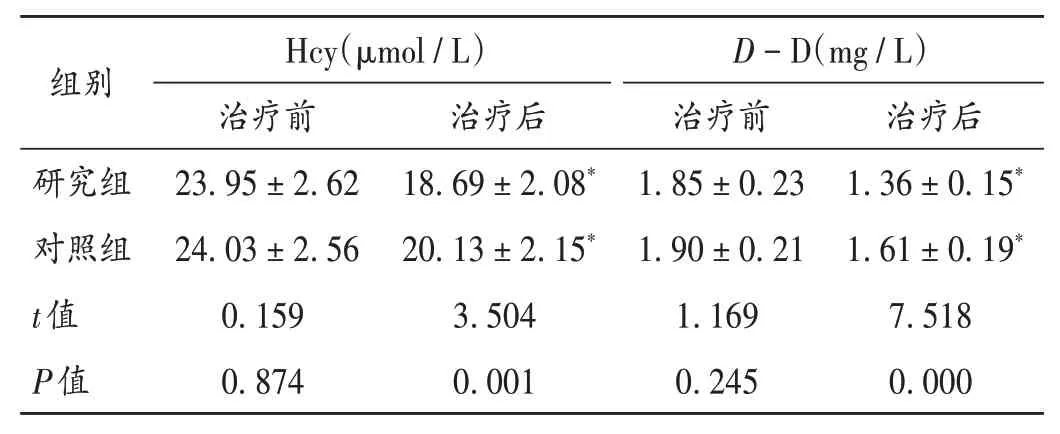
表5 两组患者血清Hcy和D-D水平比较(±s,n=53)Tab.5 Comparison of serum Hcy and D - D levels between the two groups(±s,n=53)
组别研究组对照组t值P值Hcy(μmol/L)治疗前23.95±2.62 24.03±2.56 0.159 0.874治疗后18.69±2.08*20.13±2.15*3.504 0.001 D-D(mg/L)治疗前1.85±0.23 1.90±0.21 1.169 0.245治疗后1.36±0.15*1.61±0.19*7.518 0.000
表6 两组患者血清凋亡因子水平比较(±s,n=53)Tab.6 Comparison of serum apoptosis factor levels between the two groups(±s,n=53)

表6 两组患者血清凋亡因子水平比较(±s,n=53)Tab.6 Comparison of serum apoptosis factor levels between the two groups(±s,n=53)
组别研究组对照组t值P值HO-1(ng/L)治疗前486.34±50.16 492.02±50.26 0.582 0.562治疗后604.65±62.39*545.79±55.49*5.132 0.000 sFAS(pg/mL)治疗前221.83±24.12 222.08±23.97 0.054 0.957治疗后156.47±16.40*164.08±17.76*2.292 0.024 sFASL(pg/mL)治疗前146.85±15.23 147.10±15.19 0.085 0.933治疗后108.25±11.65*114.67±12.18*2.773 0.007

表7 两组患者不良反应发生情况比较[例(%),n=53]Tab.7 Comparison of the incidence of adverse drug reactions between the two groups[case(%),n=53]
3 讨论
VD 是由急性、慢性脑血管发生病变而造成的脑局部灌注不足,主要表现为记忆力、认知能力衰退等,及早进行有效治疗可控制VD进展及改善预后[13]。奥拉西坦为临床常用痴呆治疗药物,但单用疗效欠佳。艾地苯醌为抗氧化剂和脑保护剂,可阻止自由基产生,激活线粒体电子传递系统,促进三磷酸腺苷生成,从而激活中枢神经系统功能。本研究结果显示,研究组患者总有效率显著高于对照组,表明艾地苯醌可提高VD 的临床疗效。
本研究结果显示,治疗3 个月后,研究组患者的MMSE 量表评分均显著高于对照组,ADL 量表和CDR量表评分均显著低于对照组,表明艾地苯醌联合奥拉西坦治疗VD 效果更好,可促进患者精神状态的恢复,提升日常生活能力,减轻痴呆症状,这与胡晓颖等[14]的研究结果一致。这可能是由于艾地苯醌可升高胆碱水平,减轻氧化应激反应,具有较强的抗氧化、脂质过氧化抑制作用,还可改善脑代谢,激活脑线粒体呼吸活性。
当机体发生VD 时,脑组织释放大量炎性物质,加速神经细胞凋亡,导致智力减退,最终影响患者的精神状态。当机体出现炎症且不断加重时,炎性因子大量释放入血,在血清中异常表达[15]。Hcy 可直接损害脑血管内皮细胞功能,是心脑血管疾病的独立危险因子。D-D水平高表达表示纤溶活性增加,可显著升高VD 发病率[16]。本研究结果显示,治疗3 个月后,两组患者的TNF - α,CRP,IL - 6,Hcy,D- D 水平均显著降低,且研究组均显著低于对照组,表明艾地苯醌联合奥拉西坦治疗VD,可能通过修复受损的神经细胞而减轻炎性反应。这可能是由于艾地苯醌可有效抑制Hcy 氧化损伤脑组织过程,促进局部血流循环;口服可迅速被机体吸收,清除脑组织自由基,且其抗氧化活性较强,可改善VD 患者脑能量代谢,促进恢复,从而减轻炎性反应。
HO - 1 是一种重要的抗氧化酶,有助于减轻氧化应激损伤及炎性损伤[17]。FAS 系统与机体细胞凋亡调控密切相关,sFAS 和sFASL 水平可反映神经细胞凋亡状态及VD 患者神经功能缺损状况[18]。本研究结果显示,治疗3个月后,两组患者的HO-1水平均显著升高,sFAS 和sFASL 水平均显著降低,且研究组变化均更显著,表明艾地苯醌联合奥拉西坦可有效改善VD 患者的凋亡因子水平。这可能是由于艾地苯醌联合奥拉西坦可通过促进HO-1表达而影响血管损伤及氧化损伤进程,保护神经,恢复患者的认知功能。两组患者不良反应发生率相当,表明艾地苯醌安全性良好。
综上所述,艾地苯醌联合奥拉西坦治疗VD 的临床疗效良好,可改善患者的精神状态,提高认知功能及日常生活能力,降低痴呆程度,调节炎性因子和凋亡因子水平,且安全性良好。但本研究存在局限性,纳入样本量较小,对患者炎性状态、凋亡因子表达水平的影响机制尚需进一步验证。

