肝素诱导血小板减少症患者体外循环及体外膜氧合中的抗凝处理
李 哲,管玉龙,黑飞龙
肝素及低分子肝素作为抗凝剂在临床上应用广泛。 然而,少数患者在使用肝素抗凝治疗时,出现以血小板计数降低、血栓形成、皮肤坏死为主要临床表现的药物不良反应,称为肝素诱导的血小板减少症(heparin-induced thrombocytopenia, HIT)。 目前认为,HIT 是一种由肝素或低分子肝素引起的抗体介导的药物不良反应;在接受肝素治疗的成年人中,其患病率约为0.5%~5%[1]。 但不同手术HIT 患病率有所不同,有研究表明,胸内及锁骨下血管介入手术HIT 发病率较高,静脉重建手术次之[2]。 而在体外膜氧合(extracorporeal membrane oxygenation,ECMO)患者中,虽然发生血小板数量减少的概率可高达25%,但最终确诊HIT 约为3.7%;值得注意的是,HIT 的患病概率与ECMO 持续时长并无明显相关性[3]。 HIT 是一种血栓前状态,如果不及时干预,往往会造成严重的血栓栓塞并发症。 Brown 等[4]发现,HIT 患者的手术死亡率为21.8%,而非HIT 患者的手术死亡率为5.3%;其中,29.1%的HIT 患者发生血栓栓塞事件,而非HIT 患者发生该事件的比例为2.9%。 因此,尽早的诊断与合理的处理对HIT 十分重要。 ECMO 是一种改良的体外循环(extracorporeal circulation,ECC)技术,它们均需经由人工回路将血液引出人体,通过人工肺氧合、去除二氧化碳,再泵回体内。 在此过程中,为避免血液暴露于人工材料时发生血栓并发症,常常使用肝素进行全身抗凝处理。 而当患者确诊HIT 时,肝素的使用将会成为十分谨慎的事情。
1 HIT 机制
HIT 发病机制涉及肝素-血小板4 因子(platelet factor 4,PF4)复合物的形成,PF4 由巨核细胞合成,储存于巨核细胞和血小板α 颗粒中,携带正电荷。当与带负电荷的肝素结合后,PF4 构象改变,暴露出新的抗原决定簇,诱发机体产生免疫反应,与IgG 抗体结合形成复合物IgG-PF4-H[5]。 该复合物可聚集于细胞表面,激活单核细胞及内皮细胞,促使其释放组织因子,引起内皮损伤,引发凝血级联放大反应;在血浆中还可与Fcγ 受体Ⅱa(FcγRIIa)结合,进一步活化血小板,释放更多PF4,形成恶性循环,最终消耗大量血小板[5]。
2 HIT 诊断
病史及临床表现是HIT 诊断的基础,患者既往或正在使用肝素,血小板计数明显下降,伴或不伴血栓栓塞并发症即可怀疑HIT。 HIT 疑似患者应在动态监测血小板数量的基础上采用4T’s 评分进行临床危险度分层[1,6]。 该评分主要通过四个方面去评估患者的HIT 风险:血小板减少的数量特征、血小板减少的时间特征、血栓形成的类型以及其他导致血小板减少的原因(表1)。 需要注意的是,该评分对于HIT 诊断敏感度较高,具有较高的阴性预测值,低度临床可能性(≤3 分)患者可基本排除HIT;但特异度有限,对于中高临床可能性(>3 分)的患者,则需实验室检查进一步明确[6]。
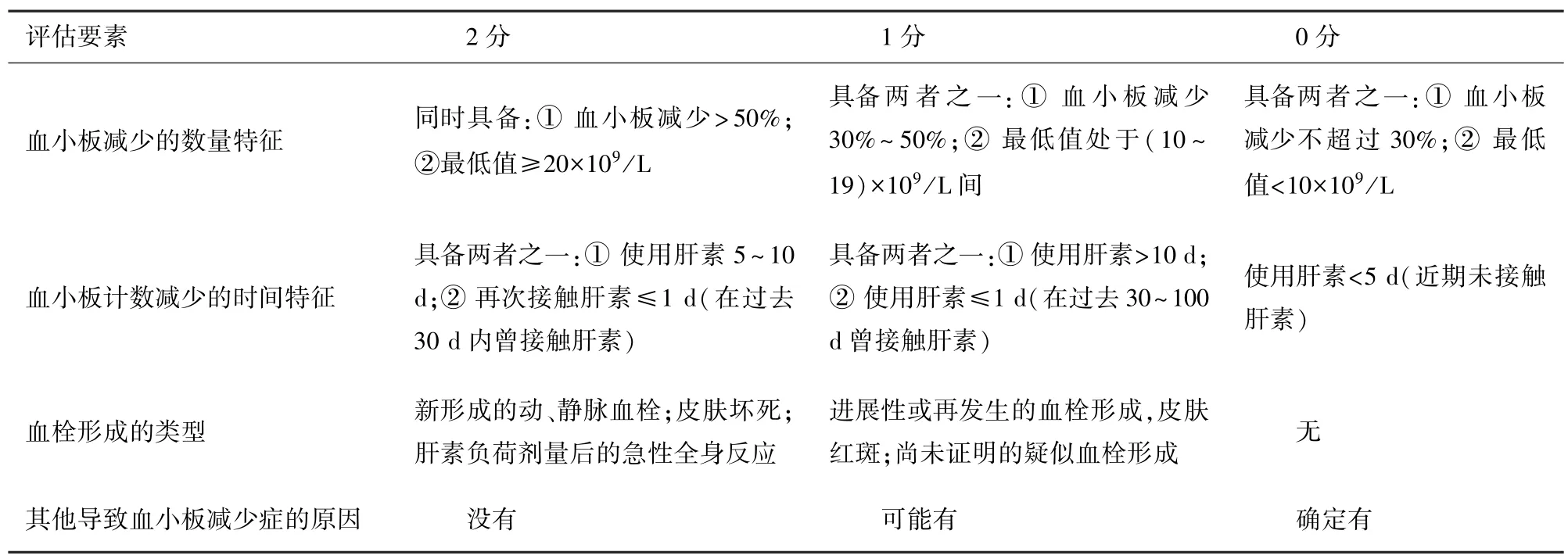
表1 4T's 评分
针对4T’s 评分的上述缺陷,如何更好地评估患者HIT 的可能性也成为了当前研究的方向之一。HIT 专 家 概 率 评 分(HIT expert probability score,HEP)综合了较4T’s 更多的临床特征,包括血小板计数下降程度、下降时间、最小计数、血栓、皮肤坏死、急性全身性反应、出血以及有无其它血小板减少诱因,针对每项指标赋予不同评分,最终亦通过累计分数对患者HIT 可能性进行分层。 然而,目前对于HEP 的预测能力仍有争议,部分研究表明,对于特定人群,该评分较4T’s 评分可能有更好的表现。 而对于更广泛的人群,HEP 的预测能力可能与4T’s相似[7]。 但是当前,HEP 评分的复杂性使其在临床中的推广及应用存在一定的困难。 因此,除HEP外,也有研究着力于构建改良型4T’s 评分,但该评分的运用亦需要更多临床试验的进一步验证[8]。
针对中高临床可能性的患者,需采用实验室检查进一步明确,包括血小板功能分析试验和HIT 抗体检测等[9]。 HIT 抗体检测主要采用的是酶联免疫吸附试验,包括混合抗体(IgG、IgA、IgM)检测和IgG特异性抗体检测;其中,HIT 混合抗体诊断特异性较低,但敏感性较高,仅可用于排除诊断;IgG 特异性抗体诊断的特异性高,在设定合理临界值的基础上,结合临床评估可实现诊断[9-10]。
功能试验主要是检验在肝素存在的前提下患者血清诱导激活血小板的能力,以此诊断HIT,主要包括5-羟色胺释放试验(Serotonin release assay,SRA)、肝素诱导的血小板活化试验等。 其中以SRA敏感性和特异性较高,被认为是HIT 诊断的金标准。 但功能试验耗时长,操作技术要求高,仅可在少数实验室完成,因此仅做确诊实验[10]。
3 HIT 患者肝素替代抗凝方案
患者一经诊断或者高度怀疑HIT 应立即停用肝素,并接受非肝素类抗凝药物治疗[6]。 HIT 患者肝素替代抗凝药物见表2。

表2 肝素诱导血小板减少症患者肝素替代抗凝药物
3.1 直接凝血酶抑制剂(direct thrombin inhibitors,DTI) 与肝素相比,DTI 有诸多优点。 首先,DTI 直接结合凝血酶,不消耗抗凝血酶,使其在抗凝血酶活性较低的患者中更为可靠。 其次,DTI 不存在HIT相关抗原,可避免诱发HIT。 但需要注意的是,当前DTI 除达比加群外,其余均无特异性拮抗药物[11]。
3.1.1 比伐卢定 可逆性结合凝血酶,2 ~4 min 即可发挥作用。 比伐卢定20%经肾脏代谢,80%经血浆蛋白酶水解,其在肾功能正常的患者体内半衰期为25 min[12]。 经血浆蛋白酶水解是比伐卢定应用的优势,但血流瘀滞区域蛋白酶水解加快,低温时水解减慢,这在ECMO 及ECC 过程中需要额外注意。美国ECC 抗凝指南建议,HIT 患者ECC 中采用DTI抗凝时推荐使用比伐卢定,可先经静脉给予负荷剂量1.5 mg/kg,ECC 管路中预充50 mg,术中以2.5 mg/(kg·h)泵入,维持血药浓度10 ~15 mg/L,结束时ECC 系统可追加50 mg 防止血栓形成[13]。 蝰蛇毒凝血时间(ecarin clotting time,ECT)与比伐卢定抗凝水平线性相关性较强,但当前开展ECT 检查的医院较少,所以临床工作及研究中更多还是以活化凝血时间(activated clotting time, ACT)及活化部分凝血酶时间(activated partial thromboplastin,APTT)衡量;当前认为,维持ACT 或APTT 于正常值2 ~3 倍是较为合理的ECC 抗凝水平区间,部分研究认为需维持ACT≥450 s 才能达到ECC 的抗凝要求[14-15]。对于ECMO 患者,可以2.5 μg/(kg·min)起始泵注,以APTT 50~70 s 为目标调整泵注速度[14,16]。
当前,比伐卢定抗凝治疗的有效性及安全性已经得到一定的验证:与肝素相比,比伐卢定能够降低ECMO 运转期间患者对于血制品的需求,减少患者的死亡率[17-18]。 近期一项荟萃分析对此进行了一定的探究与总结:对于小儿ECMO,比伐卢定可显著降低出血、血栓形成和住院死亡的概率;对于成人ECMO,出血发生率、30 d 死亡率和ECMO 运转时间亦有所降低[19]。 另一方面,对于ECC 期间比伐卢定应用的安全性,Carlson 等[20]进行了一定的探索。 研究发现,ECC 期间采用比伐卢定抗凝的患者,其30 d死亡率与肝素组相比有所降低;在校正血小板减少程度和回路长度后,肝素组与比伐卢定组在30 d 死亡率、血栓形成及出血等方面未见明显差异。
3.1.2 阿加曲班 与比伐卢定类似,均为可逆性结合凝血酶发挥抗凝作用,但起效时间较比伐卢定慢(30 min),药物半衰期稍长(40~50 min)。 阿加曲班经肝脏代谢,中度肝功能不全患者体内半衰期延长至152 min。 当前,阿加曲班的最佳剂量仍有待进一步探索,对于ECMO 患者,可给予2 μg/(kg·min)维持,ECC 则为5 ~25 μg/(kg·min)[12,14]。 对于其抗凝水平监测,当前亦有争议,部分研究认为阿加曲班用于ECMO 抗凝需维持APTT 1.5~2.5 倍正常值,ECC 中抗凝则需维持ACT 300~400 s[21]。 关于阿加曲班在ECMO 中的应用,Fisser 等[22]在一项回顾性分析中发现,使用阿加曲班抗凝的患者血栓相关并发症发生率并未显著增加,同时患者血小板数量下降程度更小,所需的血制品也相对更少。 Geli 等[23]分析了13 项相关研究,发现多数研究在使用阿加曲班进行ECMO 抗凝时未使用负荷剂量,泵注剂量为0.05~2 μg/(kg·min),其中大多采用APTT 评估抗凝水平,其最佳水平位于43 ~70 s 至60 ~100 s 之间,部分以活化凝血时间进行评估,维持其位于150~210 s 至180~230 s 之间。 该分析认为,阿加曲班用于ECMO 抗凝,其出血和血栓栓塞并发症发生率与使用肝素抗凝的患者相当,但不足的是当前研究多为病例报告和小规模人群,尚无关于阿加曲班作为ECMO 患者一线抗凝剂的报道。
3.2 因子Xa 抑制剂
3.2.1 达那肝素(Danaparoid) 达那肝素是低分子量、硫酸化糖胺聚糖的混合物,包括硫酸肝素、硫酸皮肤素和硫酸软骨素,主要通过抗凝血酶增强对凝血因子Xa 和凝血酶的抑制,发挥抗血栓形成的作用。 该药物大部分经由肾脏排除,所以肾功能不全的患者易造成药物蓄积。 当前,达那肝素在加拿大、日本、欧洲和澳大利亚可用于HIT 的替代抗凝,但由于其半衰期较长(22 h),无拮抗药物,抗凝效果有限,当前关于ECMO 及ECC 的研究仍较少[24]。 目前,ECMO 中可采用1.2~2 U/(kg·h)维持抗Xa 活性0.4~0.8 U/ml,行ECC 时应先于ECC 系统中加入3 000 U,静脉注射负荷剂量100 U/kg,后续予以200 U/h 泵入,维持抗Xa 活性1.2~1.8 U/ml[12,25]。
3.2.2 磺达肝癸钠 该药是一种合成的高度硫酸化的五糖,可与抗凝血酶结合,对因子Xa 产生长效抑制作用,但对凝血酶无抑制作用。 磺达肝癸钠皮下注射后吸收迅速(30 min),但其半衰期较长,可达17~21 h。 磺达肝癸钠治疗剂量很少延长APTT,可以使用抗Xa 因子测定法和药物血浆浓度测定评估抗凝水平,但考虑其药代动力学较稳定,并不需要频繁进行抗凝水平监测。 需要注意的是,磺达肝癸钠同样也可启动抗PF4 抗体的形成,但其分子量较小,通常无法引起级联放大反应激活血小板。 尽管如此,部 分 学者仍对此表示担忧[26-27]。 Schindewolf等[28]在ECMO 患者中尝试性使用磺达肝癸钠抗凝,发现使用磺达肝癸钠的患者虽然血小板计数较少,但血栓并发症发生概率相对较低。 在一项ECC 病例报告中,Khoury 等[29]采用静脉注射7.5 mg、皮下注射2.5 mg 磺达肝癸钠的方式进行抗凝。 在此期间,该患者未出现出血、血栓相关并发症。 当前,关于磺达肝癸钠在ECC 中应用的探究仍较少,其可行性仍需更多研究的进一步认证。
3.3 HIT 抗体清除 目前,为避免HIT 患者ECC 期间使用肝素抗凝引起血栓栓塞并发症,部分研究着眼于清除HIT 患者体内相应抗体,其中主要包括免疫吸附、治疗性血浆置换及免疫球蛋白的使用等。Füreder 等[30]在一项病例报告中采用半选择性免疫吸附剂清除HIT 相关抗体:该患者连续3 天进行免疫吸附治疗,第三次治疗后抗体下降至目标水平,ECC 过程中采用肝素进行抗凝,予以鱼精蛋白进行拮抗。 在后续18 个月的随访过程中,该患者均未发现血栓栓塞事件。 而在另一项回顾性研究中,Soares等[31]分析了治疗性血浆置换(therapeutic plasma exchange,TPE)和静脉注射免疫球蛋白(intravenous immune globulin,IVIG)用于HIT 患者ECC 的可能性,发现TPE 或IVIG 治疗与更高概率的住院死亡、出血和感染等结局相关。 但IVIG 与TPE 相比,死亡率、血栓形成、出血、感染、住院时间和住院费用,没有显著差异。
3.4 肝素涂层管路的使用 肝素涂层管路在HIT发生中的作用尚不明确,Pabst 等[32]在其研究中发现, 肝素涂层管路对ECMO 患者血小板数量的影响较小,停用静脉肝素后血小板短时间内亦可恢复正常。 同时, 当前大多数病例报告、队列研究显示在不更换管路的情况下,HIT 患者的血小板计数均可恢复至正常水平。
4 结 论
当前,鉴于ECMO/ECC 过程中抗凝要求较高,最适于HIT 患者的肝素替代治疗尚无法确定。 目前,比伐卢定受到较多指南及文献的推荐,但当前仍存在许多不足,限制其在临床中的应用,包括缺乏大样本随机对照试验、临床应用局限性、无特异拮抗药物、抗凝监测可信度有限等。 因此,针对比伐卢定等肝素替代抗凝剂的选择,未来仍需更多的研究探索。

