甲型肝炎病毒衣壳蛋白VP1、VP3的原核表达及其免疫原性
赵丹莹,周永飞,徐艳玲,陈子杨,唐剑光,常东英,王艺博,关诗宇,常军亮,曹玉锋
长春生物制品研究所有限责任公司,吉林 长春 130012
甲型肝炎病毒(hepatitis A virus,HAV)属于微小核糖核酸病毒科嗜肝病毒属,HAV 感染可导致甲型肝炎(简称甲肝),是一种主要引起肝脏损害的急性传染病。2008 年,甲肝疫苗纳入我国扩大免疫规划后,甲肝发病率呈明显下降趋势,由7.34/10 万(2004 年)下降至1.66/10 万(2015 年)[1],表明接种甲肝疫苗是预防甲肝的有效手段。目前,已上市甲肝疫苗包括减毒活疫苗和灭活疫苗,减毒活疫苗可能发生基因突变导致毒力返祖,安全性较低;灭活疫苗可能存在灭活不完全,具有强毒扩散的风险,且成本较高[2]。鉴于HAV 在全球流行及进化方面具有高度保守性,随着对HAV 结构蛋白及表位分布研究的深入及新型佐剂在基因工程疫苗领域应用的推广,HAV 重组亚单位疫苗成为重要研究方向。
目前,常用的佐剂包括水包油型佐剂MF59、氢氧化铝佐剂(AH)、磷酸铝佐剂(AP)、磷酸铝-CpG 寡核苷酸佐剂(AP-CpG ODN)等。其中MF59与铝佐剂的作用方式不同,其不在机体内形成抗原库,不依赖炎性小体发挥作用,不直接活化树突状细胞,而是通过刺激注射部位免疫细胞上调多种炎性趋化因子的表达,募集单核细胞分化为树突状细胞提呈抗原,并运输至淋巴结。CpG ODN佐剂与铝佐剂协同使用可在组织内形成CpG 库,使代谢速度减缓,引起更持久的免疫应答。HAV 具有直径约30 nm 的无囊膜衣壳,呈二十面体对称,包裹约7 500 bp的正义RNA 单链基因组[3]。HAV 可分为7 个基因型,但仅有1 个血清型[4],不同基因型毒株间有较好的交叉保护效应。HAV 的结构蛋白包括VP4、VP2、VP3 和VP1pX(即VP1、2A)[5],其抗原表位位于VP2、VP3和VP1上[6-7]。VP3、VP1蛋白含有主要抗原中和表位,因此,本研究通过E.coli原核表达系统分别表达重组蛋白VP1、VP3,经纯化复性后与不同佐剂配伍,免疫小鼠,并评价其免疫原性,为HAV 重组亚单位疫苗的进一步研发奠定基础。
1 材料与方法
1.1 细胞、毒株、载体及菌株 2BS细胞及HAV L-A-1株原液均由本司疫苗二室提供,载体pET-G28a及感受态E.coliBL21(DE3)由本公司生物技术研究室保存;感受态E.coliDH5α购自北京全式金生物技术有限公司。
1.2 血清 甲肝灭活疫苗免疫NIH 小鼠血清由本公司疫苗二室提供,兔抗HAV 抗血清及鼠抗HAV-VP3抗血清由本公司生物技术研究室保存。
1.3 主要试剂及仪器 总RNA 提取试剂盒购自北京博迈斯科技发展有限公司;反转录试剂盒及DNA片段纯化试剂盒均购自日本TaKaRa 公司;FastPfu DNA 聚合酶、限制性内切酶XhoⅠ和NdeⅠ均购自北京全式金生物技术有限公司;DNA 凝胶回收试剂盒购自美国Axygen 公司;无缝克隆试剂盒购自美国Clone Smart 公司;FITC 标记的鼠抗HAV 单克隆抗体由本公司生物技术研究室保存;HRP 标记的山羊抗鼠IgG 及山羊抗兔IgG 均购自北京中杉金桥生物技术有限公司;DAB 显色试剂盒购自北京索莱宝科技有限公司;SP Bestarose FF 购自上海博格隆生物技术有限公司;DEAE Sepharose Fast Flow 购自美国GE Healthcare 公司;NanoPhotometer N60 超微量分光光度计购自德国IMPLEN公司。
1.4 实验动物 SPF 级BALB/c 小鼠,雌性,6~8 周龄,体质量18~20 g,由本公司动物室提供,动物许可证号:SCXK(吉)-2017-0005。本实验对小鼠的所有处理均以科研为目的进行养殖和使用,且按照本公司动物伦理相关规定进行。
1.5 引物的设计及合成 根据GenBank 中登录的HAV L-A-1 株基因序列(AF314208.1),应用Primer Premier 5.0 软件设计引物,见表1,由吉林省库美生物科技有限公司合成。

表1 用于PCR扩增的引物序列Tab.1 Primer sequences for PCR amplification
1.6 目的基因的扩增 用总RNA提取试剂盒提取HAV L-A-1株的总RNA,以2B-R为引物,逆转录合成cDNA,以其为模板,VP1-F/R和VP3-F/R为引物,分别扩增目的基因VP1和VP3。PCR反应条件为:95 ℃预变性2 min;95 ℃变性20 s,41 ℃(VP1)/49 ℃(VP3)退火20 s,72 ℃延伸1 min,共35个循环;72 ℃再延伸5 min。PCR产物经1%琼脂糖凝胶电泳鉴定,并纯化回收。
1.7 重组表达质粒的构建 将载体pET-G28a经NdeⅠ和XhoⅠ双酶切后,回收载体片段,以无缝克隆试剂盒中的同源重组酶分别与目的片段于50 ℃连接20 min;连接产物转化至感受态E.coliDH5α,涂布于含50 μg/mL 卡那霉素LB 固体培养基,37 ℃培养16 h;经菌落PCR 鉴定,阳性单克隆送吉林省库美生物科技有限公司测序,将测序正确的质粒命名为pET-G28a-VP1和pET-G28a-VP3。
1.8 目的蛋白的诱导表达 将重组表达质粒pET-G28a-VP1及pET-G28a-VP3转化至感受态E.coliBL21(DE3),涂布于含50 μg/mL 卡那霉素的LB 固体培养基,37 ℃培养16 h;挑取单克隆,接种于含50 μg/mL卡那霉素的LB液体培养基,进行扩大培养,至A600=0.6~0.8时,加入终浓度为1 mmol/L的IPTG,于37 ℃诱导5 h;10 000 ×g离心1 min,收集1.5 mL 菌体,用200 μL注射用水重悬,进行超声破碎,分别取破碎上清及沉淀,进行12%SDS-PAGE分析。
1.9 目的蛋白的纯化 收集VP1和VP3的重组菌,分别 用50 mmol/L Tris-HCl(pH 8.0)和50 mmol/L Tris-HCl(pH 6.0)缓冲液按1∶10(W/V)的比例重悬,在800 bar压力下循环均质3次;于4 ℃,10 000×g离心30 min,收集沉淀,依次用包涵体洗液A[50 mmol/L Tris-HCl、0.5mmol/LEDTA、0.5%(V/V)TritonX-100,pH 7.0]、洗液B(50 mmol/L Tris-HCl、0.5 mmol/L EDTA、2 mol/L NaCl,pH 7.0)、洗液C(50 mmol/L Tris-HCl、0.5 mmol/L EDTA、2 mol/L 尿素,pH 7.0)进行洗涤。将包涵体分别置于含8 mol/L 尿素的50 mmol/L Tris-HCl(pH 8.0)和50 mmol/L Tris-HCl(pH 6.0)中,4 ℃放置过夜;变性后的VP1、VP3包涵体均经0.45 μm 滤膜抽滤,分别上样于阴离子交换层析柱(SP Bestarose FF)和阳离子交换层析柱(DEAE Sepharose Fast Flow)进行纯化,流速均为1 mL/min;收集流穿峰,用含1 mol/L NaCl 的洗脱液洗脱目的蛋白,流速均为1 mL/min,收集洗脱峰。流穿峰及洗脱峰样品经12%SDS-PAGE分析。
1.10 目的蛋白的复性及鉴定 VP1和VP3纯化蛋白中分别滴加等体积的pH 为8.0 及6.0 的包涵体复性液(50 mmol/L Tris-HCl、1 mmol/L EDTA、0.5 mol/L L-精氨酸、0.2 mmol/L 氧化型谷胱甘肽、2 mmol/L 还原型谷胱甘肽),充分搅拌,收集于透析袋,分别置含有3 mol/L 尿素的复性液(pH 同上)中进行梯度透析,逐步降低外透液(复性液)中的尿素浓度,直至外透液中不含尿素,每次换液间隔48~72 h;将透析袋置PEG20000 中进行浓缩,用NanoPhotometer N60 超微量分光光度计对浓缩后重组蛋白进行定量分析。取复性浓缩的重组蛋白VP1、VP3,经12%SDS-PAGE 分离后,转移至PVDF 膜上,用含20% FBS 的PBS 于室温封闭1 h;PBST 洗涤3 次,分别加入兔抗HAV 抗血清(1∶1 000 稀释)及鼠抗HAV-VP3 抗血清(1∶100 稀释),4 ℃孵育过夜;PBST 洗涤3 次,分别加入HRP 标记的山羊抗兔IgG 和山羊抗鼠IgG(均1∶5 000 稀释),室温孵育1 h;PBST 洗涤5 次,用DAB 显色试剂盒室温避光显色。
1.11 动物分组及免疫 将小鼠随机分为VP1-MF59、VP1-AH、VP1-AP、VP1-AP-10CpG、VP1-AP-50CpG、VP3-AP、VP3-VP1-AP及PBS对照组,每组5只,VP1-MF59 组抗原与佐剂按等体积分数混合,其他组中AH 及AP 终浓度均为1 mg/mL,10CpG 和50CpG 终浓度分别为20 和100 μg/mL。给药剂量及途径见表2。于0、1、2 周各免疫1 次,首次免疫后5 周,经小鼠内眦静脉采血,分离血清。

表2 动物分组及免疫信息Tab.2 Animal grouping and immune related information
1.12 小鼠血清IgG抗体效价的测定 采用间接ELISA法。用0.05 mol/L碳酸盐包被液将抗HAV 单克隆抗体稀释至6 μg/mL,加入96 孔板,100 μL/孔,4 ℃包被24 h;加入含20%FBS的PBS,200 μL/孔,于4 ℃封闭16 h;加入HAV L-A-1 株原液(用含3% FBS的PBS稀释至2 μg/mL),120 μL/孔,37 ℃孵育3 h;加入待测血清(从1∶4 起进行2 倍系列稀释,共10个稀释度),100 μL/孔,37 ℃孵育1 h;PBST 洗涤3次,加入HRP 标记的山羊抗鼠IgG(1∶6 000 稀释),100 μL/孔,37 ℃孵育30 min;PBST 洗涤5 次;加入TMB 显色底物,37 ℃避光孵育15 min,用2 mol/L硫酸终止反应,用酶标仪检测A450。以阴性孔平均值的2.1倍为Cutoff值,以判为阳性(≥Cutoff值)的血清最大稀释倍数为其抗体效价。
1.13 小鼠血清中和抗体效价的测定 采用快速荧光灶免疫抑制试验。取VP1-AP、VP3-VP1-AP、PBS对照组小鼠血清,于56 ℃灭活30 min,进行2 倍系列稀释,共7个稀释度,与200 CCID50/mL HAV 等体积混合,接种至铺有2BS 细胞的96 孔板(融合度为70%),每个稀释度均设8 个复孔,同时设病毒对照(100 CCID50/mL HAV L-A-1 株和2BS 细胞)和细胞对照(仅含2BS细胞)。于37 ℃,5%CO2孵箱培养7 d;弃细胞上清,PBS 洗涤1 次,加入-20 ℃预冷的80%丙酮,室温固定20 min;弃固定液,挥发至干,以含10%FBS的PBS室温封闭20 min;PBS洗涤3次,加入FITC 标记的鼠抗HAV 单克隆抗体(1∶50 稀释),50 μL/孔,室温孵育2 h;PBST 洗涤3 次,加入95%甘油封片,于荧光显微镜下观察计数,采用Reed-Muench法计算血清中和抗体效价。
1.14 统计学分析 应用GraphPad Prism 5.0 和Excel软件进行统计学分析,组间血清效价的比较采用单因素方差分析(One-way Anova),以P<0.05 为差异有统计学意义。
2 结果
2.1 目的基因的鉴定 目的基因VP1和VP3的PCR产物经1%琼脂糖凝胶电泳分析,分别可见1 035 和735 bp的特异条带,大小与预期一致,见图1。

图1 目的基因PCR产物电泳图Fig.1 Electrophoretic profile of PCR products of target genes
2.2 重组表达质粒的鉴定 含有pET-G28a-VP1和pETG28a-VP3的重组菌菌落PCR 扩增产物经1%琼脂糖凝胶电泳鉴定,分别可见1 035和735 bp的目的基因条带,大小与预期一致,见图2。测序结果表明,重组表达质粒pET-G28a-VP1和pET-G28a-VP3的目的基因序列分别与HAV L-A-1株VP1、VP3基因序列完全一致。

图2 含有pET-G28a-VP1 和pET-G28a-VP3 的重组菌菌落PCR鉴定Fig. 2 Colony PCR identification of recombinant colonies pET-G28a-VP1 and pET-G28a-VP3
2.3 表达产物的鉴定 含有pET-G28a-VP1及pETG28a-VP3重组菌的破菌上清及沉淀经12% SDSPAGE 分析,分别可见相对分子质量约37 000 和26 000 的VP1 和VP3 目的蛋白条带,且主要以包涵体形式存在,见图3。重组蛋白VP1和VP3表达量分别为18.6%和32.4%。

图3 重组蛋白VP1和VP3的SDS-PAGE分析Fig.3 SDS-PAGE analysis of recombinant proteins VP1 and VP3
2.4 纯化产物的鉴定
2.4.1 SDS-PAGE 分析 变性后的VP1、VP3 包涵体的阴离子交换层析柱及阳离子交换层析柱图谱见图4。流穿峰及1 mol/L NaCl 洗脱峰样品经12%SDS-PAGE分析,均可见相对分子质量约为37 000和26 000 的重组蛋白VP1 和VP3 目的条带,见图5。重组蛋白VP1和VP3纯度分别为86.3%和84.7%。

图5 重组蛋白VP1(A)和VP3(B)纯化产物的SDS-PAGE分析Fig. 5 SDS-PAGE analysis of purified products of recombinant proteins VP1(A)and VP3(B)
2.4.2 Western blot 鉴定 重组蛋白VP1 和VP3 纯化产物复性后的浓度分别达0.80 和1.28 mg/mL,且分别可与兔抗HAV 抗血清及鼠抗HAV-VP3 抗血清发生特异性反应,于相对分子质量约37 000 和26 000处可见特异性结合条带,见图6。

图6 重组蛋白VP1(A)和VP3(B)纯化产物的Western blot分析Fig. 6 Western blot analysis of purified products of recombinant proteins VP1(A)and VP3(B)
2.5 小鼠血清抗体效价 与PBS 对照组比较,VP1-AH、VP1-AP、VP1-AP-10CpG、VP1-AP-50CpG、VP3-AP 及VP3-VP1-AP 组小鼠血清IgG 抗体效价均明显升高(q= 4.99~26.65,P均<0.05),VP1-MF59 组差异无统计学意义(q= 0. 71,P>0.05)。VP1-AP-50CpG 组小鼠血清的IgG 抗体效价显著高于VP1-AP组(q=22.05,P<0.01),表明免疫制剂配伍中添加100 μg/mL 的CpG 有利于增强重组抗原VP1 的免疫原性。VP3-VP1-AP组小鼠血清的IgG抗体效价显著高于VP1-AP及VP3-AP组(q分别为22.05和24.49,P均<0.01),表明重组蛋白VP3、VP1 联合免疫较单独免疫能引起更强烈的免疫应答。见图7。
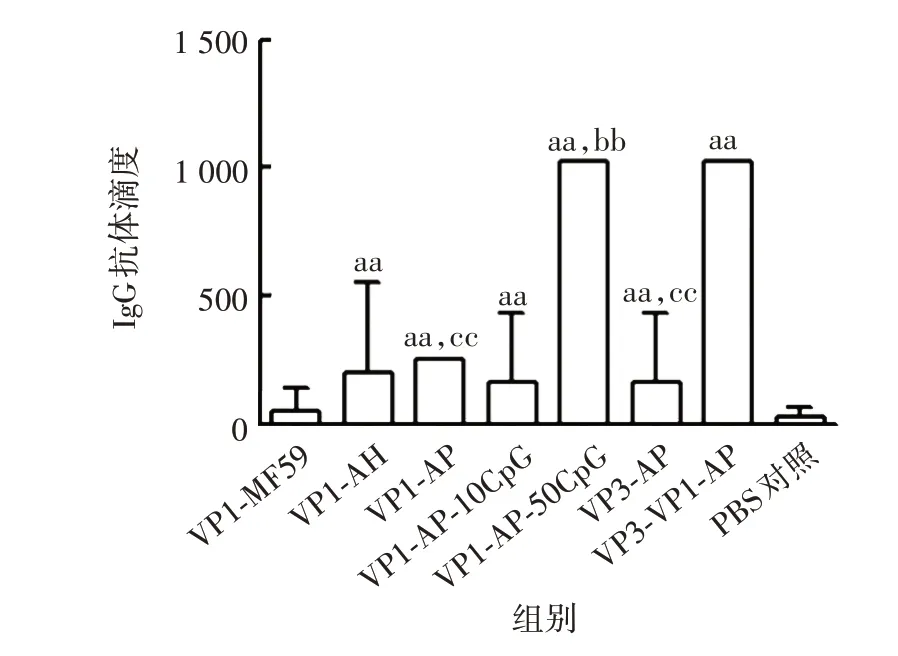
图7 重组蛋白VP1和VP3小鼠免疫血清的IgG抗体效价Fig. 7 IgG antibody titer in serum of mice immunized with recombinant proteins VP1 and VP3
2.6 小鼠血清的中和抗体效价 VP1-AP、VP3-VP1-AP 及PBS 对照组小鼠血清中和抗体效价分别为1∶20、1∶40 和1∶11。与PBS 对照组比较,VP1-AP 及VP3-VP1-AP 组小鼠血清的中和抗体效价显著升高(q分别为7.79和25.11,P<0.01)。
3 讨论
HAV基因组由1个5'非翻译区(untranslated region,UTR)、1个开放阅读框(open reading frame,ORF)和1个3'UTR组成,ORF编码的蛋白可裂解为3个多聚蛋白前体P1、P2 和P3,其中P1 编码结构蛋白VP4、VP2、VP3 和VP1pX[8]。HAV 的主要中和抗原表位存在于VP1 和VP3 上,也存在于VP1 上的某肽段和VP3 上的部分氨基酸共同构成的空间构象上[9]。本研究选取的表位为HAV 中高度保守的VP1及VP3基因序列,确保该疫苗可激发较强的免疫反应。目前,国内外有多家甲肝减毒活疫苗及灭活疫苗上市,暂无重组疫苗上市[10-12]。有研究表明,重组蛋白VP1 在E.coli系统中成功表达,且能够诱导中和抗体反应,抑制HAV 增殖[13-14]。奎翔[15]研究表明,将HAV 的VP1 与戊型肝炎病毒(hepatitis E virus,HEV)ORF2 结构域嵌合表达后可形成病毒样颗粒(virus-like particles,VLPs),其可激发宿主产生针对于HAV的中和抗体;沈智俊等[16]利用Bac-to-bac 杆状病毒表达系统共表达HAV的P1、P3,形成直径约50 nm的VLPs,证明HAV重组疫苗是一种具有巨大潜在应用前景的疫苗。
佐剂作为非特异性增强疫苗免疫原性的辅助物质,已广泛应用于多种疫苗的研发。目前,已上市HAV 疫苗采用氢氧化铝、明矾、脂质体等多种传统佐剂[17-18]。本研究对多种佐剂进行了筛选,还比较了不同剂量CpG 的效果,结果表明,与重组蛋白VP1 配伍的佐剂中,AP 佐剂组免疫小鼠血清IgG 抗体效价最高;在AP佐剂的基础上添加了100 μg/mL的CpG,免疫原性显著增强,CpG 通过与胞浆内Toll样受体9(Toll-like receptor 9,TLR9)结合活化转录因子,上调多种Th1 类细胞因子和趋化因子的表达,从而快速活化B 淋巴细胞,增强免疫应答作用[19-21]。CpG ODN 佐剂较传统佐剂能更快地诱导机体产生保护性抗体,增强细胞免疫应答,减少抗原免疫剂量及简化免疫程序[22-24]。CpG ODN 佐剂通过与铝佐剂协同使用,在组织内形成CpG 库,使其代谢速度减缓,从而引起更持久的免疫应答[25]。美国Dynavax 公司的CPG-乙肝疫苗产品已获批上市;我国首个采用双佐剂(CpG ODN 佐剂、铝佐剂)的重组乙型肝炎疫苗(云南沃森生物技术股份有限公司)已完成Ⅰ期临床试验[26]。
本研究采用E.coli系统分别表达了HAV 衣壳蛋白VP1、VP3,并筛选了不同免疫制剂,发现重组蛋白VP1 较VP3 具有更好的免疫原性,VP3-VP1 联合免疫较重组蛋白VP1 单独免疫能引起更强的免疫应答,提示VP3-VP1 有望成为重要的候选抗原。本研究为重组甲肝疫苗的研发提供了新的思路。

