非小细胞肺癌肝转移预后的列线图构建
邓跃扬, 廖志晓, 朱津丽, 周京旭, 董 硕, 贾英杰
(1. 天津中医药大学第一附属医院 肿瘤科, 天津, 300193; 2. 国家中医针灸临床医学研究中心, 天津, 300193;3. 广州中医药大学第一临床医学院,广东 广州,510405;4. 广州中医药大学第一附属医院 肿瘤科, 广东 广州, 510405)
肺癌在全球恶性肿瘤中的发病率和致死率均居前列。约85%的肺癌患者为非小细胞肺癌(NSCLC), 超过50%的患者在确诊时已处于晚期阶段[1]。肝转移是NSCLC患者常见且预后最差的转移类型[2],晚期肝转移的发生率可达20%[3], 患者中位总生存时间(OS)约为7个月[4-5]。相较于脑转移与骨转移,目前有关NSCLC肝转移的临床特征、治疗方式、预后评估的研究仍比较欠缺。本研究基于监测、流行病学和最终结果(SEER)数据库探讨NSCLC肝转移患者的临床特征及预后相关因素,并构建OS和癌症特异性生存率(CSS)列线图,通过更准确地预测NSCLC肝转移患者的生存情况,及早识别出高风险患者并采取分层治疗,现将结果报告如下。
1 资料与方法
1.1 一般资料
使用SEER*Stat软件(8.3.9版)下载2010—2019年诊断为原发性NSCLC患者的临床资料。纳入标准: ① 年龄≥18岁的成年患者; ② 患者只有1个原发性肿瘤; ③ 经阳性组织学确诊为NSCLC者; ④ 患者具有完整的临床病理及生存信息。排除标准: ① 通过尸检或仅根据死亡证明获得诊断者; ② 生存时间及死亡原因未知者; ③ 病理分级、TNM分期、肿瘤直径、转移器官、治疗记录缺失或不完整者。最终纳入79 977例原发性NSCLC患者,并分为肝转移组与非肝转移组。具体流程见图1。

本研究以OS和CSS为结局指标, OS被定义为肺癌诊断至任何原因导致的死亡的随访时间, CSS被定义为肺癌诊断至因肺癌死亡的随访时间。本研究已签署《SEER数据使用协议》,鉴于数据库的公开数据均已消除识别信息,因此不需要知情同意和伦理审查。
1.2 统计学分析
将原发性NSCLC患者分为肝转移组与非肝转移组,并将肝转移组又分为训练集与验证集(比例为7∶3), 训练集用于构建列线图和风险分类系统,验证集用于验证模型。年龄和肿瘤直径的最佳截断值由X-tile软件确定。采用χ2检验比较分析肝转移组的临床特征。采用Cox比例风险回归分析筛选独立预后因素,将单因素分析中P<0.05的因素纳入多因素分析。根据多因素分析的结果建立OS和CSS列线图,并使用受试者工作特征(ROC)曲线和校准曲线验证模型的区分度和校准度。基于训练集患者的列线图总分建立风险分类系统,将患者分为高风险和低风险预后组,通过Kaplan-Meier方法和Log-rank检验比较组间的生存差异。采用SPSS 26.0和R 4.1.2软件进行数据处理。随机分组、χ2检验和Cox回归分析使用SPSS软件。列线图和校准曲线使用R软件的“survival”和“rms”包生成。ROC曲线使用“survival”和“timeROC”包绘制。Kaplan-Meier生存曲线使用“survival”“tibble”“survminer”和“ggplot2”包制作。检验水准(α)为0.05。
2 结 果
2.1 肝转移与非肝转移NSCLC患者的临床特征比较
纳入的NSCLC患者的临床特征见表1。结果表明,性别、年龄、原发部位、组织学分类、病理分级、肿瘤直径、T分期、N分期、远处转移、手术、化疗、放疗与肝转移相关,组间差异有统计学意义(P<0.001); NSCLC患者中,男性、年龄18~71岁、肺上叶部位、鳞癌、低分化程度、肿瘤直径>2.6 cm、T4期、N2期、有骨转移、无脑转移、无肺转移患者发生肝转移的比率相对较高。从治疗方面来看,肝转移患者更少接受原发部位和转移部位手术以及放疗,而更多接受化疗。此外,发生肝转移患者的中位生存时间短于未发生者。
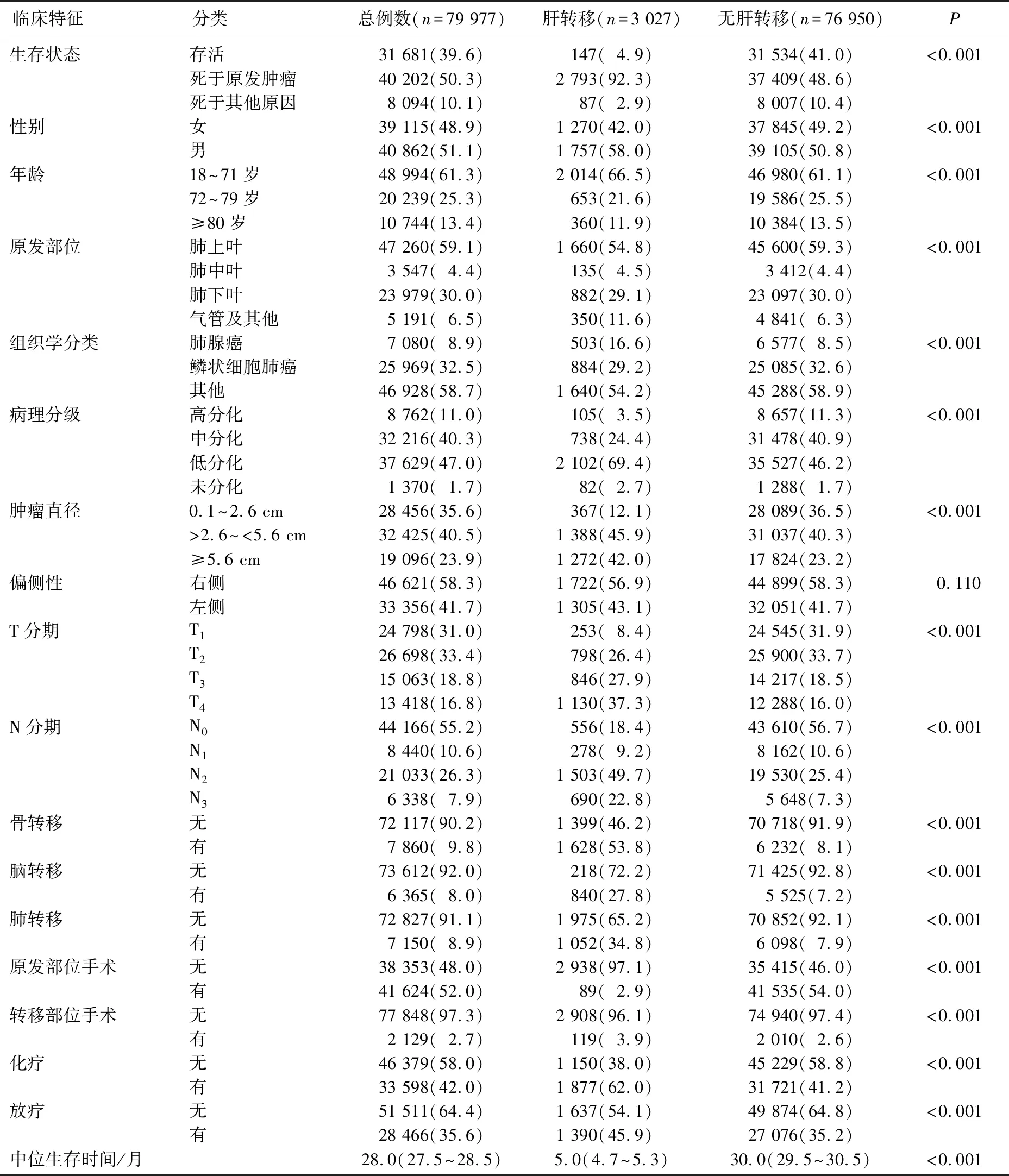
表1 肝转移与非肝转移NSCLC患者临床特征比较[n(%)]
2.2 NSCLC肝转移患者OS和CSS的预后因素
单因素分析结果显示, N分期、偏侧性、转移部位手术、放疗、肺转移与OS无显著相关性(P>0.05), N分期、原发部位、偏侧性、转移部位手术、放疗与CSS无显著相关性(P>0.05)。多因素分析发现,年龄、性别、肿瘤直径、组织学类型、病理分级、原发部位手术、化疗、骨转移、脑转移均是OS和CSS的独立影响因素(P<0.05)。见表2。

表2 OS和CSS的多因素Cox回归分析

2.3 预后列线图的构建
基于OS和CSS的独立危险因素分别构建列线图。根据列线图可得到每个因素对应的分值,通过分值相加得到的总分定位在总分轴上即可确定1、3年OS和CSS的估计概率。
在OS和CCS列线图中,化疗对预后的影响最为显著,其次是原发部位手术; 病理分级、有无骨转移、有无脑转移、年龄和组织学类型对预后的影响中等,而肿瘤直径及性别对预后的影响不大。见图2。
2.4 列线图的评价和验证
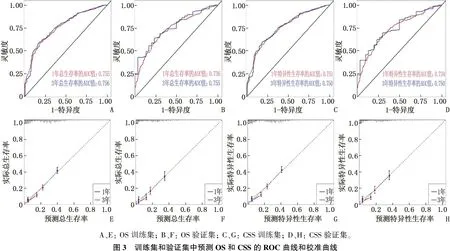
ROC曲线显示, OS列线图训练集1、3年的曲线下面积(AUC)分别为0.755、0.756, 在验证集中分别为0.736、0.755。CSS列线图训练集1、3年的AUC分别为0.751、0.750, 在验证集中分别为0.734、0.750, 表明模型具有良好的区分能力。1、3年OS和CSS的校准曲线接近45°对角线,提示列线图预测的存活率与实际观察值具有良好的一致性。见图3。
2.5 风险分层系统
使用X-tile软件计算列线图总分与预后相关的最佳临界值,结果显示最佳OS阈值为204.22, 最佳CSS阈值为203.90。训练集和验证集的Kaplan-Meier曲线显示,低风险组的预后优于高风险组,差异有统计学意义(P<0.001), 提示该风险分层能够较准确地识别出高危患者群体,并将患者分成预后有显著差异的2个风险亚组。见图4。

3 讨 论
肝转移是影响NSCLC患者预后和引起死亡风险增高的关键因素[6], 即使是单一肝脏转移的患者,也需要给予足够的治疗强度。本研究主要分析了SEER数据库中NSCLC患者临床特征与肝转移发生率的关系,进一步建立了预测NSCLC肝转移患者生存率的列线图,其中包含了化疗、原发部位手术、病理分级、骨转移、脑转移、年龄、组织学类型、肿瘤直径和性别共9个变量, ROC曲线和校准曲线结果表明,列线图具有良好的预测效能,可以为更早发现高危患者及更有效地治疗肝转移患者提供临床指导。
本研究中,年轻患者发生肝转移的风险较高,其原因可能是年轻患者拥有较好的血管生成微环境,由此可促进肿瘤生长和转移,且其较长的生存期增加了发生转移的风险时间,同时肿瘤需要更具侵袭性才能逃脱年轻个体的免疫监测。此外,老年患者因细胞增殖变慢,激素浓度以及细胞对激素的反应性发生改变,肿瘤生长转移的血管化生受损,因而肿瘤的侵袭性降低[7]。因此,临床上对年龄较小的肺癌患者应加强监测,以了解是否发生肝转移,并制订完善的临床策略以改善预后。本研究证实, NSCLC肝转移患者的生存时间与性别、年龄、组织学类型、病理分级、肿瘤直径、骨转移、脑转移、原发部位手术、化疗等因素有关; 其中,肿瘤病理分级越高,组织侵袭性越强,相应的生存期也越短; 肿瘤越大,患者的预后越差,这可能是因为更大的肿瘤会产生更多的克隆形成细胞,且随着肿瘤增大,肿瘤细胞对治疗的敏感性也会降低[8]。合并远处转移的肺癌患者预后不良这一结论已达成普遍共识,有研究[9]进一步发现多器官多灶转移与更短的无进展生存期(PFS)(0~1个器官为5.7个月, 2~3个器官为3.5个月, ≥4个器官为2.7个月)和较低的疾病缓解率(36%、29.8%、18.2%)相关,差异有统计学意义(P<0.001)。
NSCLC肝转移患者的预后较差。目前单一的治疗方法都有一定的局限性,且长期疗效不佳,而综合治疗往往能够提高疗效,但仍需进一步研究来阐明最佳治疗方案。由于已出现肝转移灶,相当比率的患者不能接受根治性肺切除术。本研究发现原发部位手术可较为显著地改善患者的生存率,回顾性研究[10]也显示姑息性肺切除术的死亡率低于2%, 5年生存率为11%~30%。当肝转移灶为单个或局限于1个肝叶时,可选择手术切除。研究[11]提出,虽然肝转移瘤手术近期疗效佳,但长期预后不佳,中位PFS仅为6.3个月,最终均死于肿瘤进展。本研究同样发现肝转移灶手术治疗的效果并不理想。
对于不能手术的肺癌肝转移患者,应以全身化疗为主[12]。由于肝内药物浓度低,化疗有效缓解期较短。肝动脉化疗栓塞通过超选择栓塞肿瘤供应血管,可明显提高局部控制率,但栓塞后会使侧支循环及新生毛细血管形成,导致血液药物浓度减小,也会影响治疗效果。有研究[11]进一步表明全身化疗联合局部介入治疗的有效率为65%,中位PFS为7.9个月,疗效优于单独手术及化疗。还有研究[13]推断对于直径较大的肝转移病灶,可先用消融术减小肿瘤负荷,而后用动脉化疗栓塞术进一步提高疗效。在肝转移灶数目不超过5个且肿瘤直径小于6 cm的情况下,放疗可用于肺癌肝转移患者。本研究中,放疗并不能改善患者的OS和CCS, 这可能与放疗后肝脏常出现新的转移有关。指南[14]提示,放疗仍可作为转移性NSCLC患者缓解疼痛、减轻并发症、提高生活质量的姑息性治疗,并在寡灶性疾病、中枢神经系统转移和联合治疗中发挥积极的作用。
目前靶向和免疫治疗已成为肺癌转移治疗的重要方向,晚期NSCLC患者的5年生存率已提高至22%[15]。肺癌的分型也由病理组织学分类进一步细分为基于基因的分子亚型,约73.9%的NSCLC患者可检测出相关驱动基因突变[16],这部分患者可从特定的靶向药物中获益。研究[17]提出,对于野生型NSCLC伴肝转移者,化疗联合贝伐珠单抗仍能提供更好的整体生存效益。此外,对于驱动基因野生型的晚期NSCLC患者,免疫治疗是目前一线治疗的基石[18]。需要注意的是,免疫治疗对肝转移的疗效不佳[19], 这可能与肝脏中免疫细胞多处于免疫耐受状态,分化的细胞亚群多发挥促肿瘤生长作用,从而形成免疫抑制性的肿瘤微环境密切相关[20]。免疫染色结果[9]也显示,肝转移患者的PD-L1表达和CD8+肿瘤浸润淋巴细胞密度的比率均低于无肝转移的患者(0%与30.8%,P=0.088)。研究[20]发现,阿特珠单抗联合贝伐珠单抗治疗可显著提高NSCLC肝转移人群的生存获益,有望成为新的标准的一线治疗方案。Mata分析[21]提示,在晚期野生型NSCLC患者的一线治疗中,免疫联合化疗的长期生存率显著优于标准化疗。此外,免疫联合放疗可以更大程度地减少T细胞的凋亡,缓解免疫抑制,提高疗效[22]。
本研究存在的局限性: ① SEER数据库未收录靶向和免疫治疗的具体信息,因此无法纳入该预后分析。② SEER数据库缺乏详尽的治疗方案、部分肿瘤标志物等关键指标,可能会影响预测模型的准确性和全面性。③ 回顾性研究可能会导致固有偏倚,只纳入病例数据完整的患者可能会导致选择偏倚。④ 本研究中缺少独立的外部验证,可能会影响预测模型的实用普遍性。
综上所述,本研究基于化疗、原发部位手术、病理分级、骨转移、脑转移、年龄、组织学类型、肿瘤直径和性别共9个指标建立的NSCLC肝转移患者生存率列线图的区分能力良好,可准确评估患者的OS和CSS,并对优化个体化治疗提供参考。

