虱螨脲对棉铃虫叶酸一碳库代谢途径的影响
杨林 刘彩月 韩小强 陈明慧 陈阅新 张艳聪 周科瑾


摘要 为了探究虱螨脲对棉铃虫的作用机理,用虱螨脲(200 mg/L)处理棉铃虫3龄幼虫,通过转录组测序、叶酸含量测定、叶酸饲喂试验和分子对接技术分析了虱螨脲对棉铃虫叶酸一碳库代谢途径的影响。结果表明,棉铃虫幼虫差异基因数量随虱螨脲处理后时间的延长而增多,主要富集在叶酸一碳库、氧化还原活性、几丁质结合、氨基酸合成、嘌呤合成与代谢以及离子跨膜运输等途径上,其中叶酸一碳库代谢通路在处理后0.5 h极显著富集(P=6.35×10-5)。棉铃虫幼虫的叶酸含量随着虱螨脲处理后时间的延长而显著降低,处理后24 h叶酸含量为4.53 μg/100 g,约为对照组的1/2;用含叶酸的饲料饲喂虱螨脲处理的棉铃虫幼虫,能够明显降低其中毒症状。分子对接结果表明,胞质10-甲酰基四氢叶酸脱氢酶(cytosolic 10-formyltetrahydrofolate dehydrogenase)与虱螨脲共形成12个氢键和6个卤键,具有最低的结合能(-10.4 kcal/mol),推测其是虱螨脲的潜在作用靶标之一。研究结果进一步丰富了虱螨脲的作用机理,为以叶酸途径为靶标的杀虫剂开发提供了理论指导。
关键词 虱螨脲; 棉铃虫; 叶酸一碳库; 转录组; 分子对接
中图分类号: S 482.37; Q 965.9; TP 391
文献标识码: A
DOI: 10.16688/j.zwbh.2021626
Abstract In order to explore the action mechanism of lufenuron on Helicoverpa armigera, the 3rd instar larvae of H.armigera were treated with lufenuron (200 mg/L). The effects of lufenuron on folate and one-carbon metabolism of H.armigera were analyzed by transcriptome sequencing, folate content determination, folate feeding test and molecular docking technology. The number of differentially expressed genes (DEGs) increased with the extension of time after treatment, and their functions were mainly enriched in one-carbon pool by folate, oxidation-reduction process, chitin binding, amino acid synthesis, purine synthesis and metabolism, and ion transport across membranes. Among them, the one-carbon pool by folate pathway (P=6.35×10-5) was extremely significantly enriched in 0.5 h after treatment. The folate content in H.armigera larvae decreased significantly after treated with lufenuron, and the folate content of H.armigera treated with lufenuron was 4.53 μg/100 g after 24 h, about 1/2 of the control. The poisoning symptoms of H.armigera treated with lufenuron were obviously reduced by feeding H.armigera with folate. Molecular docking results showed that cytosolic 10-formyltetrahydrofolate dehydrogenase formed 12 hydrogen bonds and 6 halogen bonds with lufenuron. They had the lowest binding energy (-10.4 kcal/mol), indicating that they were the potential targets of lufenuron. Our study helps to understand the action mechanism of lufenuron, and provides a theoretical guidance for the development of insecticides targeting folate pathway.
Key words lufenuron; Helicoverpa armigera; one-carbon pool by folate; transcriptome; molecular docking
虱螨脲(lufenuron)是一種选择性好,对环境和非靶标生物安全的苯甲酰脲类昆虫生长调节剂,具有触杀和胃毒作用。对鳞翅目[1]、双翅目[2]、鞘翅目[3]以及虱目[4]等害虫有出色的防效,适于防治对拟除虫菊酯和有机磷农药产生抗性的害虫,广泛用于棉花、玉米、甜菜、马铃薯、葡萄、柑橘等作物。一般认为,虱螨脲干扰鳞翅目昆虫的正常生长发育,但其具体的作用机理却一直没有定论。
关于虱螨脲作用机理的研究较多。如Dean等发现虱螨脲引起猫栉头蚤Ctenocephalides felis表皮细胞中细胞质减少,线粒体、核糖体、高尔基体等细胞器溶解,中肠细胞的分化被抑制[5]。Douris等认为虱螨脲直接作用于黑腹果蝇Drosophila melanogaster的几丁质合成酶[6]。此外,虱螨脲能够抑制卵几丁质的合成,进而影响卵的呼吸代谢及胚胎发育过程中DNA和蛋白质代谢,致使卵内胚胎缺乏几丁质而不能孵化或孵化后随即死亡[7-10]。以上研究表明,虱螨脲的作用机理比较复杂。
棉铃虫Helicoverpa armigera (Hübner)是为害棉、粮、油、蔬菜等多种作物的重要害虫,在全世界范围内造成了重大的经济损失[11]。为了进一步研究虱螨脲的作用机理,本研究通过转录组测序分析虱螨脲对棉铃虫3龄幼虫代谢途径的影响,在此基础上利用鼠李糖杆菌法测定虱螨脲处理后不同时间棉铃虫体内叶酸含量的变化,并使用叶酸饲喂虱螨脲处理后的棉铃虫,观察棉铃虫症状表现。进一步结合分子对接技术探究虱螨脲与棉铃虫叶酸一碳库代谢途径相关酶的作用关系,旨在深入地了解虱螨脲杀虫作用机理,为棉铃虫的可持续防控提供指导。
1 材料与方法
1.1 供试材料
供试昆虫:棉铃虫H.armigera幼虫,购于河南省济源白云实业有限公司。
供试试剂:97%虱螨脲原药,武汉远成共创科技有限公司;N,N-二甲基甲酰胺和Triton X-100,天津市光复科技发展有限公司;胰蛋白酶-EDTA消化液、98%叶酸,索莱宝科技有限公司。
供试仪器:昆虫生长培养箱(Adaptis A1000IN),加拿大康威龍公司;实时荧光PCR仪(ABI 7500)、酶标仪(Multiskan FC),Thermo Fisher Scientific公司。
1.2 试验方法
1.2.1 转录组样本制备
将虱螨脲原药溶于适量的N,N-二甲基甲酰胺中,配制成10 g/L的母液,用0.01% Triton X-100溶液稀释成200 mg/L的供试药液。以0.01% Triton X-100溶液为溶剂对照。采用浸虫法处理棉铃虫[12]。将棉铃虫3龄幼虫分别在200 mg/L虱螨脲药液和0.01% Triton X-100中浸渍5 s,取出后用滤纸吸干多余药液,转入昆虫生长培养箱,在温度(26±1)℃,相对湿度(70±10)%,光周期L∥D=14 h∥10 h条件下单头饲养并接入人工饲料。浸虫时棉铃虫幼虫口器保持在液面以上,减少胃毒作用干扰。分别取处理后0、0.5、1、3、6、12 h和24 h的棉铃虫幼虫,在冰上放置2 min,用大头针固定虫体于蜡盘上,用镊子、剪刀取下表皮组织,用预冷的0.9% NaCl溶液清洗干净,-78°C保存后送至北京诺禾致源科技股份有限公司进行转录组测序。每个处理重复3次,每重复30头试虫。
1.2.2 转录组数据分析
测序获得的所有clean reads与棉铃虫参考基因组 (Harm_1.0)[13]比对,使用featureCounts计算映射到每个基因的reads数。根据基因的长度计算每个基因的FPKM (fragments per kilobase of transcript per million mapped fragments)。使用DESeq2 1.20.0进行虱螨脲各处理组与CK组两两组合之间基因的差异表达分析,通过clusterProfiler 3.4.4软件实现差异表达基因的GO富集分析和KEGG通路分析。
1.2.3 差异基因的筛选和RT-qPCR验证
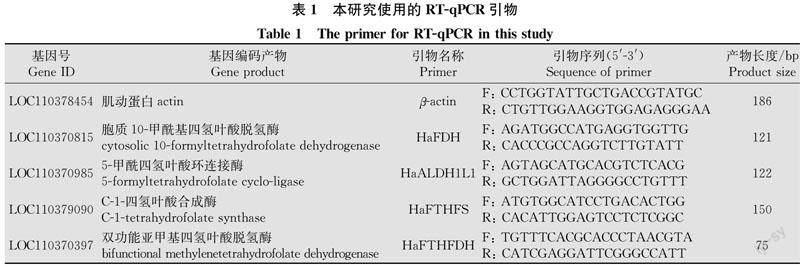
由转录组分析得到差异表达基因后,将|log2(Foldchange)|>0 且Padj≤0.05 作为差异表达基因的筛选标准[14]。选取差异表达基因中与叶酸一碳库代谢途径相关的4个基因进行转录组数据的验证,从NCBI网站下载目的基因序列,使用Primer-BLAST模块设计基因引物(表1)。将棉铃虫RNA反转录为cDNA。qPCR按照ChamQ Universal SYBR qPCR Master Mix荧光定量试剂盒(南京诺唯赞生物科技股份有限公司)步骤进行。荧光定量PCR反应体系(10 μL):10 mmol/L上、下游引物各0.5 μL,2×ChamQ Universal SYBR qPCR Master Mix 5 μL,RNase-Free ddH2O 3 μL、cDNA模板 1 μL。反应程序为:95℃预变性10 min;95℃变性15 s,60℃延伸1 min,循环40次。以棉铃虫的β-actin为内参基因。每个样本设置3次重复。2-ΔΔCt法计算基因的相对表达量。
1.2.4 棉铃虫叶酸含量测定
按照1.2.1的方法处理试虫,分别取处理后0.5、1、3、6 h和24 h的棉铃虫整虫液氮研磨制备样品。分别取1 g制备的棉铃虫样品和 20 mg 猪胰酶(猪胰酶P1750,Sigma-Aldrich公司)加入50 mL离心管中,加入30 mL磷酸盐缓冲液,摇匀后37℃黑暗条件下孵育4 h;95℃水浴30 min,12 500 r/min离心5 min,吸取上清液过0.2 μm 无菌滤膜后备用。叶酸含量测定和叶酸标准曲线的制备方法按照试剂盒(叶酸试剂盒P1001,德国VitaFast公司)说明书进行,叶酸含量计算公式:叶酸(μg/100 g)=吸光值对应标准曲线的浓度×稀释倍数/样品重量。
1.2.5 叶酸饲喂试验
选取发育状态良好的棉铃虫3龄幼虫,饥饿处理24 h后,按照1.2.1的方法处理试虫。处理后分别饲喂叶酸含量为0和0.1%(质量百分比)的饲料0.3 g/头,每浓度重复3次,每重复12头试虫。待试虫取食完含叶酸饲料后继续饲喂正常饲料,药后第7天记录试虫症状。
1.2.6 分子对接
通过转录组测序结果,结合叶酸含量测定和饲喂试验,挑选了4个在虱螨脲处理后下调或连续下调表达的基因(表2),从NCBI(https:∥www.ncbi.nlm.nih.gov/)下载目的基因编码的氨基酸序列,导入在线服务器Swiss-model (https:∥swissmodel.expasy.org/)进行同源建模,再将同源建模结果上传到SAVES 6.0 (https:∥saves.mbi.ucla.edu) 在线服务器,使用Verify3D和拉氏图(PROCHECK)模块对蛋白模型进行结构评价。使用AutoDock Vina软件进行分子对接,蛋白质模型和虱螨脲加氢、去水、加电荷等操作,对接参数exhaustiveness=24进行精细对接。用Discovery Studio 2021 client进行虱螨脲与蛋白质相互作用分析,使用PyMOL 2.3软件绘制虱螨脲和蛋白的结合图[15]。
2 结果与分析
2.1 转录组结果分析
2.1.1 差异表达基因分析和GO富集分析
相比于对照,虱螨脲处理棉铃虫幼虫后0 h共有1 151个基因差异表达,其中上调表达基因400个,下调表达基因751个;处理后0.5 h共有1 053个基因差异表达,其中上调表达基因364个,下调表达基因689个;处理后1 h共有1 573个基因差异表达,其中上调表达基因691个,下调表达基因882个;处理后 3 h共有1 486个基因差异表达,其中上调表达基因677个,下调表达基因809个;处理后6 h共有939个基因差异表达,其中上调表达基因385个,下调表达基因554个;处理后12 h共有1 685个基因差异表达,其中上调表达基因843个,下调表达基因842个;处理后24 h共有2 174个基因差异表达,其中上调表达基因1 167個,下调表达基因1 007个。
GO分析筛选出69个有显著差异的分类条目(Padj<0.05),主要归属于生物过程、细胞组分和分子功能。在生物过程上,氧化还原过程、碳水化合物衍生物代谢、几丁质代谢和药物代谢条目富集基因较多,分别有314、109、74个和72个基因。
药物代谢过程涉及外来化学物质如药物在虫体内的化学反应和途径,氧化还原过程涉及一个或多个电子与质子的转移。几丁质属于高分子多糖类物质,是昆虫表皮结构的重要组成成分,几丁质代谢过程涉及氧化还原过程和碳水化合物衍生物代谢。生物过程的富集结果表明虱螨脲处理后,棉铃虫几丁质代谢出现异常,虱螨脲可能干扰了氧化还原过程。
在细胞组分上,细胞外区域条目被富集多次,表明细胞外区域的正常生化反应受到影响。在分子功能上,结构分子活性、表皮结构成分和辅酶结合条目富集到基因较多,表明试虫表皮结构物质的代谢受到影响。
2.1.2 差异表达基因的KEGG富集
KEGG分析发现叶酸一碳库途径在每个处理组中都有显著富集,其中0.5 h时极显著富集(P=6.35×10-5)。有1 053个差异基因被富集到93个代谢通路,共获得12条显著性代谢通路(表3),包括叶酸一碳库、DNA复制、错配修复、嘌呤代谢、酪氨酸代谢、苯丙氨酸代谢、氨基酸生物合成、N-多糖生物合成、乙醛酸二羧酸代谢、寿命调节通路以及昆虫激素生物合成,其中叶酸一碳库代谢通路最显著。叶酸一碳库主要与叶酸及其衍生物的一碳单位代谢过程相关,在DNA复制、核酸甲基化修饰和一碳单元转运等方面发挥重要作用[16]。将富集到的叶酸一碳库的差异基因进行组间比较时发现,在所有处理组中参与叶酸一碳库途径的差异表达基因共有10个,这些基因在虱螨脲处理后呈现不同的表达模式(图1)。三功能嘌呤生物合成蛋白腺苷-3 (trifunctional purine biosynthetic protein adenosine-3)、双功能嘌呤生物合成蛋白水解酶(bifunctional purine biosynthesis protein PURH)和胞质丝氨酸羟甲基转移酶(cytosolic serine hydroxy methyltransferase)基因都连续上调表达,氨甲基转移酶(aminomethyltransferase)、二氢叶酸还原酶(dihydrofolate reductase)、胸苷酸合酶(thymidylate synthase)和C-1-四氢叶酸合酶(C-1-tetrahydrofolate synthase)基因都先上调表达,然后下调表达,最后又上调表达;5-甲酰四氢叶酸环连接酶(5-formyltetrahydrofolate cyclo-ligase)基因的表达先下调,然后上调,最后又下调表达;双功能亚甲基四氢叶酸脱氢酶 (bifunctional methylene tetrahydrofolate dehydrogenase)和胞质10-甲酰基四氢叶酸脱氢酶(cytosolic 10-formyltetrahydrofolate dehydrogenase)基因表达呈现持续的下调表达模式。
2.2 差异基因的RT-qPCR验证
KEGG通路分析表明,叶酸一碳库代谢途径相关基因在虱螨脲处理的棉铃虫转录本中显著的差异表达(图2)。cytosolic 10-formyltetra-hydrofolate dehydrogenase基因(FDH)是叶酸代谢酶基因,主要功能是调节叶酸量和叶酸结合甲基量以及参与嘌呤从头合成等[17]。5-formyltetrahydrofolate cyclo-ligase基因(ALDH1L1)是唯一的将5-甲酰四氢叶酸催化成5,10-甲酰四氢叶酸的酶基因[18]。bifunctional methylenetetrahydrofolate dehydrogenase基因(FTHFDH)是一类依赖于NADP,主要催化四氢叶酸衍生物之间相互转化的基因[19]。C-1-tetrahydrofolate synthase基因(FTHFS)是叶酸一碳库途径中的中心酶基因,将5,10-甲酰四氢叶酸催化成5,10-次甲基四氢叶酸[20]。虱螨脲处理后,棉铃虫3龄幼虫的这4个酶的基因大致呈现先上调表达后下调表达的趋势,其中HaFDH(图2a)的FPKM值变化趋势和RT-qPCR一致,在处理后24 h基因表达量显著下降;HaALDH1L1 (图2b)也具有类似的规律。HaFTHFS (图2c)基因FPKM值和RT-qPCR试验所测值在处理后6 h和12 h处表现不一致,但整体趋势两者相似。 HaFTHFDH (图2d)在处理后0~12 h FPKM值变化趋势和RT-qPCR试验所测值相同,但在处理后24 h基因FPKM值增大而RT-qPCR试验所测值变化不大。
2.3 虱螨脲对棉铃虫叶酸含量的影响
为了进一步验证虱螨脲对棉铃虫叶酸代谢的影响,采用鼠李糖杆菌法测定了虱螨脲处理后棉铃虫幼虫体内的叶酸含量(叶酸的标准曲线方程为y=0.547 2x-0.000 2,R2=0.998 7)。虱螨脲处理棉铃虫后,虫体内的叶酸含量随着处理后时间的延长而下降,处理后6 h和24 h叶酸含量分别为4.27 μg/100 g和4.53 μg/100 g,约是CK组叶酸含量的一半;除处理后0.5 h的叶酸含量高于CK外,其余时间点都显著低于CK(图3)。
虱螨脲处理后棉铃虫表现出典型的“双头囊”症状,部分虫体出现蜕皮困难,新表皮和旧表皮同时存在,表皮颜色变黑,毛片突出(图4a)。虱螨脲處理过的棉铃虫再饲喂含叶酸饲料后,未出现双头囊症状,中毒症状明显减轻,表明叶酸对虱螨脲处理的棉铃虫具有治疗效果(图4b)。
2.4 分子对接
以上研究结果表明,虱螨脲可干扰棉铃虫叶酸一碳库途径基因的表达,并显著影响棉铃虫体内的叶酸含量,为了进一步探究虱螨脲影响棉铃虫叶酸一碳库代谢途径的作用机理,使用分子对接技术探究虱螨脲处理后叶酸一碳库途径的4个基因所编码蛋白与虱螨脲的关系。结果表明,虱螨脲对5-formyltetrahydrofolate cyclo-ligase、cytosolic 10-formyltetrahydrofolate dehydrogenase、C-1-tetrahydrofolate synthase、bifunctional methylenetetrahydrofolate dehydrogenase蛋白的结合能都低于-8 kcal/mol,其中对cytosolic 10-formyltetrahydrofolate dehydrogenase结合能最低,为-10.4 kcal/mol。结合能越小表示虱螨脲与蛋白质结合程度越强,故推测cytosolic 10-formyltetrahydrofolate dehydrogenase和虱螨脲的结合程度强,可能是虱螨脲的潜在作用靶标之一。
结合虱螨脲与蛋白模型组成复合体时的相互作用关系分析,cytosolic 10-formyltetrahydrofolate dehydrogenase和虱螨脲之间的氢键和卤键数最多,共形成12个氢键和6个卤键(图5a)。而bifunctional methylenetetrahydrofolate dehydrogenase与虱螨脲只形成6个氢键,不存在卤键(图5b)。5-formyltetrahydrofolate cyclo-ligase和虱螨脲之间存在6个氢键和6个卤键(图5c)。C-1-tetrahydro-folate synthase与虱螨脲形成3个氢键和4个卤键(图5d)。由于虱螨脲特殊结构以及氮原子和氯原子所处的特殊位置关系赋予虱螨脲影响棉铃虫叶酸一碳库途径中基因表达和叶酸含量的生物活性。
3 结论与讨论
虱螨脲处理后,棉铃虫幼虫的差异基因GO富集主要集中在结合蛋白活性、催化活性和代谢过程,这与虱螨脲作用于甜菜夜蛾Spodoptera exigua Hübner的结果类似[21]。虱螨脲处理猫栉首蚤后,其表皮细胞发生降解,细胞器数量显著少于对照组[5],表明虱螨脲对DNA复制过程也产生了抑制作用,阻止表皮细胞正常增殖。转录组分析表明,虱螨脲处理棉铃虫后几丁质代谢、表皮细胞组分相关基因显著富集,药物代谢途径、嘌呤合成途径、嘌呤核苷酸代谢过程、蛋白质合成以及氧化还原途径也有明显的富集。以上结果表明虱螨脲通过多种途径影响棉铃虫的生长发育。
叶酸一碳库代谢为昆虫的生命活动提供一碳单位,发挥一碳供体和受体的作用[22],参与嘌呤和胸腺嘧啶的合成以及DNA、RNA和蛋白质的甲基化过程[23]。本研究表明,虱螨脲显著影响棉铃虫叶酸一碳库代谢途径相关基因的表达,虱螨脲处理后棉铃虫幼虫的叶酸含量显著下降,饲喂含有叶酸的饲料可明显缓解棉铃虫的中毒症状。进一步的分子对接结果表明,虱螨脲与5-formyltetrahydrofolate cyclo-ligase、cytosolic 10-formyltetrahydrofolate dehydrogenase、C-1-tetrahydrofolate synthase和bifunctional methylenetetrahydrofolate dehydrogenase等4种酶都有较好的结合作用。研究表明,通过干扰鳞翅目害虫的叶酸一碳库代谢途径可达到杀虫的目的,如叶酸拮抗剂2,4-二氨基嘧啶类化合物对多种鳞翅目害虫都有较好的防治效果,对美洲棉铃虫H.zea (Boddie) LC50为0.5 mg/ L,对烟芽夜蛾Heliothis virescens的LC50为0.2 mg/ L[24]。氨甲蝶呤可通过抑制二氢叶酸还原酶(DHFR)的活性影响果蝇的生殖和后代的生长发育过程,并造成果蝇的生长发育异常以及畸形等症状[25]。
综上所述,本研究通过转录组测序首次分析出叶酸一碳库代谢途径为虱螨脲作用于棉铃虫的潜在途径之一,叶酸含量测定和饲喂叶酸试验进一步证实了该机理,并通过同源模建和分子对接技术预测了虱螨脲与叶酸一碳库代谢途径相关蛋白的结合模式,研究结果可为研究虱螨脲的作用机理提供线索,为以叶酸途径为靶标的杀虫剂开发提供理论指导。
参考文献
[1] CORREIA A A, WANDERLEY-TEIXEIRA V, TEIXEIRA A A C, et al. Microscopic analysis of Spodoptera frugiperda (Lepidoptera: Noctuidae) embryonic development before and after treatment with azadirachtin, lufenuron, and deltamethrin [J]. Journal of Economic Entomology, 2013, 106(2): 747-755.
[2] SAMPSON B J, MARSHALL D A, SMITH B J, et al. Erythritol and lufenuron detrimentally alter age structure of wild Drosophila suzukii (Diptera: Drosophilidae) populations in blueberry and blackberry [J]. Journal of Economic Entomology, 2017, 110(2): 530-534.
[3] COSTA H N, CUNHA F M D, CRUZ G S, et al. Lufenuron impact upon Anthonomus grandis Boheman (Coleoptera: Curculionidae) midgut and its reflection in gametogenesis [J]. Pesticide Biochemistry and Physiology, 2017, 137: 71-80.
[4] DAVIS R M, CLEUGH E, SMITH R T, et al. Use of a chitin synthesis inhibitor to control fleas on wild rodents important in the maintenance of plague, Yersinia pestis, in California [J]. Journal of Vector Ecology, 2008, 33(2): 278-284.
[5] DEAN S R, MEOLA R W, MEOLA S M, et al. Mode of action of lufenuron in adult Ctenocephalides felis (Siphonaptera: Pulicidae) [J]. Journal of Medical Entomology, 1999, 36(4): 486-492.
[6] DOURIS V, STEINBACH D, PANTELERI R, et al. Resistance mutation conserved between insects and mites unravels the benzoylurea insecticide mode of action on chitin biosynthesis [J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(51): 14692-14697.
[7] MANSUR J F, FIGUEIRA-MANSUR J, SANTOS A S, et al. The effect of lufenuron, a chitin synthesis inhibitor, on oogenesis of Rhodnius prolixus [J]. Pesticide Biochemistry and Physiology, 2010, 98(1): 59-67.
[8] 賈变桃,卢晶晶,袁嘉伟,等. 虱螨脲对小菜蛾成虫繁殖力及子代种群发展的影响[J]. 植物保护学报, 2019, 46(3): 582-588.
[9] MATSUMURA F. Studies on the action mechanism of benzoylurea insecticides to inhibit the process of chitin synthesis in insects: A review on the status of research activities in the past, the present and the future prospects [J]. Pesticide Biochemistry and Physiology, 2010, 97(2): 133-139.
[10]GANGISHETTI U, BREITENBACH S, ZANDER M, et al. Effects of benzoylphenylurea on chitin synthesis and orientation in the cuticle of the Drosophila larva [J]. European Journal of Cell Biology, 2009, 88(3): 167-180.
[11]LU Yanhui, WU Kongming, JIANG Yuying, et al. Widespread adoption of Bt cotton and insecticide decrease promotes biocontrol services [J]. Nature, 2012, 487(7407): 362-365.
[12]MEYER F, FLOTENMEYER M, MOUSSIAN B. The sulfonylurea receptor sur is dispensable for chitin synthesis in Drosophila melanogaster embryos [J]. Pest Management Science, 2013, 69(10): 1136-1140.
[13]PEARCE S L, CLARKE D F, EAST P D, et al. Genomic innovations, transcriptional plasticity and gene loss underlying the evolution and divergence of two highly polyphagous and invasive Helicoverpa pest species [J/OL]. BMC Biology, 2017, 15(1): 63.DOI:10.1186/s12915-017-0402-6.
[14]YOUNG M D, WAKEFIELD M J, SMYTH G K, et al. Gene ontology analysis for RNA-seq: accounting for selection bias [J/OL]. Genome Biology, 2010, 11(2): R14. DOI:10.1186/gb-2010-11-2-r14.
[15]TROTT O, OLSON A J. Autodock vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading [J]. Journal of Computational Chemistry, 2009, 31(2): 455-461.
[16]DUCKER G S, RABINOWITZ J D. One-carbon metabolism in health and disease [J]. Cell Metabolism, 2017, 25(1): 27-42.
[17]KRUPENKO N I, SHARMA J, PEDIADITAKIS P, et al. Cytosolic 10-formyltetrahydrofolate dehydrogenase regulates glycine metabolism in mouse liver [J/OL]. Scientific Reports, 2019, 9(1): 14937. DOI: 10.1038/s41598-019-51397-1.
[18]MEIER C, CARTER L G, WINTER G, et al. Structure of 5-formyltetrahydrofolate cyclo-ligase from Bacillus anthracis (BA4489) [J]. Acta Crystallographica Section F Structural Biology and Crystallization Communications, 2007, 63(3): 168-172.
[19]LEE W H, SUNG M W, KIM J H, et al. Crystal structure of bifunctional 5,10-methylenetetrahydrofolate dehydrogenase/cyclohydrolase from Thermoplasma acidophilum [J]. Biochemical and Biophysical Research Communications, 2011, 406(3): 459-463.
[20]CHEN Meijun, ZHAI Jingjie, LIU Yu, et al. Molecular cloning and characterization of C1 tetrahydrofolate (C1-THF) synthase in Bombyx mori, silkworm [J]. Gene, 2018, 663: 25-33.
[21]陳吉祥, 任相亮, 姜伟丽, 等. 甲氧虫酰肼与3种药剂对甜菜夜蛾的联合毒力及亚致死效应[J]. 中国棉花, 2019, 46(2): 4-8.
[22]FU T F, MARAS B, BARRA D, et al. A noncatalytic tetrahydrofolate tight binding site is on the small domain of 10-formyltetrahydrofolate dehydrogenase [J]. Archives of Biochemistry and Biophysics, 1999, 367(2): 161-166.
[23]KIM D W, HUANG T, SCHIRCH D, et al. Properties of tetrahydropteroylpentaglutamate bound to 10-formyltetrahydrofolate dehydrogenase [J]. Biochemistry, 1996, 35(49): 15772-15783.
[24]WIERENGA J M, CULLEN T G, DYBAS J A, et al. Insecticidal activity and mode of action of 2,4-diaminopyrimidines [J]. Pest Management Science, 2000, 3(56): 233-236.
[25]AFFLECK J G, WALKER V K. Transgenic rescue of methotrexate-induced teratogenicity in Drosophila melanogaster [J]. Toxicological Sciences, 2007, 99(2): 522-531.
(责任编辑:杨明丽)

