蛋白质精氨酸残基化学修饰酶PADs与PRMTs在人肝癌细胞系中的表达
邹 瑾,何向蕾,2,张 欣,2,陈日萍,张 宇,胡帅悦,应士波*
1.杭州医学院 公共卫生学院,浙江 杭州 310012;2.浙江省人民医院 杭州医学院附属人民医院,浙江 杭州 310011
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝癌类型[1-2]。最新数据显示,2020年中国发病例数达41万,死亡人数更是高达39万[3]。肝细胞癌早期诊断困难,缺乏靶向药物,经治疗的病例中位生存期也仅为1~1.5年[1]。蛋白质精氨酸脱亚氨酶(protein arginine deiminases,PADs)是一类催化蛋白质肽链中的精氨酸残基转化为瓜氨酸残基的水解酶,而这种蛋白质翻译后修饰被称为瓜氨酸化(citrullination)[4]。研究表明,PADs家族中PAD2和PAD4表现出细胞特异性的表达水平、活性和生物学效应,参与多种肿瘤的发生发展[5]。蛋白质精氨酸甲基转移酶(protein arginine methyltransferases,PRMTs)是一类催化蛋白质精氨酸残基发生甲基化修饰的同工酶[6]。PRMTs分为3种类型,其中PRMT1、PRMT5和PRMT7分别是各型PRMTs中具有代表性的酶,且与肿瘤发生发展也有密切联系[7-8]。因此,PADs和PRMTs的催化位点都为蛋白质精氨酸残基,两者可能存在竞争关系,它们的相互作用可能在细胞恶性转化与肿瘤发生发展进程中起着重要作用。
本研究通过细胞模型和病理组织探究PADs和PRMTs在肝癌细胞中的转录与表达水平,并分析PADs催化的蛋白瓜氨酸化水平是否可能与PRMTs有关,旨在为肝癌的诊断和临床治疗提供新的科学依据。
1 材料与方法
1.1 材料
1.1.1 细胞和组织:人正常肝细胞系LX-2(上海中乔新舟生物科技有限公司),人肝癌细胞系HepG2和Huh7(中科院上海细胞库);肝癌病理组织样本(浙江省人民医院),已通过医学伦理审查委员会审批并豁免知情同意(QT2022431)。
1.1.2 试剂与材料:引物(Thermo公司);反转录试剂盒、qPCR试剂盒(Takara公司);DMEM培养基、0.25%胰蛋白酶、血清(Gibco公司);PAD2、PAD4、PRMT1和PRMT5(Abcam公司);PRMT7抗体(Santa Cruz Biotechnology公司);抗肽基瓜氨酸抗体F95(Sigma公司);β-actin抗体(宝科生物);HRP羊抗兔、羊抗鼠IgG抗体(宝科生物)。
1.2 方法
1.2.1 细胞的培养:用含10%胎牛血清的DMEM培养基培养LX-2、HepG2和Huh7细胞,放入37 ℃含5%的CO2培养箱中。待对数期时收集细胞开始RT-qPCR和Western blot检测。
1.2.2 RT-qPCR检测PADs和PRMTs的mRNA水平:引物序列(表1)。收集LX-2、HepG2和Huh7细胞,Trizol法抽提总RNA,分光光度计检测RNA浓度(A260/280=1.8~2.0),反转录合成cDNA,步骤:37 ℃ 15 min,85 ℃ 5 s。SYBR Green法进行qPCR,扩增步骤:95 ℃预变性30 s,95 ℃ 3 s,60 ℃ 30 s,40个循环。以GAPDH作为内参,2-ΔΔCt法计算基因相对表达量。

表1 引物序列Table 1 Primer sequence
1.2.3 Western blot检测PADs、瓜氨酸化蛋白和PRMTs蛋白:收集LX-2、HepG2和Huh7细胞,RIPA裂解液冰上裂解细胞,4 ℃,12 000r/min离心15 min,收集上清,BCA定量法确定蛋白浓度。样品煮沸10 min后按每孔20 μg蛋白体系上样,80 V电泳20 min,100 V电泳1 h,200 mA湿法转膜2 h。加入一抗PAD2(1∶1 000)、PAD4(1∶2 000)、PRMT1(1∶1 000)、PRMT5(1∶10 000)、PRMT7(1∶500)、F95(1∶1 000)、β-actin(1∶3 000)4 ℃孵育过夜,二抗孵育1 h 30 min,快速封闭液封闭15 min,加入ECL显影液后置于显影仪显影,ImageJ软件分析蛋白表达水平。
1.2.4 免疫组化染色:取肝癌病理组织石蜡切片,使用二甲苯、乙醇脱蜡至水,放入盛满EDTA修复盒中抗原修复,加入H2O2酶室温孵育10 min,加入BSA封闭30 min,加入目的蛋白一抗4 ℃孵育过夜,PBS清洗。二抗室温孵育30 min,加入DAB显色液,纯水冲洗切片终止显色。苏木素复染细胞核2~3 min,乙醇脱水,中性树胶封片,显微镜下观察拍照。
1.2.5 生物信息学分析:从癌基因组图谱(the Cancer Genome Atlas,TCGA)数据库(https://portal.gdc.cancer.gov)收集424份肝细胞肝癌样本数据(肝癌样本374份,癌旁样本50份),分析PADs和PRMTs在肝癌组织与癌旁组织中mRNA的转录水平,再对PADs和PRMTs基因进行Spearman相关性分析。
1.3 统计学分析
2 结果
2.1 PADs和PRMTs在肝癌细胞中mRNA转录水平
与正常肝细胞LX-2相比,PAD2在高分化肝癌细胞Huh7中mRNA转录水平较高(P<0.001),PAD4在低分化肝癌细胞HepG2中mRNA转录水平较高(P<0.01)。与LX-2细胞相比,PRMT1、PRMT5和PRMT7在HepG2细胞中的mRNA转录水平较高(P<0.001),PRMT1在Huh7细胞中的mRNA转录水平较高(P<0.01)。而PRMT5和PRMT7在Huh7细胞中的mRNA转录水平与正常肝细胞无显著性差异(图1)。

LX-2, human normal liver cell line; HepG2 and Huh7, human hepatocellular carcinoma cell lines; *P<0.01, **P<0.001 compared with LX-2 cells group.图1 PADs和PRMTs在肝癌细胞中mRNA转录水平Fig 1 mRNA transcription levels of PADs and PRMTs in hepatocellular carcinoma cells
2.2 PADs和瓜氨酸化蛋白在肝癌细胞中表达水平
PAD2和PAD4在肝癌细胞HepG2和Huh7中的蛋白水平均显著高于LX-2(P<0.01)(图2A)。瓜氨酸化蛋白(citrullinated proteins)在HepG2和Huh7中的表达水平却低于正常肝细胞系LX-2(图2B),尤其是40和70 ku分子量蛋白的瓜氨酸化水平明显降低。
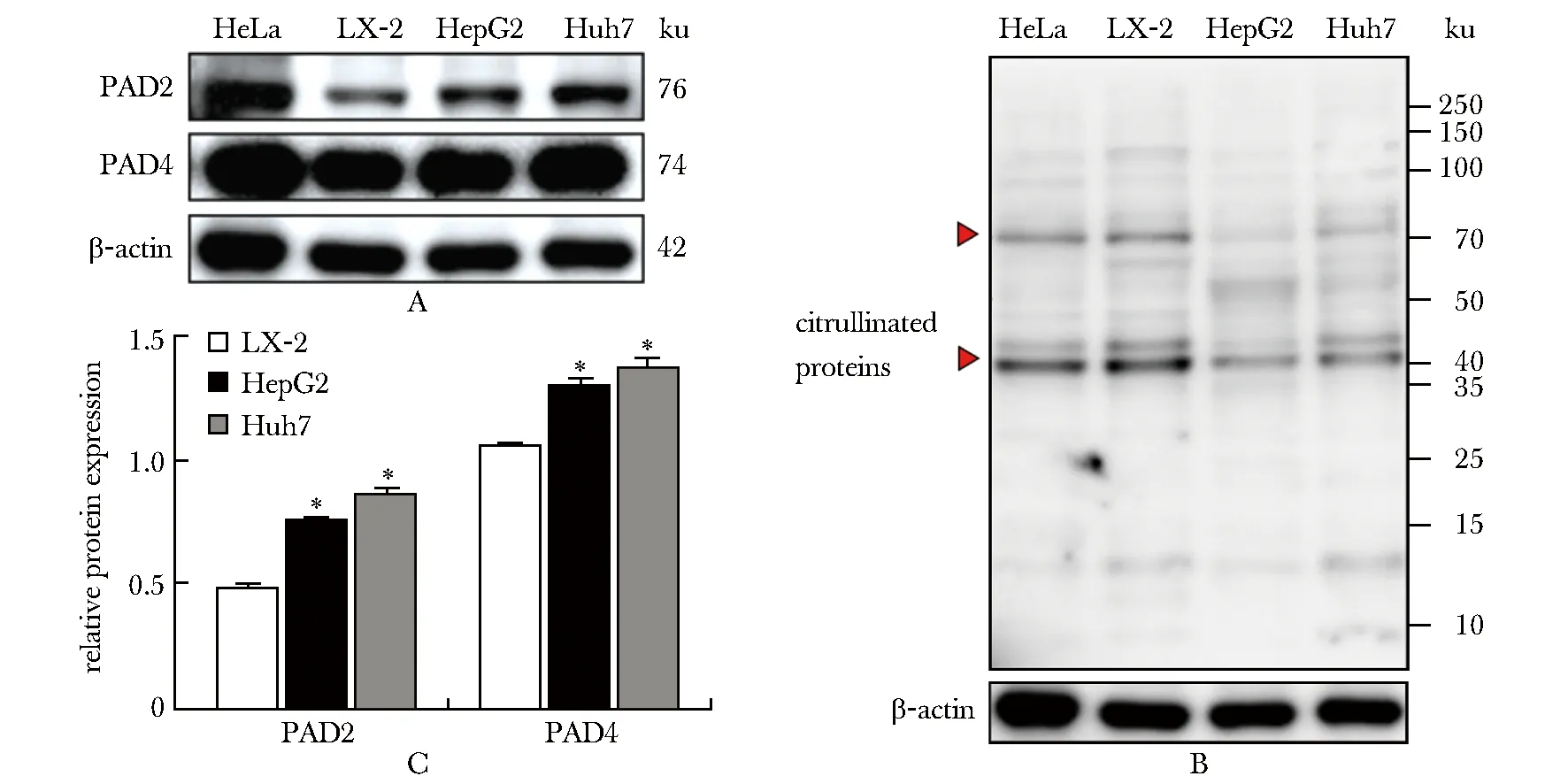
A.protein detection results of PAD2 and PAD4 in hepatocellular carcinoma cells; B.detection results of total citrullinated proteins in hepatocellular carcinoma cells;C.relative protein contents of PAD2 and PAD4 in hepatocellular carcinoma cells; human cervical cancer cell line HeLa was used as positive control; LX-2, human normal liver cell line; HepG2 and Huh7, human hepatocellular carcinoma cell line; *P<0.001 compared with LX-2 cells group.图2 PADs和瓜氨酸化蛋白在肝癌细胞的表达Fig 2 Expression of PADs and citrullinated proteins in hepatocellular carcinoma cells
2.3 PRMTs在肝癌细胞中蛋白表达水平
在肝癌细胞HepG2和Huh7中,PRMT1、PRMT5和PRMT7的蛋白表达均显著高于正常肝细胞LX-2(P<0.01)(图3)。

A.protein detection results of PRMT1, PRMT5 and PRMT7 in hepatocellular carcinoma cells; B.relative protein contents of PRMT1, PRMT5 and PRMT7 in hepatocellular carcinoma cells; human cervical cancer cell line HeLa was used as positive control; LX-2, human normal liver cell line; HepG2 and Huh7, human hepatocellular carcinoma cell lines; *P<0.001 compared with LX-2 cells group.图3 PRMTs蛋白在肝癌细胞中的表达Fig 3 Expression of PRMTs protein in hepatocellular carcinoma cells
2.4 PADs、瓜氨酸化蛋白和PRMTs在肝癌组织中的表达水平
无论是在高分化(图4)还是低分化(图5)肝癌组织,PADs同工酶(PAD2和PAD4)和PRMTs同工酶(PRMT1、PRMT5和PRMT7)均呈强阳性表达,而在相应癌旁组织中阳性程度较弱。瓜氨酸化蛋白在肝癌组织和相应癌旁组织中几乎都呈阴性。免疫组化结果进一步发现,PAD2主要在胞质中表达,PAD4主要定位在细胞核内(图4)。PRMT1和PRMT5在细胞核和胞质中均表达,PRMT7主要定位在胞质中。

图5 PADs和PRMTs在低分化肝癌组织中的表达Fig 5 Expression of PADs and PRMTs in poorly differentiated liver cancer
2.5 PADs和PRMTs相关性
PAD2和其他家族PAD1、PAD3、PAD4之间存在显著相关性(P<0.001),且为正相关;PAD2和PRMTs家族PRMT1、PRMT5和PRMT7之间存在显著相关性(P<0.05),且为正相关(图6A);PAD4和PAD1、PAD2之间存在显著相关性(P<0.001),且为正相关;PAD4和PRMT9之间存在显著相关性(P<0.001)且为正相关(图6B)。

A.Spearman correlation analysis of PAD2 and PADs or PRMTs genes; B.Spearman correlation analysis of PAD4 and PADs or PRMTs family genes; *P<0.05, **P<0.01, ***P<0.001.图6 肝细胞癌中PAD2/4与PADs和 PRMTs家族基因Spearman相关性分析Fig 6 Spearman correlation analysis of PAD2/4 and PADs and PRMTs family genes in hepatocellular carcinoma
3 讨论
近年来,PADs作为蛋白质翻译后修饰的重要酶,已被发现与肝癌的发生发展有关,探索早期诊断、治疗靶点及预后的生物标志物有利于对肝癌的防控[9]。研究发现PAD2主要在细胞质中表达,并且PAD2过表达与肝癌细胞增殖和转移有关,抑制PAD2表达可增加肝癌细胞系Bel-7402的增殖和迁移[10]。而PAD4主要在细胞核表达,它依赖自身的核定位序列从细胞质易位到细胞核,从而介导蛋白质瓜氨酸化[6]。PAD4在肝癌患者组织和血液中多为高表达[6],基因敲除PAD4小鼠模型通过抑制NETs的形成,减轻肝脏炎性反应并且延缓肝癌的生长[11]。
在本研究中,PADs和PRMTs的mRNA转录水平存在差异,可能与不同分化程度的肝癌细胞有关。PADs酶和瓜氨酸化蛋白水平不一致,提示PADs催化的蛋白质瓜氨酸化修饰可能受到其他翻译后修饰酶的竞争。PRMTs在肝癌细胞中有较高表达,可能与PADs同时竞争底物蛋白,或使精氨酸残基甲基化修饰占有优势。精氨酸残基在PRMTs作用下会发生单甲基化,PRMTs进一步催化发生双甲基化,或在PAD4的作用下发生瓜氨酸化,瓜氨酸化一旦发生便是不可逆的[12]。有研究发现,乳腺癌中PADs介导的体外去甲基化速率比精氨酸残基甲基化的速度慢1 000倍以上,使得PADs成为一种相对低效的去甲基化酶[12]。本研究进一步检测发现,虽然肝癌病理组织中PADs有较高的表达水平,但是瓜氨酸化水平却很低,这可能与高水平表达的PRMTs的竞争性抑制有关,与细胞模型的结果指向一致。生物信息学结果提示PAD2和PRMTs家族成员在临床大样本中呈显著正相关性,PAD2可能是与PRMTs竞争底物的主要PADs同工酶成员。
综上所述,肝细胞癌中PADs表达较癌旁组织有显著升高,而PADs催化的瓜氨酸化蛋白水平较低,未相应升高,可能是受细胞内高水平表达的PRMTs竞争性影响,这为进一步研究PADs在肝癌发生发展中的作用机制提供新的线索。

