早产儿支气管肺发育不良与25(OH)D的关系及治疗方式的探讨
雷瑞瑞,张新,张剑,张艺森
驻马店市中心医院新生儿科,驻马店 463000
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是早产儿常发生的并发症之一,易并发哮喘、呼吸道感染及神经系统发育障碍,可严重影响早产儿健康[1]。该病在出生体重≤1500g 的早产儿中具有较高的发病率,探究BPD 的发病机制及危险因素对于该病的预防及早期治疗至关重要[2-3]。相关研究发现[4-6],维生素D 缺乏可引起多种肺部疾病,可能的机制是维生素D 缺乏影响了肺表面活性物质的合成及肺泡化进程,进而影响了肺功能。研究显示[7],血清25 羟维生素D[25-hydroxy-vitamin D,25(OH)D]水平低下的早产儿较易出现呼吸窘迫综合征。也有研究提示维生素缺乏易引发哮喘[8]。如何合理防治BPD 是临床关注的热点问题,随着临床机械通气策略的改进及糖皮质激素的应用,早产儿存活率明显增加。但采用糖皮质激素治疗BPD 尚存在一定争议,其虽然能够有效改善肺功能,但也可能会引起神经系统发育不良,在用药时需要权衡利弊[9]。本研究分析了早产儿BPD 发生与25(OH)D 的关系,探讨雾化吸入布地奈德+机械通气治疗的效果以及并发症,以期为明确BPD 的发病机制及治疗方法提供参考依据。
1 资料与方法
1.1 一般资料
回顾性选取某院2020年1月~2021年12月早产儿病房收治的确诊为BPD 的早产儿86 例作为BPD 组,选取同期出生且支气管发育正常的早产儿90 例作为对照组。两组早产儿的分娩体重、胎龄、性别构成等一般资料比较无统计学差异(P>0.05),具有可比性(表1)。
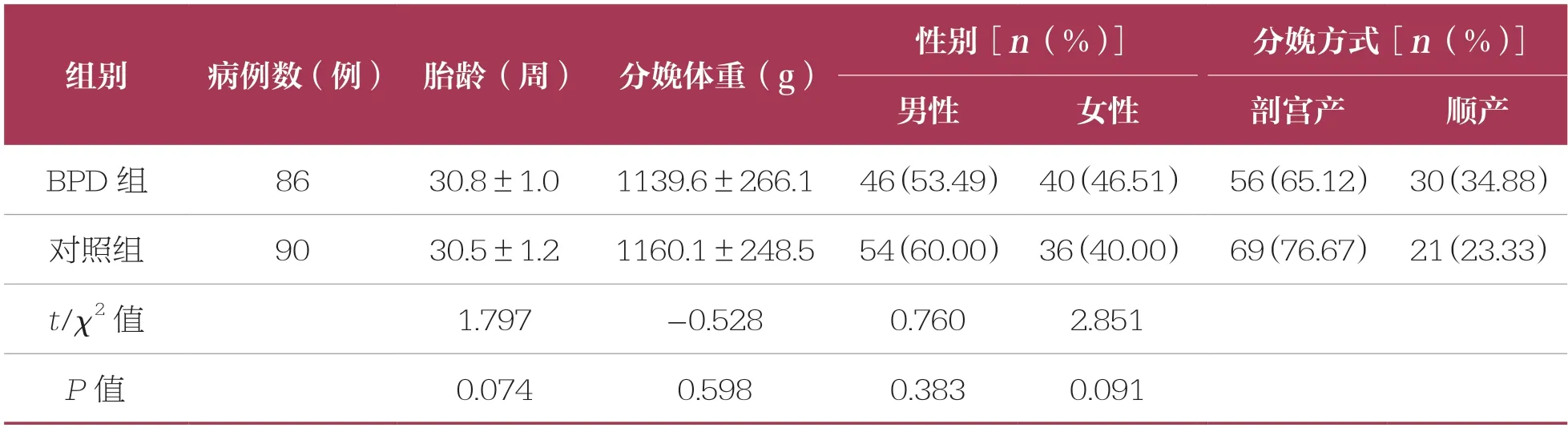
表1 两组一般资料比较
纳入标准:①分娩胎龄<32 周,出生体重≤1500g 者。②依据《实用新生儿学》[10]的诊断标准确诊为BPD 者。③对任何氧疗依赖度>21%者。④病情程度属于中重度者。⑤住院时间超过28 天者。⑥均为该院分娩的早产儿。
排除标准:①支气管、肺部畸形者。②染色体缺陷者。③先天性心脏病者。④具有基础的肝肾功能疾病、甲状腺功能疾病者。⑤伴有其他系统的重大疾病者。
1.2 治疗方法
根据早产儿治疗过程中是否使用布地奈德将BPD 组分为A 组和B 组。两组早产儿入院后给予机械通气,采取同步间歇指令通气模式,参数:吸气峰压(peak inspiratory pressure,PIP) 22~18cmH2O、呼吸频率(respiratory rate,RR) 40~60次/min、呼气末正压通气(positive end expiratory pressure,PEEP) 5~6cmH2O,吸氧浓度(fraction ofinspiration O2,FiO2) 30%~80%。
A 组在上述治疗的基础上取0.5mg 吸入用布地奈德混悬液(Astra Zeneca Pty Ltd,国药准字H20140475,规格2ml∶1ml)加入生理氯化钠溶液(石家庄四药有限公司,国药准字H20066533,规格500ml∶4.5g)2ml 置于雾化器内,在氧气驱动下进行雾化吸入治疗,每次10min,结束后去除残留药液。bid,共治疗10 天。B 组不使用其他类型糖皮质激素。两组早产儿可适当补充维生素D。
1.3 观察指标
(1)对比两组早产儿出生时(0 天)、出生后14天、出生后28 天血清25(OH)D 水平:留取早产儿静脉血2ml,LD4-2A 离心机(北京医用离心机厂)以2000r/min 离心10min(4℃)后留取血清待测,采用电化学发光免疫分析法测定25(OH)D 水平。试剂盒(英国IDS 艾狄斯公司)。血清25(OH)D<30nmol/L 即认为是维生素D 缺乏;在30~49.9nmol/L范围认为是维生素D 不足,>50nmol/L 即维生素D充足。
(2)BPD 早产儿的病情程度参考《实用新生儿学》[10]中的诊断标准:①轻度:胎龄<32 周,早产儿纠正胎龄36 周或出院时已经不需要吸氧。②中度:胎龄<32 周,早产儿纠正胎龄达到36 周时,因病情需要继续吸氧,FiO2<30%。③重度:胎龄<32 周,早产儿纠正胎龄达到36 周,因病情较为严重需要继续吸氧,FiO2≥30%和(或)持续气道正压通气(continuous positive airway pressure ventilation,CPAP)或机械通气。
(3)对比BPD 早产儿治疗前(0 天)、治疗14天、治疗28 天的PIP、平均气道压(mean airway pressure,MAP)、FiO2、动脉血二氧化碳分压(arterial blood carbon dioxide partial pressure,PaCO2)水平。
(4)记录并统计两组早产儿治疗期间发生早产儿视网膜病、败血症、颅内感染、早产儿坏死性小肠结肠炎、胆汁淤积、脑白质软化等不良反应发生情况。
1.4 统计学方法
采用SPSS21.0 软件进行数据统计学分析。计量资料以±s 表示,组间对比假设检验采用独立样本t检验;重复测量的数据组间比较采用重复测量方差分析法,任意时间点之间两两比较采用LSD-t检验;计数资料以n(%)表示,组间对比分析用χ2检验。P<0.05 为具有统计学差异。
2 结果
2.1 两组早产儿血清25(OH)D 水平比较
BPD 组早产儿在出生时、出生后14 天、出生后28 天血清25(OH)D 水平均低于对照组,具有统计学差异(P<0.05)(表2)。
表2 两组早产儿血清25(OH)D 水平比较 ±s,nmol/L

表2 两组早产儿血清25(OH)D 水平比较 ±s,nmol/L
组别病例数(例)出生时出生后14 天出生后28 天对照组9033.20±5.9462.41±8.7884.02±12.48 BPD 组8627.65±4.8155.28±9.5077.81±10.54 t 值-6.794 -5.174 -3.558 P 值 0.000 0.000 0.000
2.2 不同病情程度的B P D 早产儿血清2 5(O H)D 水平比较
86 例BPD 早产儿中有中度BPD 早产儿57 例、重度BPD 早产儿29 例。重度组早产儿在出生时、出生后14 天、出生后28 天的血清25(OH)D 水平低于中度组,具有统计学差异(P<0.05)(表3)。
表3 不同病情程度的BPD 早产儿血清25(OH)D 水平比较 ±s,nmol/L
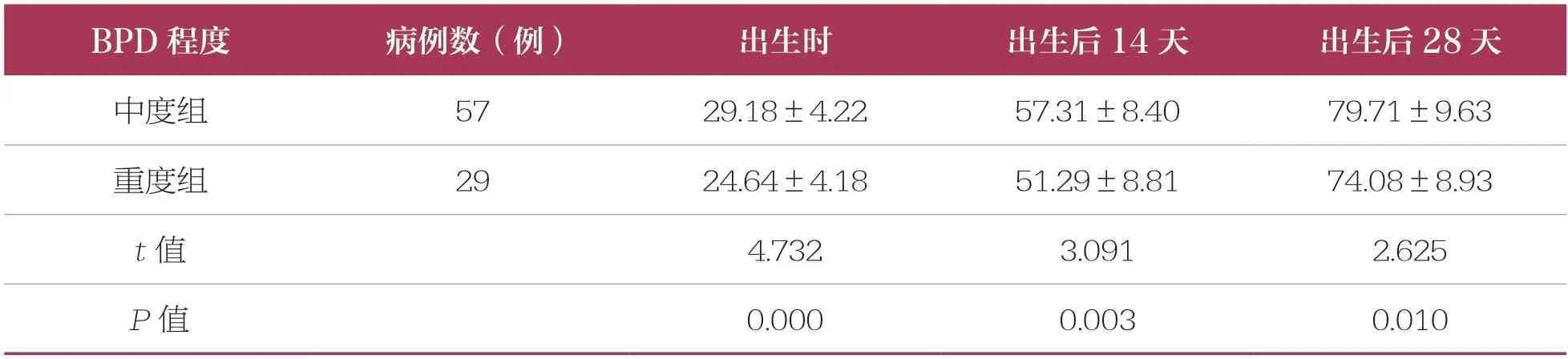
表3 不同病情程度的BPD 早产儿血清25(OH)D 水平比较 ±s,nmol/L
BPD 程度病例数(例)出生时出生后14 天出生后28 天中度组5729.18±4.2257.31±8.4079.71±9.63重度组2924.64±4.1851.29±8.8174.08±8.93 t 值4.7323.0912.625 P 值0.0000.0030.010
2.3 不同治疗方式的BPD 早产儿血气参数变化分析
A 和B 组早产儿在治疗前的PIP、MAP、FiO2、PaCO2测定值比较无统计学差异(P>0.05);治疗14 天、治疗28 天后两组早产儿PIP、MAP、FiO2、PaCO2测定值降低,且A 组低于B 组(P<0.05)(表4)。
表4 不同治疗方式的BPD 早产儿的血气参数变化分析 ±s

表4 不同治疗方式的BPD 早产儿的血气参数变化分析 ±s
PIP:吸气峰压;MAP:平均气道压;FiO2:吸氧浓度;PaCo2:动脉血二氧化碳分压。与本组治疗前比较,a:P<0.05
指标组别治疗前治疗14 天治疗28 天PIP(cmH 2O)A 组(n=42)18.32±1.7214.72±1.30a11.52±1.28a B 组(n=44)18.10±1.6715.89±1.54a13.28±1.51a t 值0.602 -3.798 -5.817 P 值0.549 0.000 0.000 MAP(cmH2O)A 组(n=42)10.86±0.859.61±0.90a7.57±0.78a B 组(n=44)11.10±0.9210.66±0.98a8.52±0.81a t 值-1.255 -5.168 -5.536 P 值0.213 0.000 0.000 FiO2(%)A 组(n=42)34.40±1.6027.57±1.29a26.04±1.72a B 组(n=44)33.68±2.1230.52±1.85a28.62±1.97a t 值1.771 -8.540 -6.457 P 值0.080 0.000 0.000 PaCO2(mmHg)A 组(n=42)49.12±3.6739.56±3.37a35.81±2.90a B 组(n=44)50.18±4.3445.10±4.72a42.75±4.14a t 值-1.220 -6.238 -8.964 P 值0.226 0.000 0.000
2.4 不同治疗方式BPD 早产儿并发症发生情况
A 组早产儿在治疗过程中有5 例早产儿出现并发症,B 组有14 例出现并发症,A 组早产儿的并发症率(11.90%)低于B 组(31.82%),具有统计学差异(P<0.05)(表5)。

表5 并发症发生情况对比 例
3 讨论
早产儿易并发BPD,BPD 早产儿常表现为肺结构受损、持续性低氧血症及氧气依赖等。近年来维生素D 与肺部结构受损的关系逐渐受到关注,有利于调节胎儿肺部发育,减轻肺损伤,其缺乏时会引发哮喘、慢性阻塞性肺疾病等[11]。考虑维生素D与BPD 早产儿发病之间存在某种联系。本研究旨在通过探究早产儿血清25(OH)D 与BPD 发生的关系,为临床防治提供参考。
卢田甜等[12]的研究显示,维生素D 通过调控反应元件对其受体进行调控,进而参与肺部发育。本研究中,BPD 组早产儿出生时、出生后14 天、出生后28 天的血清25(OH)D 水平低于对照组,且重度组低于中度组。提示25(OH)D 可作为预测BPD发生的重要指标,且对评估病情程度具有参考意义。分析25(OH)D 水平降低与增加BPD 发病风险的机制可能有:①无活性的维生素D 在人体中在肝、肾羟化酶的催化下生成具有活性的25(OH)D,后者在受体的作用下与维生素D 反应元件结合,起到调节维生素D 靶基因表达的作用[13]。②25(OH)D可参与肺表面蛋白质和活性磷脂合成过程,还参与肺泡上皮细胞、纤维原细胞的分化,早产儿尤其是体重较轻者的维生素D 较为缺乏[14]。不同病情程度早产儿血清25(OH)D 差异较大的原因可能是其在促进重度病变时发挥生物学作用消耗过多。基于此,本研究提出25(OH)D 缺乏会促进BPD 的发病,以期对早产儿BPD 发病机制探讨及疾病管理提供思路。
如何合理防治BPD 是早产儿领域关注的重点问题,而糖皮质激素在治疗BPD 的临床应用中一直存在较大争议,并且相关标准中肯定了糖皮质激素药物治疗早产儿BPD 的作用,但是对于激素种类、用药途径及并发症防治尚无明确推荐意见,有待进一步研究[15-18]。本研究探讨雾化吸入布地奈德+CPAP或机械通气治疗中重度BPD 早产儿的治疗效果以及不良反应、随访情况,旨在为BPD 治疗提供参考。
本研究结果显示,重度组在出生时、治疗14天、治疗28 天的PIP、MAP、FiO2、PaCO2测定值高于中度组,具有统计学差异(P<0.05);A 和B组早产儿在治疗后,PIP、MAP、FiO2、PaCO2测定值较治疗前降低,且A 组低于B 组。提示采取雾化吸入布地奈德+CPAP 或机械通气治疗有利于改善BPD 早产儿血气参数,促进BPD 早产儿恢复。布地奈德属于一种糖皮质激素,主要发挥免疫调节作用和抗炎作用,有利于减轻肺水肿,降低早产儿对机械通气的需求,可视为BPD 的防治用药[19-20]。布地奈德雾化吸入后作用于气道黏膜,在呼吸系统局部发挥较强的作用。治疗后血气参数明显改善,提示A 组方案使得早产儿肺通气功能得到显著改善,有利于排出CO2。
早产儿、BPD 早产儿本身就会引起一系列并发症,在接受治疗之前就已经存在复杂并发症的发生风险。本研究结果显示,治疗后A 组早产儿的并发症率低于B 组。提示布地奈德可以改善早产儿的肺功能,减少呼吸做功,且不会增加治疗后并发症,具有一定安全性。BPD 的发病原因有很多,本研究的创新点是对早产儿BPD 的25(OH)D 水平变化特点进行分析,并在此基础上探究合理的治疗方案。后续还需要进一步对采取维生素D 治疗能否改善BDD 病情等进行探讨。
综上所述,该院BPD 早产儿在出生时及出生后一段时间内的血清25(OH)D 水平均低于未发生BPD 的早产儿,且血清25(OH)D 不足与BPD病情严重程度有关;采取雾化吸入布地奈德+CPAP或机械通气治疗治疗中重度BPD 早产儿有助于尽早改善呼吸机参数,促进BPD 早产儿正常生长发育。

