莪术醇柔性脂质体雾化吸入剂的制备及体内外评价
陈博,刘一帅,田葳,叶田田,杨瑞,王淑君*(1. 安徽中医药大学药学院,合肥 001;. 沈阳药科大学,沈阳 110016;. 辽宁中医药大学附属第二医院,沈阳 11004;4. 江苏艾迪纳米生物医药有限公司,江苏 南通61;. 南通市海门长三角药物高等研究院,江苏 南通 61)
肺是人体的重要器官,空气中的灰尘颗粒、有毒物质和细菌等吸入肺部都有可能引起肺部疾病以及全身疾病[1]。肺部疾病包括各种肺炎(细菌、真菌、病毒性或吸入性肺炎)、肺纤维化、肺癌和哮喘等。靶向药物递送到肺部已成为全身或局部药物递送系统的重要研究方向之一。莪术醇(curcumol,Cur)又名姜黄醇,主要来自于姜科植物莪术、姜黄等中药中提取分离的一种倍半萜类化学成分,为无色针状结晶,易溶于乙醚、氯仿,溶于乙醇,微溶于石油醚,几乎不溶于水,在水中的溶解度仅为0.3%[2]。莪术醇是莪术挥发油的重要成分之一,具有抗纤维化、抗炎、抗氧化、抗肿瘤、降血脂等药理作用,在临床治疗中具有广阔的应用前景[3-4]。现代药理学证实,莪术醇可使致纤维化因子α-SMA、Smad2/3、TGF-β的mRNA表达水平降低[5]。莪术醇可以降低肺纤维化大鼠肺组织中TGF-β1和PAI-1的表达,降低肺组织中羟脯氨酸的含量,缓解博来霉素诱导的大鼠肺纤维化[6]。莪术醇可以通过抑制JAK1/STAT3信号通路激活而抑制肺癌细胞的增殖和侵袭[7]。张国立等[8]通过将莪术挥发油和莪术醇制备成肺吸入给药的粉雾剂,将药物递送至肺部,不仅对急性肺损伤具有良好的治疗作用,而且提高了药物的肺组织分布,减少了全身其他组织分布及不良反应。
由于莪术醇几乎不溶于水,很难达到口服或注射给药的要求,极大地限制了其实验研究和临床应用。脂质体(liposome,LP)主要是由两亲性的磷脂和其他辅料构建的双层囊泡,具有类细胞结构,可以作为药物的有效载体。利用脂质体包裹莪术醇可提高其溶解度,增强稳定性,同时具有低毒性、缓释、改善稳定性等优点[9]。其中,柔性脂质体又称为可变形脂质体,由于其高变性、高柔韧性、高渗透性的特点被广泛应用于经皮给药系统中,但是在雾化吸入给药方面报道较少[10]。相比较于静脉注射,雾化吸入由于使用方便、肺组织浓度较高、全身不良反应少等特点而日益受到重视[11]。本实验采用薄膜水化法制备了莪术醇柔性脂质体,优化了其处方和工艺,并对该制剂的质量以及体外活性进行了评价,通过雾化吸入的给药方式考察了莪术醇柔性脂质体的肺部靶向性,以期提高莪术醇柔性脂质体的肺部靶向性和肺部疾病的治疗效果,为莪术醇新剂型的进一步研究提供依据。
1 材料
1.1 细胞和动物
A549人肺腺癌细胞(武汉尚恩生物技术有限公司,批号:SNL-089),SPF级KM雄性小鼠12只[辽宁长生生物技术股份有限公司,许可证号:SCXK(辽)2020-0001],在沈阳药科大学动物实验中心[许可证编号:SYXK(辽)2021-0009]进行实验,操作严格遵守实验动物伦理保护等相关规定。
1.2 试药
莪术醇(自制[12],纯度>97%,批号:20220401),莪术醇对照品(中国食品药品检定研究院,纯度≥99.9%,批号:100185-201908),磷钨酸负染色液(北京索莱宝科技有限公司,批号:20201130),大豆卵磷脂S100(德国利宝益公司,批号:903910B),吲哚菁绿(批号:C14185060),葡聚糖凝胶G50(批号:C14185058),胆固醇(上海麦克林生化科技有限公司,批号:C12398354),TGF-β1[派普泰克生物科技(苏州)有限公司,批号:0719354],磷酸盐缓冲液(含5%海藻糖,pH 7.2,联科生物,批号:A20635),RPMI-1640培养基、1×磷酸盐缓冲液(Gibco公司),胎牛血清(HyClone公司),无水乙醇、二氯甲烷为国产分析纯,甲醇为国产色谱纯。
1.3 仪器
2 方法与结果
2.1 莪术醇柔性脂质体含量测定方法的建立
2.1.1 色谱条件 色谱柱为DB-WAX(30 m×0.32 mm,0.25 µm);进样口温度为240℃;检测器温度为250℃;柱流量为1.5 mL·min-1;进样方式为液体直接进样;分流比为5∶1;升温程序为起始温度185℃,保持10 min,以20℃·min-1升温至225℃,保持8 min。
2.1.2 专属性实验 ① 空白溶剂为甲醇;② 取空白脂质体0.2 mL置10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得空白脂质体溶液;③ 精密称取莪术醇对照品20 mg,置10 mL量瓶中,用甲醇稀释至刻度,摇匀,即得2 mg·mL-1的莪术醇对照品储备液,精密移取莪术醇对照品储备液0.2 mL置10 mL量瓶中,加甲醇溶解稀释至刻度,即得0.04 mg·mL-1的莪术醇对照品溶液;④ 精密称取莪术醇供试品20 mg,置10 mL量瓶中,用甲醇稀释至刻度,摇匀,即得2 mg·mL-1的莪术醇供试品储备液,同莪术醇对照品储备液处理,即得0.04 mg·mL-1的莪术醇供试品溶液。取空白溶剂、空白脂质体、供试品溶液及对照品溶液各2 μL,分别进样分析,结果如图1所示,莪术醇对照品及供试品在该色谱条件下的保留时间分别为8.919、8.921 min,空白溶剂、空白辅料溶液均不干扰莪术醇测定,专属性良好。
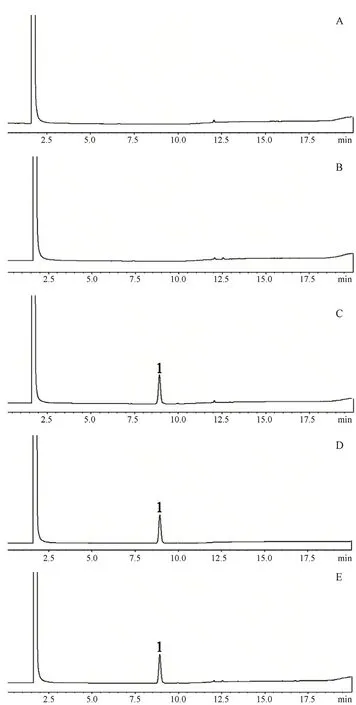
图1 专属性色谱图Fig 1 Specificity chromatogram
2.1.3 线性关系考察 精密量取莪术醇储备液0.1、0.2、0.3、0.4、0.5、0.6 mL,置10 mL量瓶中,加甲醇稀释至刻度,照“2.1.1”项下色谱条件,进样测定,以莪术醇的质量浓度(C,mg·mL-1)为横坐标,峰面积(A)为纵坐标,进行线性回归,得线性方程为:A=4.769×106C+1.382×103,r为0.9992。结果表明,莪术醇在0.020~0.120 mg·mL-1与峰面积线性关系良好。
2.1.4 仪器精密度考察 取莪术醇柔性脂质体对照品溶液连续进样6次。取供试品溶液连续进样6次,结果莪术醇的保留时间RSD值为0.02%,峰面积RSD值为0.48%,仪器精密度符合规定。
2.1.5 重复性考察 按照“2.1.2”项下方法配制供试品溶液,平行6份,进样分析,结果莪术醇含量的RSD值为0.52%,表明方法重复性良好。
2.1.6 溶液稳定性考察 按照“2.1.2”项下方法配制溶液,对照品溶液和供试品溶液分别于0、2、4、8、10、12 h进样测定,记录色谱图,考察放置稳定性。结果对照品溶液、供试品溶液峰面积RSD值分别为0.61%、0.59%,说明供试品溶液、对照品溶液在12 h内稳定。
2.1.7 加样回收实验 按照“2.1.2”项下方法配制溶液,精密称取莪术醇对照品溶液,分别配制成低、中、高(0.02、0.04、0.06 mg·mL-1)3个质量浓度,加入等量莪术醇柔性脂质体,平行配制3份;测得低、中、高浓度的平均加样回收率分别为99.05%、101.89%、102.05%,其RSD分别为0.71%、0.20%、0.15%,结果表明加样回收率良好。
准确称取样品10.0 g(精确到0.01 g)于50 mL离心管中,加入10 mL乙腈,涡旋10 min,加入3~4 g NaCl(140 ℃,烘烤4 h),涡旋1 min,在5000 r/min下离心5 min;取上清液1.5 mL,加入30 mg PSA和50 mg无水硫酸镁,振荡1 min,10000 r/min下离心5 min;取上清液过0.22 μm有机滤膜,待测。
2.1.8 包封率的测定 采用微柱离心法[13]测定脂质体包封率,取制备好的微型凝胶柱,精密吸取0.2 mL脂质体溶液,加于微型凝胶柱的顶端,3000 r·min-1离心3 min,继续加入0.2 mL纯化水于凝胶柱的顶端,3000 r·min-1离心3 min,用相同体积的纯化水分别连续洗脱,重复上述操作4次,合并洗脱液,置10 mL量瓶中,加甲醇溶解,稀释定容至刻度,摇匀,取2 μL进样分析,得峰面积A样,平行测定3份;另分别精密吸取0.2 mL脂质体溶液,置10 mL量瓶中,加甲醇溶解,稀释定容至刻度,摇匀,取2 μL进样分析,得峰面积A对,平行测定3份。包封率(%)=A样/A对×100%。
2.2 莪术醇柔性脂质体制备方法筛选
2.2.1 薄膜水化法[14]分别精密称取处方量莪术醇、大豆卵磷脂S100和胆固醇于茄形瓶中,加入5 mL无水乙醇,超声至固体全部溶解,得到淡黄色澄清透明溶液,待脂质膜材料溶解后。将茄形瓶于40℃下真空旋转蒸发30 min,除去乙醇,得干燥的脂质沉积物。量取10 mL纯化水,于40℃下预热,预热完全后加入茄形瓶中,水化30 min。将水化后脂质体混悬液置于EP管在冰浴中,于400 W探头超声15 min(工作3 s,间歇3 s),随后过1次0.8 μm微孔滤膜,过2次0.22 μm微孔滤膜,即得,测定脂质体包封率及粒径。
2.2.2 逆向蒸发法[15]分别精密称取处方量莪术醇、大豆卵磷脂S100和胆固醇于EP管,加入6 mL二氯甲烷,超声至固体全部溶解。用注射器将2 mL纯化水抽出,将针头完全插在有机相液面下方,缓缓打入其中,在冰浴中于400 W探头超声5 min(工作3 s,间歇3 s),成白色乳浊液,静置10 min稳定无明显分层。45℃减压旋蒸除去有机溶剂约30 min,成凝胶状。取10 mL纯化水40℃下预热,预热完全后加入茄形瓶中,水化30 min。将水化后脂质体混悬液于EP管在冰浴中400 W探头超声10 min(工作3 s,间歇3 s),随后过1次0.8 μm微孔滤膜,过2次0.22 μm微孔滤膜,即得,测定脂质体包封率及粒径。
2.2.3 乙醇注入法[16]分别精密称取处方量莪术醇、大豆卵磷脂S100和胆固醇,加入5 mL无水乙醇,超声至固体全部溶解。将有机相通过注射器缓缓注入处方量纯化水中。于45℃水浴磁力搅拌至无醇味后将脂质体混悬液置于EP管,在冰浴中于400 W探头超声15 min(工作3 s,间歇3 s),随后过1次0.8 μm微孔滤膜,过2次0.22 μm微孔滤膜,即得,测定脂质体包封率及粒径。
2.2.4 确定制备方法 根据包封率选择合适的脂质体制备方法,测定其包封率、中值粒径(D50)、跨度(Span),结果见表1。薄膜水化法制得脂质体包封率最高。薄膜水化法可能由于在旋蒸过程中,在茄形瓶内壁上形成一层脂质薄膜,使莪术醇与磷脂有序且均匀地排列在薄膜上,经水化后得到包封率较高、均匀、稳定的脂质体混悬液。因此,最终选用薄膜水化法制备莪术醇柔性脂质体。

表1 不同方法制备的脂质体包封率、粒径Tab 1 Encapsulation rate and particle size of liposomes prepared by different methods
2.3 莪术醇柔性脂质体处方的单因素考察
根据脂质体常用的辅料及种类,以包封率为重点考察指标,参照表2条件对辅料的种类及用量进行筛选,对脂质体的制备工艺进行优化。结果表明,当药脂比为1∶30(w/w)时,包封率达到最大值,当磷脂用量过大时包封率反而会下降,稳定性降低;当无胆固醇时包封率高、Span值小,粒径分布均匀,最终选择无胆固醇为进一步的优化条件;成膜温度在50℃时脂质体的包封率较高;水化温度在40℃时包封率最高,再结合磷脂的相变温度,考虑制剂稳定性,最终选择水化温度40℃为进一步的优化条件;水化15 min时包封率最高,且可水化完全,最终选择水化时间15 min为进一步的优化条件;水化转速为1204~1212 r·min-1时包封率最高,且可水化完全,最终选择水化转速为1204~1212 r·min-1为进一步的优化条件。

表2 单因素考察(n=3)Tab 2 Single factor examination (n=3)
2.4 正交设计优化莪术醇柔性脂质体处方
在单因素考察结果的基础上,选择药脂比(A)、膜材比(B)、旋蒸温度(C)3个影响因素,每个因素3个水平,以包封率为主要考察指标,进行三因素三水平的正交实验,实验设计见表3。选用L9(33)正交表,分别制得莪术醇柔性脂质体,测定其包封率,结果见表4,方差分析见表5。

表3 正交实验因素水平Tab 3 Factor and level

表4 正交实验结果Tab 4 Orthogonal test
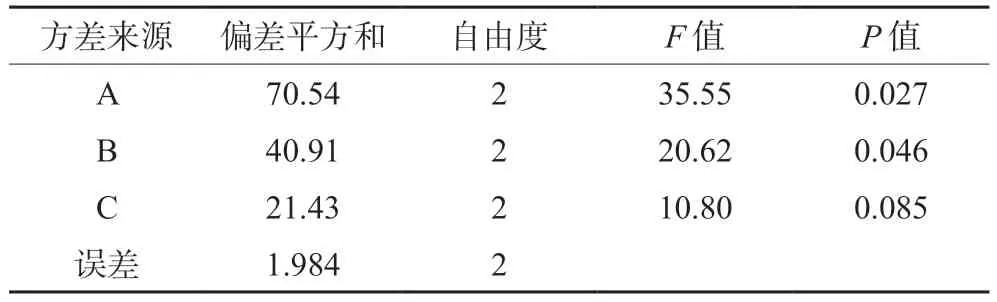
表5 方差分析Tab 5 Analysis of variance
重要程度依次为药脂比(A)>膜材比(B)>旋蒸温度(C),最终确定最佳处方为A2B2C2,即药脂比为1∶30,不加胆固醇,旋蒸温度为50℃。
2.5 验证实验
按最优处方制备3批莪术醇柔性脂质体,测定其包封率和粒径,结果见表6,脂质体的平均包封率为83.92%,平均粒径为0.116 μm。

表6 3批脂质体的包封率和粒径Tab 6 Encapsulation rate and particle size of the 3 batches of liposomes
2.6 透射电子显微镜观察
取稀释后的莪术醇柔性脂质体10 µL滴在铜网上,静置10 min后用毛边滤纸吸去多余的水分,向铜网表面滴加2%磷钨酸溶液,负染3 min,烘干后将样品放置在透射电镜下观察并拍摄电镜照片,可观察到脂质体外观呈圆整球形,粒径在100~200 nm,如图2所示。

图2 莪术醇柔性脂质体的透射电镜图Fig 2 Transmission electron micrograph of curcumol liposomes
2.7 体外释放的测定
精密量取莪术醇柔性脂质体以及莪术醇溶液2 mL,加入透析袋中,两端夹紧后置于含40%乙醇(V/V)的磷酸盐缓冲液(pH 6.5,30 mL)中,每个样品平行3份,避光,37℃恒温振荡。分别于1、2、4、6、8、10、12、24、48、72 h吸取2 mL透析液,并补加等体积磷酸盐缓冲液[17-18]。按“2.1.1”项下色谱条件测定其含量,并计算药物的累积释放百分率,结果如图3所示。

图3 莪术醇柔性脂质体的体外释放曲线Fig 3 In vitro release curves of curcumol liposomes
2.8 莪术醇柔性脂质体对细胞增殖的影响
目前,对于细胞增殖监测的方法采用的是传统的终点法,即仅仅给出某个时间点的结果,而在监测的时候需要破坏细胞,这种方法无法获得细胞真正的生长状态,对细胞的生长过程无法做出动态检测和分析。为了更好地观察和统计莪术醇对A549细胞的影响,本实验采用了能够非伤害的、长时间实时动态观察活细胞的功能分析系统(IncuCyte)来监测细胞增殖情况。
2.8.1 莪术醇对细胞增殖的影响 将复苏的A549细胞接种到F-12培养基中(含10%胎牛血清),在37℃、5%CO2饱和湿度条件下培养。传代2~3次,取处于对数生长期的A549细胞制备成单细胞悬液,以5000个/孔的细胞密度接种于96孔板中。待细胞贴壁后,每孔再加入10 μL质量浓度为10 ng·mL-1的TGF-β1进行造模。再将96孔板置于IncuCyte中,对每孔持续拍照24 h。观察各组细胞形态,如图4所示,对照组A549细胞呈鹅卵石样,细胞大小均匀,没有突触、多角,贴壁状态良好。经TGF-β1刺激后,A549细胞呈现梭状,细胞圆形度明显降低,与成纤维细胞相似,说明造模成功。弃去板中液体,再加入不同质量浓度的莪术醇(80、53、35、23、15、10、7、4、3 μg·mL-1)至96孔板中,以0.1% DMSO作为对照组处理细胞,每组5个复孔。将96孔板放入IncuCyte中,每孔持续拍照48 h,结果莪术醇呈浓度依赖性抑制细胞增殖(见图5),选取合适浓度的莪术醇进行后续实验。
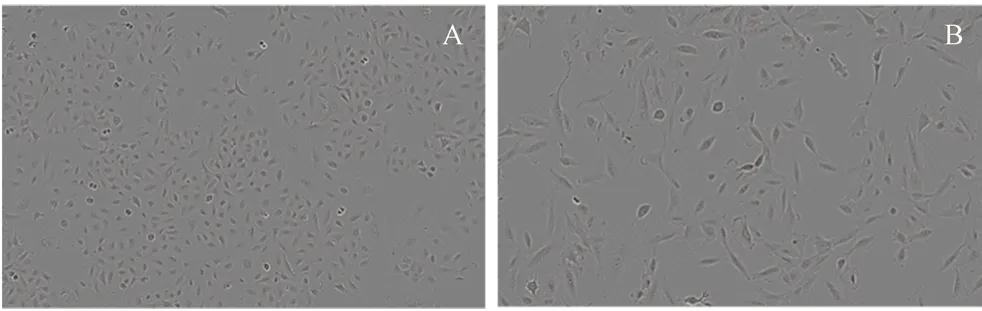
图4 A549细胞(A)和TGF-β1诱导的A549细胞(B)Fig 4 A549 cells(A)and TGF-β1-induced A549 cells(B)

图5 不同浓度莪术醇对TGF-β1诱导的A549细胞活性的影响Fig 5 Effect of different concentrations of curcumol on the viability of TGF-β1-induced A549 cells
2.8.2 莪术醇柔性脂质体对细胞增殖的影响 将空白脂质体、莪术醇、莪术醇柔性脂质体加至96孔板中(设置空白组、对照组),每组5个复孔,测定药物对细胞动态生长趋势的影响,用Confluence(%)表示细胞增殖的汇合度。将板放入IncuCyte中,96孔板每孔持续拍照48 h,结果如图6所示,空白脂质体48 h时在实验浓度范围内细胞的存活率大于90%,表明空白脂质体无明显毒性作用。莪术醇组和莪术醇柔性脂质体组对TGF-β1诱导的A549细胞均具有浓度和时间依赖性的抑制作用,且莪术醇柔性脂质体组效果优于莪术醇组。在48 h时,莪术醇柔性脂质体的半数抑制浓度(IC50)为9.11 μg·mL-1,优于游离莪术醇的12.23 μg·mL-1。

图6 莪术醇与莪术醇柔性脂质体对TGF-β1诱导的A549细胞活性的影响Fig 6 Effect of curcumol and curcumol liposomes on the viability of TGF-β1-induced A549 cells
2.9 体内实验
本研究通过包裹吲哚菁绿光敏剂进行动物活体成像,将12只健康KM小鼠(提前剃去腹部鼠毛)随机分为空白对照组、雾化吸入莪术醇溶液组、雾化吸入莪术醇柔性脂质体组、静脉注射莪术醇柔性脂质体组,每组3只。雾化吸入药物质量浓度为1 mg·mL-1的莪术醇溶液和莪术醇柔性脂质体5 min,静脉注射莪术醇柔性脂质体(5 mg·kg-1单次给药)。在给药后0 min、5 min、30 min、1 h、3 h、6 h、8 h、12 h、24 h分别测定小鼠体内荧光强弱。结果如图7所示,莪术醇柔性脂质体组雾化吸入肺部滞留时间及滞留量优于雾化吸入莪术醇溶液组和静脉注射莪术醇柔性脂质体组。24 h后脱颈处死小鼠,取出主要器官(包括心、肝、脾、肺、肾),生理盐水冲洗后置于血管成像仪中观察各组织荧光情况并拍照。结果如图8所示,雾化吸入莪术醇柔性脂质体组只分布于肺部,雾化吸入莪术醇溶液在肝部及肺部均有分布,静脉注射莪术醇柔性脂质体主要分布于肝组织。

图7 莪术醇在小鼠体内的分布Fig 7 In vivo distribution of curcumol in mice
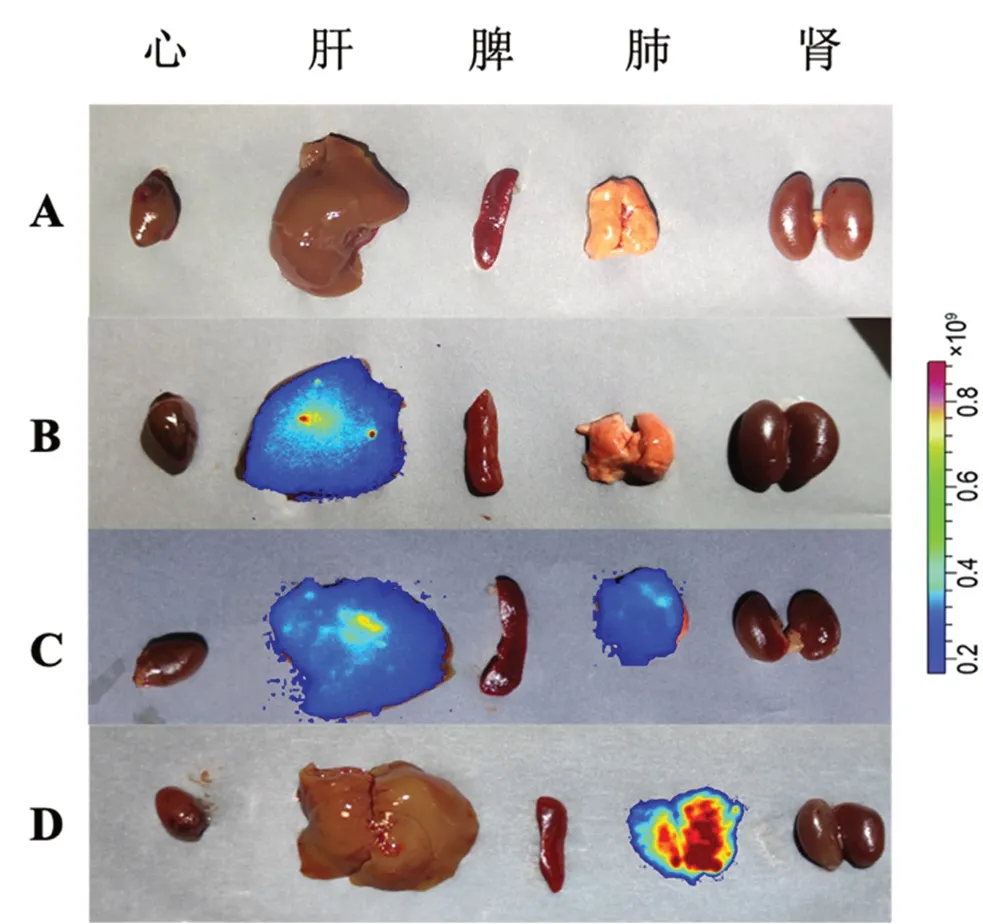
图8 莪术醇在小鼠组织的分布Fig 8 Tissue distribution of curcumol in mice
3 讨论
莪术醇为脂溶性药物,难溶于水,属于倍半萜类化合物,且分子中具有共轭双键,因此化学性质比较活泼,使其临床应用具有一定的困难。本研究通过将莪术醇包封于脂质体中,不仅改善了其脂溶性问题,而且提高了其稳定性。
本研究采用薄膜水化法制备了莪术醇柔性脂质体,薄膜水化法是一种经典的制备方法,可以制备得到多室脂质体,经过超声处理得到小单室脂质体。该法所制的莪术醇柔性脂质体粒径分布均匀,方法简单,工艺可行。通过单因素考察和正交实验确定了莪术醇的最优处方和制备工艺。体外释放实验表明,莪术醇柔性脂质体相比较游离莪术醇具有更好的缓释作用。细胞增殖实验中,莪术醇柔性脂质体的抑制作用优于游离的莪术醇,推测其可能与脂质体提高莪术醇的溶解度和增加莪术醇在细胞内的滞留时间相关。通过雾化吸入的给药方式可以极大地提高莪术醇柔性脂质体的肺部靶向性,使得药物能够更好地到达疾病部位,减少在其他器官中的蓄积,提高药物的有效性。
综上所述,本研究制备的雾化吸入莪术醇柔性脂质体安全可靠,经雾化吸入后在肺部缓慢释放,起到缓释作用,且在具有肺部靶向功能的同时减少了在其他健康组织的蓄积,可减轻不良反应,增加治疗效果。而本实验仅在细胞水平初步验证了莪术醇抗纤维化活性及其在体内的肺部靶向性,未进行莪术醇柔性脂质体的抗肺纤维化药效学实验,后续本课题组将继续考察莪术醇柔性脂质体的体内外药效学实验和体内药代动力学等,为进一步研究莪术醇柔性脂质体抗纤维化活性奠定基础。

