猪繁殖与呼吸综合征病毒NADC30-like 毒株的毒力评价
李俊辉,张伟,程兰玲,潘晓梅,唐慧芬,周涛,秦义杰,胡耀凯,刘强德,肖艳,贺笋
(天康生物制药有限公司 乌鲁木齐 830032)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是引起母猪繁殖障碍和仔猪呼吸道症状及死亡的高度接触性传染病,其病原猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)是一种易于发生变异和重组的单股正链RNA 病毒,该疾病可造成持续性感染和免疫抑制,对养猪业危害极为严重[1]。上世纪80 年代PRRS 在美国首次被报道,当时因病原体未知被称“猪神秘病”[2],我国在1996 年首次分离到PRRSV 并命名为CH-1a[3],此后流行的PRRSV 基因组发生变异,在Nsp2 基因处出现30 个氨基酸不连续缺失,称之为高致病性猪繁殖与呼吸综合征病毒(Highly pathogenic porcine reproductive and respiratory syndrome virus,HP-PRRSV),该毒株可感染各个年龄阶段的猪只,发病率可达50%~100%,死亡率达20%~100%,感染猪群主要表现出高热、高发病率和高死亡率的典型特征,给我国养猪业造成极大经济损失[4,5]。2014 年起我国报道了基因组出现明显变异和易重组的NADC30-like PRRSV[6,7]。不同区域类NADC30 毒株毒力差异较大,HNjz15 仅表现一过性体温升高、伴随呼吸道症状和体重下降的临床表现[7],而PRRSV JL580 可引起6 周龄的猪100%死亡[6]。通过全基因组分析也不能有效判定毒株的毒力,因此,本研究将分离的毒株用靶动物进行毒力评价,以期获得一株能够用于疫苗的效力评价的中等毒力或强毒力毒株。
1 材料与方法
1.1 毒株
PRRSV NADC30-like 毒株由天康生物制药有限公司分离获得。毒株信息见表1。经外源病毒检测,证明无PRRSV、ASFV、PRV、CSFV、PCV2/3 等外源病毒和细菌的污染。
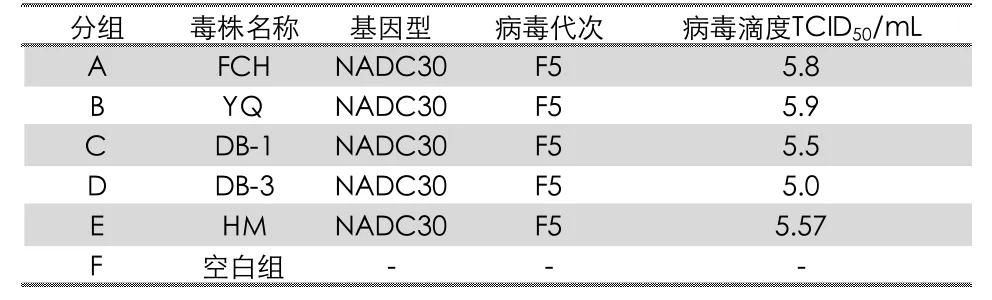
表1 进行毒力评价的猪繁殖与呼吸综合征病毒分离毒株的背景信息
1.2 试验动物
30 头6~7 周龄健康易感猪,PRRSV(病原和抗体)阴性;伪狂犬gE(抗原和抗体)阴性;猪瘟病原阴性;PCV2 病原阴性。
1.3 主要试剂与耗材
核酸提取试剂购自天根生物工程公司;PRRSV、PRV、CSFV、PCV2、核酸检测试剂盒购自世纪元亨公司;PRRSV、PRV 抗体试剂盒购自IDEXX 公司。
2 动物试验
试验分为六组,每组5 头,其中五组为攻毒组,另一组为空白对照组;30 头试验随机分组,并对其进行编号,分配在不同的区域进行饲养。每个试验组动物的编号应如实进行记录。试验分组信息见表2。
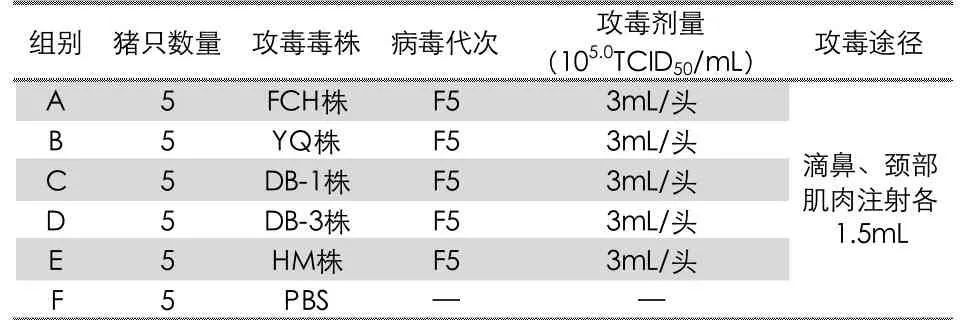
表2 试验动物分组
2.1 攻毒程序
1)攻毒前准备。所有猪每日测定直肠温度用于确定基础体温,以攻毒前3d 测定的直肠温度的平均值作为基础体温。
2)攻毒。毒力评价组所有猪按颈部肌肉注射和滴鼻途径接种不同分离PRRSV 毒株(病毒含量为1.0×105.0TCID50/mL),滴鼻接种1.5 mL,颈部肌肉注射1.5 mL。攻毒时,使猪头部稍微上仰,当猪吸气时,缓慢滴入鼻腔。对照组接种PBS,接种方式和剂量与毒力评价组相同。
2.2 攻毒后临床症状观察
试验动物攻毒后每日进行临床症状观察,包括食欲状况、呼吸症状、精神状态、腹泻等,并记录观察结果,统计死亡情况。
2.3 体温测定
攻毒后每日上午测直肠温度,直至攻毒后21d 结束。
2.4 样品采集
攻毒后第0、3、5、7、10、14 和21 天采集全血、咽拭子和肛拭子,直至试验结束。血样分离血清,用于样品中核酸载量分析。
3 结果
3.1 临床症状
从精神状态、被毛、体型、呼吸、咳嗽、皮肤、眼睛/结膜、采食、粪便九个维度进行临床症状评分,每个维度0~3 分,发病越严重评分越高[8]。其中A 组有一头猪有临床症状总评分(九个维度合计)最高2 分,表现采食下降,眼结膜炎;另外一头最高总评分7 分,主要表现采食下降、被毛粗乱、皮肤发红和眼结膜炎的症状,最高得分之后逐渐恢复正常,其他三头在整个期间临床症状总评分为0 分,未表现出九个维度特有的临床症状。B 组有三头临床症状总评分最高分别为3 分、2 分、2 分,主要表现采食降低,眼结膜炎的症状,之后逐渐恢复正常,其余两头为0 分。C 组五头临床症状总评分最高分别为1 分、2 分、2 分、4 分、4 分,主要表现采食降低,眼结膜炎或被毛粗乱的症状,之后逐渐恢复正常。D 组五头临床症状总评分最高分别为10 分、12 分、12 分、13 分、15 分,得15 分猪最终死亡,主要临床症状表现为不食、消瘦、被毛粗乱、眼部分泌物将上下眼睑粘连、卧倒不能站立、呈现腹式呼吸;得10~13 分者表现食欲不佳、消瘦、被毛粗乱、眼部分泌物将上下眼睑黏连、卧倒后驱赶可站立。E 组有两头临床症状总评分最高分别为2、4 分,主要表现采食下降,眼结膜炎,其余三头为0 分。F 组在整个攻毒过程中临床症状总评分均为0 分。
3.2 体温测定结果
其中D 组攻毒后第4~15 天,该组试验猪平均体温均不低于40.5 ℃,3/5 试验猪连续3 d 体温超过41 ℃,显著高于其他攻毒组,其他攻毒组试验猪呈现体温一过性升高,偶有一个温次超过41 ℃后逐步恢复正常。对照组试验猪在整个试验过程中体温未超过39.6 ℃,见图1“试验猪攻毒后体温变化曲线”。
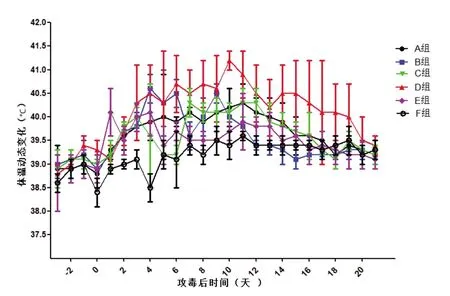
图1 试验猪攻毒后体温变化曲线
3.3 血液、口、肛拭子病毒载量分析
1)血液中病毒载量。试验猪攻毒后分别在第0、3、5、7、10、14和21 天采集全血监测病毒血症的动态变化。所有猪在第0 天血液核酸阴性;A 组在攻毒第21 天检测有一头猪核酸阴性,其他猪和其他监测时间均为阳性;B 组有一头猪在第10、14 和21 天核酸阴性,有三头在第14 天核酸阴性,之后又转为阳性;C 组在第14 天有一头猪核酸阴性,第21 天又转为阳性,其他监测时间均为阳性;D组在整个攻毒期病毒血症核酸均为阳性;E 组在攻毒后第21 天检测有一头猪核酸阴性,其他猪和其他监测时间均为阳性;F 组从攻毒到结束病毒血症始终为阴性。图2-1“试验猪攻毒后全血中病毒核酸载量分析”。
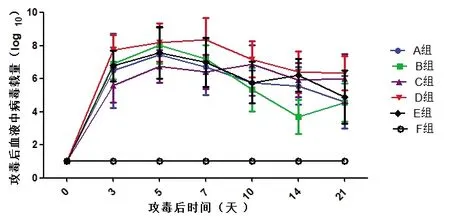
图2-1 试验猪攻毒后全血中病毒核酸载量分析
2)咽拭子病毒载量的动态变化。试验猪攻毒后分别在第0、3、5、7、10、14 和21 天采集全血监测咽拭子排毒的动态变化。所有猪在第0 天咽拭子核酸阴性;A 组在攻毒第14 和21 天检测分别有一头猪核酸阴性,其他猪和其他监测时间均为阳性;B 组在第10 天有三头猪、第14 天所有猪、第21 天一头猪核酸阴性,之后又转为阳性;C 组在第10、14 和21 天分别有四头猪核酸阴性,第21 天又转为阳性,其他监测时间均为阳性;D 组攻毒开始到结束咽拭子始终为核酸阳性;E 组在攻毒后第14 和21 天检测分别有二头、一头猪核酸阴性,其他猪和其他监测时间均为阳性;F 组从攻毒到结束咽拭子始终为阴性,见图2-2。
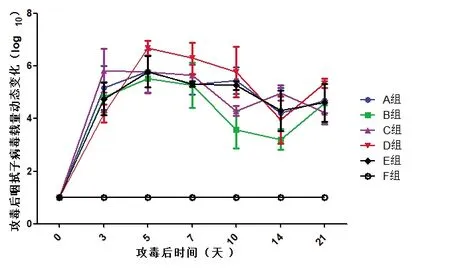
图2-2 试验猪攻毒后咽拭子中病毒核酸载量分析
3)肛拭子病毒载量的动态变化。试验猪攻毒后分别在第0、3、5、7、10、14 和21 天采集全血监测咽拭子排毒的动态变化。所有猪在第0 天肛拭子核酸阴性;A 组在攻毒第10 和21 天检测分别有三头猪、两头猪核酸阴性,其他猪和其他监测时间均为阳性;B 组在第10 天有三头猪、第14 天所有猪、第21 天一头猪核酸阴性,之后又转为阳性;C 组在第7、10 和21 天分别有三头、一头、三头猪核酸阴性,第14 天又转为阳性,其他监测时间均为阳性;D 组攻毒开始到结束肛拭子始终为核酸阳性;E 组在攻毒后第7、14 和21 天检测分别有一头、第10 天有两头猪核酸阴性,其他猪和其他监测时间均为阳性;F 组从攻毒到结束咽拭子始终为阴性,见图2-3。

图2-3 试验猪攻毒后肛拭子中病毒核酸载量分析
3.4 发病率统计
通过上述试验数据与结果的分析,结合农业部第1548 公告《高致病猪繁殖与呼吸综合征病毒活疫苗(TJM-92 株)质量检验标准规程》中检验用种毒的要求,从体温、临床症状、肺部病变三个维度进行判定,本试验分离毒株进行毒力评价和发病率分析统计见表3。
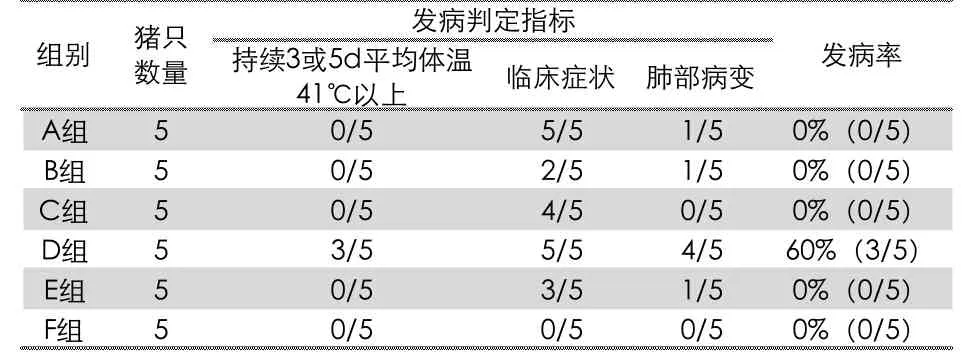
表3 发病率统计表
4 讨论
本研究经分离的毒株来自PRRSV 发病严重的阳性场,临床猪死亡率在40%~50%,但在实验室条件下进行毒力评价并没有显示比较强的致病性,但JL580 株的致死率可达到100%[6]。造成这种差异存在两个方面原因,一方面和毒株自身的致病力有关,有研究表明,JL580 株是类NADC30 与高致病性的重组毒,故具有较强的毒力[6]。另一方面用于毒力评价的猪只比较健康,饲养环境较好,未引起与临床相当死亡率。从临床症状评分看,只有D 组表现出PRRSV特有的严重的临床症状外,其余四组主要表现采食降低、被毛粗乱、眼结膜炎的轻微症状,临床症状的严重程度和体温成正相关。
本研究所用毒株经宏基因组测序分析YQ(B 组)由谱系1.9 毒株PRRSV-T1 和谱系8.7 毒株JXA1-P120 重组而来;DB1(C 组)由谱系1.9 代表毒株NADC30 和谱系8.7 毒株HB-1/3.9c 重组而来;FCH(B 组)、HM(E 组)没有与其他谱系的毒株重组,但上述毒株均属低致病力毒株,有可能在重组或进化过程中未获得强毒的毒力基因。而DB3(D 组)由谱系1.9 毒株Fujian-2014 和谱系3 野毒株QYYZ 重组而来,可使3/5 发病,一头死亡,属中等毒力毒株,在整个试验过程中体温、病毒血症、咽拭子、肛拭子排毒时间和排毒量均高于其他攻毒组类。从病毒血症、咽拭子、肛拭子含毒量、含毒周期数据来看,病毒检出率为病毒血症〉咽拭子〉肛拭子,因此,在临床检测中全血是首选的检测材料。
NADC30 毒株无时无刻不在发生变异和重组,在进化重组的过程中有可能获得高致病性的毒力基因,为PRRSV 疫病的防控雪上加霜。在实际生产中除做好生物安全外,急需一款能够通用且广谱的PRRSV 基因工程疫苗,以减少临床带毒、排毒和共感染现状,减少毒株遗传演化多样性,从而降低因PRRSV 造成的经济损失。因此,获得一株具有代表性,又可引发强烈临床症状的毒株是至关重要的,本研究评价的毒株(DB-3)初步可用于NADC30-like 疫苗效力评价的毒株。

