镇巴腊肉生产过程中微生物组成及多样性变化
左瑶 朱联旭 路宏朝 任宏强 王令 王珊珊 吴国飞 张涛

摘 要:基于高通量测序技术,对镇巴腊肉加工过程不同阶段的微生物种群组成进行鉴定和分析,同时对细菌表型及相关功能进行预测。结果表明:镇巴腊肉生产加工过程中,真菌丰度大于细菌丰度,并随着发酵时间及加工工艺变化,微生物群落存在明显的演替;镇巴腊肉中丰度最高的细菌为厚壁菌门(Firmcutes)和变形菌门(Proteobacteria),优势细菌属随着加工步骤推进由原料肉样品中的大肠-志贺氏菌属演替为腌制时期和熏制时期的葡萄球菌属(Staphylococcus)、嗜冷杆菌属(Psychrobacter)和乳杆菌属(Latilactobacillus);丰度最高的真菌门为子囊菌门(Ascomycota)和担子菌门(Basidiomycota),优势真菌属由镰刀菌属(Fusarium)和被孢霉属演替为镰刀菌属(Mortierella)和德巴利氏酵母属(Debaryomyces);基于菌落演替变化及细菌表型和功能预测,发现镇巴腊肉在加工过程中有害微生物不断减少,利于发酵的微生物逐渐增加,促进镇巴腊肉风味物质形成。
关键词:镇巴腊肉;微生物多样性;高通量测序;微生物群落演替
Abstract: High-throughput sequencing technology was used to identify and analyze the microbial community in Zhenba bacon at different stages of processing, and bacterial phenotypes and related functions were predicted. The results showed that during the processing of Zhenba bacon, the abundance of fungi was greater than that of bacteria, and there was an obvious succession of microbial community during the fermentation process. The most abundant bacteria were Firmcutes and Proteobacteria. As the process proceeded, the dominant bacteria changed from Escherichia coli and Shigella in the raw meat samples to Staphylococcus, Psychrobacter and Latilactobacillus at the curing and smoking stages. The most abundant fungal phyla were Ascomycota and Basidiomycota, and the dominant fungi changed from Fusarium and Alternaria to Mortierella and Debaryomyces. Based on the microbial community succession and the prediction of bacterial phenotype and functions, it was found that during the processing of Zhenba bacon, the harmful microorganisms decreased continuously, and the microorganisms conducive to the fermentation process gradually increased, which promoted the formation of flavor substances of Zhenba bacon.
Keywords: Zhenba bacon; microbial diversity; high-throughput sequencing; microbial community succession
DOI:10.7506/rlyj1001-8123-20230224-018
中圖分类号:TS251.51 文献标志码:A 文章编号:
引文格式:
左瑶, 朱联旭, 路宏朝, 等. 镇巴腊肉生产过程中微生物组成及多样性变化[J]. 肉类研究, 2023, 37(5): . DOI:10.7506/rlyj1001-8123-20230224-018. http://www.rlyj.net.cn
ZUO Yao, ZHU Lianxu, LU Hongzhao, et al. Changes in microbial composition and diversity during the production of zhenba bacon[J]. Meat Research, 2023, 37(5): . (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20230224-018. http://www.rlyj.net.cn
腊肉具有独特的风味、色泽、口感和质地,是一种传统腌干肉制品,品种、类型繁多[1]。腊肉属于发酵肉制品,其原料肉在自然条件或人工设定的环境下,通过微生物或酶的发酵作用,发生一系列生物、化学及物理变化,形成具有特殊风味、色泽和质地,且能长时间保藏的肉制品[2]。腊肉在发酵过程中,微生物菌群是影响其风味、口感和营养价值的关键因素[3-4]。受自然环境和饮食习惯影响,不同地区腊肉具有明显的风味差异和地域特色,这主要受腊肉生产过程中微生物种群差异的影响[5]。周莹等[6]通过高通量测序技术解析安徽地区徽派腊肉的微生物多样性,发现其优势菌群为乳球菌属、嗜冷杆菌属和葡萄球菌属等;文开勇等[7]研究发现,四川腊肉的优势微生物为葡萄球菌属和曲霉属;李彦虎等[4]研究表明,甘肃地区陇西腊肉中环丝菌属、肉食杆菌属及乳杆菌属等是其中的优势菌属。
陕西省镇巴县地属北亚热带季风气候,境内植被丰茂,自然环境优良,具有悠久的腊肉生产历史和成熟的生产工艺[8],镇巴腊肉形成了自己独特的风味和口感,2010年获地理标志产品保护。镇巴腊肉生产主要采用传统加工方式,依赖自然发酵[9]。由于镇巴腊肉生产过程中没有发酵剂等添加,故镇巴腊肉中的风味物质等形成主要靠发酵过程中的微生物参与原料的诸多生化反应,受微生物多样性及种群结构影响较大。本研究应用高通量测序技术,分析镇巴腊肉腌制和熏制过程中微生物多样性,为优化镇巴腊肉发酵工艺提供数据支撑,为镇巴腊肉产品提质创新和相关产业发展提供基础。
1 材料与方法
1.1 材料
镇巴腊肉生产主要有原料肉修整、腌制和熏制过程。其中生肉预处理主要将原料分割至相应大小肉坯,洗掉血污、肉表浮油,沥干表面水分;然后将食用粗盐均匀涂抹于表面,置于香樟木桶,室温腌制8~9 d;腌制结束后转至熏房,保持熏房温度为25~45 ℃,熏制30~32 d。根据镇巴腊肉生产过程,分别选择原料肉(修整后,M)、腌制中期(腌制4 d,S4D)、腌制末期(腌制8 d,S8D)、熏制中期(熏制16 d,F16D)和熏制末期(熏制32 d,F32D)5 个时期的样品,切取表层0.3~0.5 cm肉样,每组样品采集3 份平行样品,分别标记M1~M3、S4D1~S4D3、S8D1~S8D3、F16D1~F16D3、F32D1~F32D3,置于50 mL无菌离心管中,低温保存,快速送回实验室后置于-80 ℃冰箱保存。
1.2 仪器与设备
Synergy HTX酶标仪 香港基因有限公司;Legend Micro 21高速离心机、5424EQ766751 24 孔离心机 德国Eppendorf公司;G560E振荡器 美国Scientific Industries公司;9902 96 孔聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Thermo Fisher公司;1795微型离心机 天根生化科技(北京)有限公司。
1.3 方法
1.3.1 样品处理
每种样品分别取约5 g,剪碎至1 cm左右大小,加入10 mL灭菌生理盐水漩涡振荡3~5 min充分悬浮,重复2 次,收集上清液。6 000 r/min离心10 min,弃上清,收集菌体。使用基因组DNA提取试剂盒提取微生物基因组DNA,检测DNA质量和浓度后置于-20 ℃保存备用。
1.3.2 DNA片段扩增及测序
将处理后的样品送至北京擎科生物科技有限公司,完成DNA提取后,使用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')PCR扩增细菌16S rDNA的V3~V4区域,以及引物ITS 1(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS 2-Rev(5'-GCTGCGTTCTTCATCGATGC-3')PCR扩增真菌内转录间隔区(internal transcribed spacer,ITS)区域。PCR扩增体系为10×PCR buffer 5 μL、dNTP(10 mmol/L)35 μL、模板DNA 10 ng、正反向引物(10 μmol/L)各2 μL、Taq DNA聚合酶0.5 U,加dd H2O补齐体系至50 μL。PCR扩增程序为95 ℃预变性5 min,95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,循环25 次,最后72 ℃充分延伸5 min,4 ℃保存。纯化目标DNA后基于该公司Illumina Novaseq测序平台完成测序。
1.4 数据处理
DNA样品质检合格后基于Illumina Novaseq 6000平台,采用双末端测序的方法,经碱基识别得到原始序列。随后使用Trimmomatic v0.33和Cutadapt 1.9.1软件对原始序列进行过滤,同时识别并去除引物序列,基于Usearch v10软件将序列拼接起来,并根据不同区域的长度范围对拼接后数据进行长度过滤。使用QIIME2软件进行去噪并去除嵌合体序列,得到最终的有效序列,同时划分样品的操作分类单元(operational taxonomic unit,OTU),统计样品的ACE、Chao 1、Simpson和Shannon指数来评估样品α多样性。参考Silva数据库使用朴素贝叶斯分类器对特征序列进行分类学注释,绘制样品微生物门、属水平分布柱状图。通过t检验和线性判别分析效应量(line discriminant analysis (LDA) effect size,LEfSe)完成样品组间差异分析。通过BugBase和PICRUSt2软件对样品中微生物的表型及功能进行分析预测。
2 结果与分析
2.1 高通量测序结果质控及聚类分析
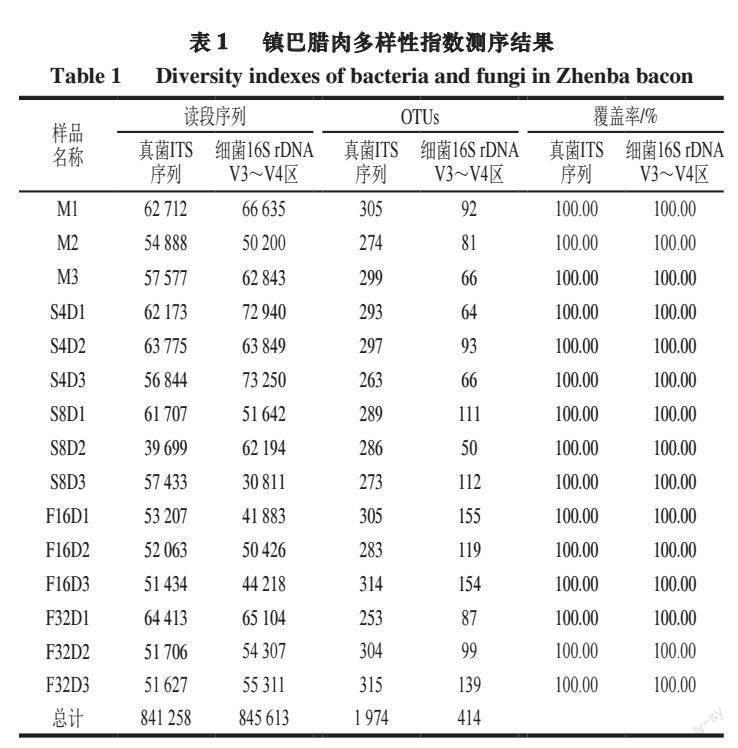
由表1可知,测序共得到845 613 条优质细菌16S rDNA V3~V4区序列和841 258 条优质真菌ITS序列,结果覆盖率达100.00%,说明测序深度足以代表样品中微生物的多样性,测序结果代表样品中微生物的真实情况。使用QIIME2软件对所得到的序列进行去噪和聚类,15 个样本共产生414 个细菌OTUs和1 974 個真菌OTUs,可以反映样品中细菌的丰度。其中样品F16D1中细菌OTUs达到155 个,样品S8D2仅有50 个;样品F32D3产生315 个真菌OTUs,S4D3仅产生263 个真菌OTUs,总体而言,样品中真菌丰度大于细菌丰度。
基于OTU对腊肉生产过程5 个阶段样品的微生物群落多样性进行聚类分析,绘制Venn图,利用Venn图可以清晰地展示样品中共有和特有的特征数目,以达到评估不同样本间OTUs组成及分布异同的目的。由图1可知,镇巴腊肉制作过程各时期中共有的细菌OTUs数量为9 个,真菌OTUs数量为56 个。其中样品M、S4D、S8D、F16D、F32D独有的细菌OTUs分别为51、19、50、35、12 个,独有的真菌OTUs分别为320、348、303、90、94 个。样品M共有125 个细菌OTUs和718 个真菌OTUs,样品S4D共有98 个细菌OTUs和721 个真菌OTUs,样品S8D共有171 个细菌OTUs和705 个真菌OTUs,样品F16D共有199 个细菌OTUs和578 个真菌OTUs,样品F32D共有162 個细菌OTUs和561 个真菌OTUs。结果表明,在镇巴腊肉生产过程中F16D中细菌微生物丰度最高,S4D细菌微生物丰度最低;S4D真菌微生物丰度最高,F32D真菌微生物丰度最低。不同生产时期样品的微生物组成有差异,细菌OTUs随加工工艺变化和时间延长浮动较大,而真菌OTUs在加工过程中不断降低,说明镇巴腊肉样品中真菌丰度受加工阶段和时间影响,并逐渐下降。
2.2 α多样性分析
α多样性反映的是单个样品物种丰度及物种多样性。Chao 1指数和ACE指数是微生物群落丰度指数,反映物种数量的多少。Shannon和Simpson指数用于衡量物种多样性,受样品群落中物种丰度和物种均匀度的影响,相同物种丰度的情况下,群落中各物种具有越大的均匀度,即不同物种分布越均匀,则认为群落具有越大的多样性。Shannon指数和Simpson指数越大,说明样品的物种多样性越高。
由图2A可知:腊肉样品中S4D的细菌Shannon指数和Simpson指数均最低,F16D的Shannon指数达到最高,F32D的Simpson指数最高,说明S4D中的细菌物种多样性最低,熏制时期2 种样品细菌物种多样性最高。M和S4D有显著差异,这表明腌制处理对于样品中的细菌组成影响较大;Chao 1和ACE指数在M和S4D中最低,F16D中最高,说明F16D中细菌物种丰富度最高。由图2B可知:样品中真菌的Shannon指数和Simpson指数在M、S4D和S8D均处于较高水平,在熏制处理时期有所下降,说明熏制处理对于腊肉样品中真菌组成有影响;Chao 1和ACE指数在S8D最低,熏制时期显著上升。综上所述,熏制是镇巴腊肉生产过程中重要的发酵步骤,对腊肉样品中微生物组成有较大影响。
2.3 镇巴腊肉中菌群结构分析
由图3可知,通过对特征序列进行分类学注释、统计并聚类分析,在腊肉样品中共鉴定出11 个细菌门和13 个真菌门,以及部分未分类和注释的微生物,其中细菌以变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)为主要优势菌群,真菌以子囊菌门(Ascomycota)和担子菌门(Basidiomycota)为主要优势组成部分,且子囊菌门在各加工时期均属于优势菌群,其相对丰度在整个加工过程中一直保持在50%以上,为腊肉样品中第一优势真菌群。M组变形菌门细菌占据绝对优势,相对丰度达到91%,在腌制处理后相对丰度显著降低至14%,随腌制时间延长和熏制加工后,相对丰度回升至50%左右。腊肉样品中厚壁菌门相对丰度也随加工处理时间的延长和工艺变化而产生波动,加工处理最终阶段稳定在50%左右。
为进一步揭示镇巴腊肉生产过程中不同时期细菌组成变化,将先前测序所得序列处理后,基于属分类水平将样品中微生物进行聚类分析,由图4可知,M组腊肉样品中占比较大的细菌菌属为大肠-志贺氏菌属(Escherichia-Shigella),其相对丰度为37%,通过加工工艺处理后其相对丰度降低至10%以下。在腌制处理时期,葡萄球菌属(Staphylococcus)、球菌属(Macrococcus)、嗜冷杆菌属(Psychrobacter)相对丰度不断上升,球菌属在S4D组达到最高,其相对丰度由M组的3%上升至51%;葡萄球菌属和嗜冷杆菌属也在S4D和S8D组相对丰度上升至30%和12%。熏制处理后,样品中主要的细菌菌属为弧菌属(Vibrio)、乳杆菌属(Latilactobacillus),其相对丰度分别为35%和19%;到熏制后期(F32D组),样品中的葡萄球菌属、嗜冷杆菌属相对丰度回升,成为这一时期优势菌群,其相对丰度分别为39%和23%。
真菌组成较细菌组成更复杂,种类更多。其中镰刀菌属(Fusarium)在各个发酵时期相对丰度均有10%左右,在F16D组相对丰度最高,达到11%。被孢霉属(Mortierella)相对丰度在各个发酵时期均稳定在5%左右。熏制处理后,库尔茨曼氏菌属(Kurtzmaniella)和德巴利氏酵母属(Debaryomyces)相对丰度上升,F16D和F32D组分别达到11%和25%,成为熏制时期的优势真菌。
综上结果表明,在镇巴腊肉发酵过程中,微生物组成在不断发生极大变化,优势菌群有明显的演替现象。如大肠-志贺氏菌属、不动杆菌属(Acinetobacter)、气单胞菌属(Aeromonas)等菌属在未处理的原料肉样品中为主要细菌属,这几类细菌广泛分布于外界环境,如水体、土壤中[10-11],故推断是由于原料肉存放期间和加工过程的间隙附着在样品表面,但在腌制和熏制时期相对丰度降低。在发酵过程中葡萄球菌属等生肉时期的非优势菌群成为主要组成部分,在发酵后期乳杆菌属等成为优势菌群,这说明不仅优势菌群存在演替现象,非优势菌群也存在演替现象。
2.4 镇巴腊肉不同加工时期微生物组成差异分析
为明确镇巴腊肉加工过程中不同时期的微生物属水平组成差异,对样本数据每2 组间进行t检验,由图5可知:较生肉时期样品,腌制处理后,葡萄球菌属细菌相对丰度显著上升;随着加工进程推进,熏制完成后样品中希瓦氏菌属(Shenwanella)相对丰度上升,罕见小球菌属(Subdoligranulum)相对丰度下降。腌制加工后相较生肉样品而言真菌组成变化不大;熏制加工处理后,对比生肉样品真菌组成差异较明显,灵芝属(Ganoderma)和冬虫夏草属(Cordyceps)等菌属相对丰度上升,曲霉菌属(Aspergillus)和长西氏菌属(Naganishia)等菌属相对丰度下降。对比S8D和F32D组真菌物种丰度差异,可以看出熏制工艺可以有效增加曲霉菌属和长西氏菌属的丰度。
综上结果表明,腌制工艺可有效增加样品中的葡萄球菌属细菌相对丰度,熏制工艺对于腊肉样品中真菌菌群的组成和结构影响较大,加工前后菌群结构差异显著。
LEfSe分析用于评估每组微生物种类的重要性。由图6可知,共分析得到36 种细菌生物标记物和42 种真菌生物标记物,其LDA值大于4.0,柱状图的长度代表差异物种的影响大小。加工处理后的样品较原料肉样品微生物结构发生显著变化,生肉时期的菌群多为有害菌,在腌制加工后转变为葡萄球菌属等细菌,熏制前期也出现了乳杆菌属,熏制后期的样品中葡萄球菌属等细菌也占据主要地位。
各个发酵时期的真菌演替较明显,菌群结构组成变化较大。在熏制后期的样品中以酵母菌属(Saccharomycetes)和德巴利氏酵母属等为主要菌群,其LDA值最高,说明酵母菌属和德巴利氏酵母属菌种在镇巴腊肉发酵后期至成品时期中起重要作用。
综上结果可以看出,在镇巴腊肉生产发酵过程中菌群演替明显,各时期发挥重要功能的微生物组分变化较大,说明镇巴腊肉发酵过程是多种微生物共同作用的。葡萄球菌属、酵母菌属和德巴利氏酵母属等菌群LDA值较其他菌群高,表明其在镇巴腊肉原料发酵过程中起主要作用。
2.5 镇巴腊肉中微生物的功能相关性分析及预测
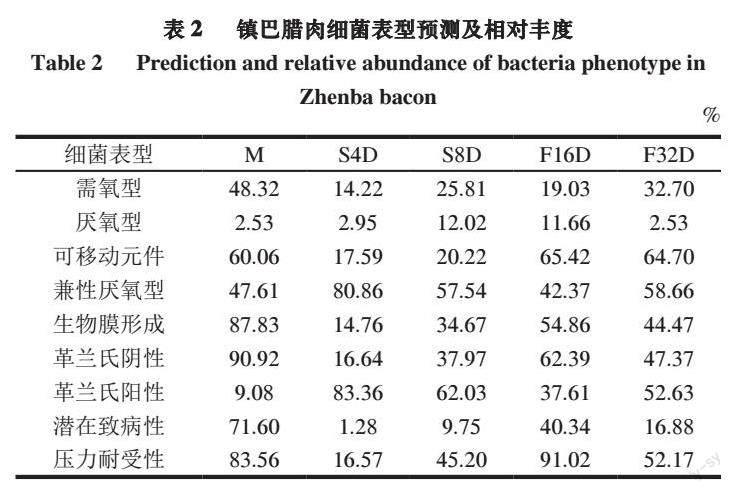
基于OUT水平分类,使用BugBase对组内功能途径的生物水平覆盖表型进行预测,由表2可知,BugBase预测结果表明,腊肉发酵各时期的微生物组成变化显著,其表型也有较大差异。在M组样品中,革兰氏阴性菌占细菌中的主要地位,其相对丰度高达90.92%,厌氧型和兼性厌氧型细菌相对丰度超过50%,并且潜在致病性细菌占比也较大。腌制加工后,S4D和S8D组样品中细菌组成主要为革兰氏阳性菌,相对丰度均在60%以上;相对原料肉样品,腌制后的样品中包含质粒、转座子等可移动基因元件的细菌相对丰度降低至20%左右,潜在致病性细菌含量也降低至10%以内,说明腌制过程可以有效降低潜在致病性细菌的含量。在加工处理末期,熏制完成后革兰氏阳性菌和阴性菌相对丰度基本持平,厌氧型和兼性厌氧型细菌占比相对需氧细菌较高,约为60%,潜在致病性细菌在加工过程中相对丰度有所浮动,在加工末期稳定在16.88%,相较未处理(M组)有所降低,但仍然存在一定程度的风险。
为更进一步探究腊肉发酵各时期细菌的功能,使用PICRUSt2软件,对各时期样品KEGG生物代谢通路进行分析,以观测不同组样品之间微生物群落的功能基因在代謝途径上的差异和变化。由图7可知,腊肉中发酵各阶段的细菌功能主要是参与各类代谢途径,相对丰度最高的代谢途径为全局图和概览图(Global and overview maps),在发酵各时期相对丰度达到40%以上;氨基酸代谢(Amino acid metabolism)和碳水化合物代谢(Carbohydrate metabolism)途径次之,相对丰度在各发酵时期均处于9%和6%以上;能量代谢(Energy metabolism)途径、辅因子及维生素代谢(Metabolism of cofactors and vitamins)途径、核苷酸代谢(Nucleotide metabolism)及脂代谢(Lipid metabolism)途径相对丰度在腊肉发酵各时期均占2%~5%。除此之外,腊肉样品中的细菌功能还集中在膜运输(Membrane transport)、复制与修复(Replication and repair)、信号转导(Signal transduction)、翻译(Translation)等途径。
3 讨 论
镇巴腊肉加工工艺主要为腌制、自然发酵和熏制等环节,过程中影响因素较多,微生物结构也较为复杂。本研究选取加工过程中各时期的镇巴腊肉材料表层组织作为研究对象,通过高通量测序技术对发酵各时期样品进行微生物多样性检测与分析。从OUT层面,对比文开勇等[7]研究的四川腊肉中细菌微生物丰度高于真菌这一特性,镇巴腊肉中细菌OTUs数量显著低于真菌OTUs数量,发酵各时期的OTUs数量也有较显著差异,细菌丰度显著低于真菌丰度。腌制中期和熏制中期样品分别为真菌丰度和细菌丰度最高,这2 个过程是加工工艺转变的关键期,因此微生物群落组成受加工工艺变化影响,微生物群落组成变化较大。在发酵过程中,镇巴腊肉的微生物组成有明显的演替现象,先前研究[4,6]也表明,陇西腊肉和徽派腊肉均在发酵过程中有菌落演替现象,且不仅优势菌群,非优势菌群同样具有演替现象,说明加工工艺对腊肉中微生物组成影响较大,是腊肉生产过程微生物群落演替的主要驱动力。
镇巴腊肉中细菌的主要组成部分是变形菌门和厚壁菌门,这2 种细菌广泛存在于陇西腊肉[4]、四川腊肉[7]、新疆传统风干肉[12]及恩施腊肉[13]等我国各地腌腊肉制品中,在其他种类的发酵肉制品中,如干腌草鱼[14]、即食鸡肉[15]、骆驼肉香肠[16]和贵州传统酸酢肉[17]中,变形菌门和厚壁菌门同样是优势菌门,这2 类细菌广泛存在于各类发酵肉制品中,不受原料和工艺限制。另有研究[15]表明,变形菌门细菌丰度会随低温处理时间延长而下降,镇巴腊肉表层组织的变形菌门丰度在低温腌制时下降,随后在高温熏制过程中,其丰度又有所回升。镇巴腊肉中的主要细菌属为葡萄球菌,葡萄球菌是参与脂肪代谢的重要细菌[18],主要参与不饱和脂肪酸的代谢,调控发酵过程中脂肪氧化[4]。同时具有较强的蛋白酶活性,分解蛋白质产生特定芳香类物质和多肽[19],优化腊肉口味并抑制不良风味,不仅是诸多腌腊肉类产品加工生产发酵过程中重要的微生物发酵剂[3,12,20],还是肉制品发酵过程中重要的风味菌[14,21-22]。
真菌部分主要的优势菌门为子囊菌门,优势菌属多为酵母菌属、镰刀菌属和被孢霉属。酵母菌由于其发酵特性,广泛存在于各种发酵产品中,是发酵肉制品中常见的菌种。酵母菌可以降解腊肉中的脂肪和蛋白质,产生醇类化合物,与乳酸菌发酵产生的酸结合产生酯类化合物,进一步丰富腊肉的风味和色泽[5]。部分酵母菌可以在高浓度盐和高pH值环境中发酵[1],有利于优化腊肉的发酵环境,减少杂菌干扰,降低腊肉制品的酸度。被孢霉属真菌具有产多聚不饱和脂肪酸和转化有机化合物的能力[23-24],且霉菌同样是发酵肉制品中的常见真菌,有研究表明,部分霉菌可以产生脂肪酶,可作为外源发酵剂用于发酵,改善肉制品质构,加速腊肉脂肪的分解,增加风味物质前体的积累[25-26];抑菌隔氧,防止肉制品的腐败[27]。需要注意的是,这类微生物并非全都无害,部分霉菌会产生具有毒性的次生代谢物,主要由曲霉属、镰刀菌属、青霉属等真菌产生[28],镰刀菌属是动物饲料生产过程中最常见的污染真菌之一,并且广泛存在于食品和饲料生产的发酵等加工过程中[29],是生产过程中难以避免的问题之一。
镇巴腊肉在发酵过程中微生物结构变化受工艺影响,微生物功能主要集中在代谢方面,氨基酸、碳水化合物、脂类等物质代谢是腊肉发酵过程主要的挥发性前体物质和风味物质的主要来源。并且腊肉发酵过程中厌氧型和兼性厌氧型微生物相对丰度高于需氧型微生物,这为腊肉发酵环境优化提供了良好的基础。本研究发现未处理的原料肉表面组织存在较多的潜在致病微生物,如大肠-志贺氏菌属,这类细菌是一种常见的食源性致病菌[30]。由于生肉未经处理,在放置和运输过程中接触空气、水体等,很多环境中的细菌易附着在生肉表层,在经过清洗、腌制等处理后,潜在致病性菌种相对丰度也有所降低,同时在后续加工及包装环节配合一定的灭菌工艺来降低镇巴腊肉的风险性,延长镇巴腊肉的货架期。
4 结 论
本研以镇巴腊肉不同加工时期的材料为研究对象,通过高通量测序分析不同加工时期样品中微生物的16S V3~V4區序列和ITS序列,共检测到414 个细菌OTUs和1 974 个真菌OTUs。研究发现,镇巴腊肉生产过程中微生物群落组成变化较大,优势细菌门为变形菌门和厚壁菌门,优势细菌属由原料肉样品中的大肠-志贺氏菌属逐渐演替为腌制时期的葡萄球菌属、嗜冷杆菌属,以及熏制时期的乳杆菌属;优势真菌门为子囊菌门和担子菌门,优势真菌属也由镰刀菌属和被孢霉属演替为镰刀菌属和德巴利氏酵母菌属。同时发现,镇巴腊肉生产过程中的微生物主要为厌氧型和兼性厌氧型细菌,其功能主要集中在氨基酸、碳水化合物等能量物质代谢途径,这些功能有助于镇巴腊肉的风味物质形成,为解析其风味物质组成提供参考。
参考文献:
[1] 张秋会, 王晗, 祝超智, 等. 自然发酵腊肉中酵母菌的分离鉴定及其发酵特性研究[J]. 食品与发酵工业, 2022, 48(14): 113-117. DOI:10.13995/j.cnki.11-1802/ts.029561.
[2] 张根生, 潘雷, 岳晓霞, 等. 发酵肉制品加工过程中风味物质形成和影响因素研究进展[J]. 中国调味品, 2022, 47(1): 200-205. DOI:10.3969/j.issn.1000-9973.2022.01.039.
[3] 吴宝森, 孙玥晖, 刘姝韵, 等. 发酵肉制品中脂肪、蛋白质水解氧化与微生物的关系[J]. 食品安全质量检测学报, 2017, 8(3): 832-837. DOI:10.19812/j.cnki.jfsq11-5956/ts.2017.03.020.
[4] 李彦虎, 贠建民, 赵风云, 等. 陇西腊肉传统制作过程中细菌群落演替对脂肪水解及氧化的影响[J]. 食品科学, 2021, 42(10): 154-161. DOI:10.7506/spkx1002-6630-20200219-198.
[5] 葛芮瑄, 罗玉龙, 剧柠. 传统发酵肉制品中微生物菌群对风味形成的研究进展[J]. 微生物学通报, 2022, 49(6): 2295-2307. DOI:10.13344/j.microbiol.china.210563.
[6] 周莹, 王兆明, 涂健, 等. 基于16S rRNA的徽派腊肉加工过程中微生物群落结构分析[J]. 肉类研究, 2021, 35(3): 1-7. DOI:10.7506/rlyj1001-8123-20201215-289.
[7] 文开勇, 汪月, 文鹏程, 等. 四川传统腊肉中微生物群落结构研究[J]. 食品与发酵工业, 2020, 46(3): 36-42. DOI:10.13995/j.cnki.11-1802/ts.022133.
[8] XI Linjie, ZHANG Jing, WU Ruixiao, et al. Characterization of the volatile compounds of Zhenba bacon at different process stages using GC-MS and GC-IMS[J]. Foods, 2021, 10(11) 2869. DOI:10.3390/foods10112869.
[9] 朱联旭, 李崇勇, 孟怡璠, 等. 基于气相色谱-离子迁移谱分析镇巴腊肉贮藏过程中挥发性风味成分变化[J]. 食品安全质量检测学报, 2022, 13(15): 4832-4839. DOI:10.19812/j.cnki.jfsq11-5956/ts.2022.15.047.
[10] 翟盼盼, 吴宇骞, 陆坚. 不动杆菌属分类的研究进展[J]. 新发传染病电子杂志, 2020, 5(1): 51-55; 59. DOI:10.19871/j.cnki.xfcrbzz.2020.01.012.
[11] 王闻卿, 苏靖华, 傅慧琴, 等. 食源性气单胞菌属种水平监测和表型特征研究[J]. 中国食品卫生杂志, 2014, 26(1): 1-5. DOI:10.13590/j.cjfh.2014.01.008.
[12] 王俊钢, 李宇辉, 刘成江, 等. 新疆哈萨克族传统风干肉中细菌多样性分析及安全评价[J]. 中国食品学报, 2021, 21(11): 209-218. DOI:10.16429/j.1009-7848.2021.11.023.
[13] 董蕴, 王玉荣, 王尧, 等. 基于变性梯度凝胶电泳和MiSeq高通量测序技术分析恩施地区腊肉的细菌多样性[J]. 肉类研究, 2018, 32(10): 37-42. DOI:10.7506/rlyj1001-8123-201810007.
[14] ZHAO Dandan, HU Jun, CHEN Wenxuan. Analysis of the relationship between microorganisms and flavour development in dry-cured grass carp by high-throughput sequencing, volatile flavour analysis and metabolomics[J]. Food Chemistry, 2022, 368: 130889. DOI:10.1016/j.foodchem.2021.130889.
[15] QIU Mengjia, XIAO Xingning, XIAO Yingping, et al. Dynamic changes of bacterial communities and microbial association networks in ready-to-eat chicken meat during storage[J]. Foods, 2022, 11(22): 3733. DOI:10.3390/foods11223733.
[16] FONTANA C, BASSI D, LOPEZ C, et al. Microbial ecology involved in the ripening of naturally fermented llama meat sausages: a focus on lactobacilli diversity[J]. International Journal of Food Microbiology, 2016, 236: 17-25. DOI:10.1016/j.ijfoodmicro.2016.07.002.
[17] WANG Hanyu, SU Wei, MU Yingchun, et al. Correlation between microbial diversity and volatile flavor compounds of Suan zuo rou, a fermented meat product from Guizhou, China[J]. Frontiers in Microbiology, 2021, 12: 736525. DOI:10.3389/fmicb.2021.736525.
[18] BERDAGUE J L, MONTEIL P, MONTEL M C, et al. Effects of starter cultures on the formation of flavour compounds in dry sausage[J]. Meat Science, 1993, 35(3): 275-287. DOI:10.1016/0309-1740(93)90033-E.
[19] HU Yingying, ZHANG Lang, LIU Qian, et al. The potential correlation between bacterial diversity and the characteristic volatile flavour of traditional dry sausages from Northeast China[J]. Food Microbiology, 2020, 91: 103505. DOI:10.1016/j.fm.2020.103505.
[20] 熊力, 易浪波, 粟桂蓉, 等. 基于宏基因組学分析湘西腊肉的细菌多样性[J]. 中国微生态学杂志, 2022, 34(1): 23-28. DOI:10.13381/j.cnki.cjm.202201005.
[21] 赵改名, 李珊珊, 崔文明, 等. 不同来源腊肉中细菌菌群结构与风味相关性分析[J]. 食品与发酵工业, 2021, 47(13): 246-253. DOI:10.13995/j.cnki.11-1802/ts.026439.
[22] LUO Yulong, ZHAO Lihua, XU Junqiang, et al. Effect of fermentation and postcooking procedure on quality parameters and volatile compounds of beef jerky[J]. Food Science and Nutrition, 2020, 8(5): 2316-2326. DOI:10.1002/fsn3.1515.
[23] WAGNER L, STIELOW B, HOFFMANN K, et al. A comprehensive molecular phylogeny of the Mortierellales (Mortierellomycotina) based on nuclear ribosomal DNA[J]. Persoonia, 2013, 30: 77-93. DOI:10.3767/003158513X666268.
[24] ZHANG Huidan, CUI Qiu, SONG Xiaojin. Research advances on arachidonic acid production by fermentation and genetic modification of Mortierella alpina[J]. World Journal of Microbiology and Biotechnology, 2021, 37(1): 4. DOI:10.1007/s11274-020-02984-2.
[25] 于華, 黄丹, 陈卓, 等. 四川腊肉中产脂肪酶霉菌筛选及产酶条件研究[J]. 中国食品添加剂, 2016(12): 78-83. DOI:10.3969/j.issn.1006-2513.2016.12.005.
[26] PIZZOLATO MONTANHA F, ANATER A, BURCHARD J F, et al. Mycotoxins in dry-cured meats: a review[J]. Food and chemical Toxicology, 2018, 111: 494-502. DOI:10.1016/j.fct.2017.12.008.
[27] 蔡嘉铭, 王际辉, 陶冶, 等. 霉菌发酵剂对干发酵香肠的理化指标、氧化程度及风味的影响[J]. 食品与发酵工业, 2020, 46(5): 17-22. DOI:10.13995/j.cnki.11-1802/ts.022880.
[28] HAQUE M A, WANG Yihui, SHEN Zhiqiang, et al. Mycotoxin contamination and control strategy in human, domestic animal and poultry: a review[J]. Microbial Pathogenesis, 2020, 142: 104095. DOI:10.1016/j.micpath.2020.104095.
[29] 肖柯, 张霖, 朱寒剑, 等. 乳酸菌对真菌毒素的减毒研究进展[J]. 食品科学, 2022, 43(15): 283-293. DOI:10.7506/spkx1002-6630-20210603-042.
[30] 卢鑫, 王立娟, 郭威, 等. 食品中志贺氏菌检测技术研究进展[J]. 食品工业科技, 2022, 43(1): 410-416. DOI:10.13386/j.issn1002-0306.2020100045.

