Sigma-1受体介导的视网膜神经保护作用研究进展
马啸辰 综述 刘红玲 审校
哈尔滨医科大学第一附属医院眼科医院,哈尔滨 150000
视网膜神经细胞的胞体及其突起组成复杂神经网络,维持视觉功能。眼底疾病常伴有神经元细胞的永久性、不可逆损伤。如何提高视网膜神经细胞的抗损伤能力,是我们亟需解决的问题。Sigma-1受体是一种多功能的分子伴侣,存在于内质网膜和内质网相关线粒体膜中,并广泛分布于各种组织和器官中,对多种神经退行性疾病具有保护作用。本文就Sigma-1受体介导的视网膜神经保护作用予以综述,旨在探寻治疗视网膜疾病的新靶点。
1 Sigma-1受体结构和功能
Sigma-1受体是一种膜受体蛋白,与真菌来源的C-8,7甾醇异构酶具有很强的同源性,但与已知的哺乳动物蛋白没有明显的同源性[1]。Sigma-1受体存在于多种组织和器官中,例如角膜、虹膜、睫状体、晶状体、视网膜、脑、肝脏、肺脏以及心脏等[2]。Sigma-1受体基因序列在整个哺乳动物中高度保守。Sigma-1受体蛋白由223个氨基酸构成,带有2个跨膜螺旋和1个疏水性C端区域,形成1个配体结合袋[3]。根据结合位点和分子量可将Sigma受体分为2种亚型,其中Sigma-1序列已被确定,主要分布于内质网膜、线粒体膜、质膜以及核膜,激活时也会游离到胞质中[4-6];Sigma-2的结构目前仍然未知[7-8]。Sigma-1受体激动剂包括喷他佐辛(pentazocine,(+)-PTZ)、SA4503、PRE-084、孕烯醇酮和双脱氢表雄酮等,其拮抗剂包括NE-100、BD1047和BD1063等。此外,Sigma-1受体还可结合多种天然存在的物质,如N,N-二甲基色胺、鞘氨醇、胆固醇和前列腺素等,发挥不同的作用并调节多种细胞功能[9-10]。
在中枢神经系统中,Sigma-1受体已被证实对神经递质释放、突触功能调节,学习记忆过程具有重要作用,是治疗神经系统退行性疾病,如亨廷顿病、帕金森病、阿尔茨海默病、肌萎缩性侧索硬化症等的重要靶点[11]。在视网膜中,Sigma-1受体与感光细胞的功能密切相关[12]。还有研究表明,Sigma-1受体拮抗剂NE-100通过调控视网膜中多巴胺的含量,进而抑制形觉剥夺性近视的形成[13]。在多数视网膜细胞中均可检测到Sigma-1受体的表达[14-15],由于视网膜在结构上可视为中枢神经系统的延伸,故推测二者可能具有相似的病理生理学机制。为了进一步明确Sigma-1受体的保护作用,研究者在分子层面对其进行了大量的实验研究。
2 Sigma-1受体对视网膜的保护作用及其分子机制
作为一种新型分子伴侣,Sigma-1受体通过与离子通道、膜受体、激酶甚至RNA相互作用,进而调节多种细胞功能,发挥着视网膜保护作用(图1)。
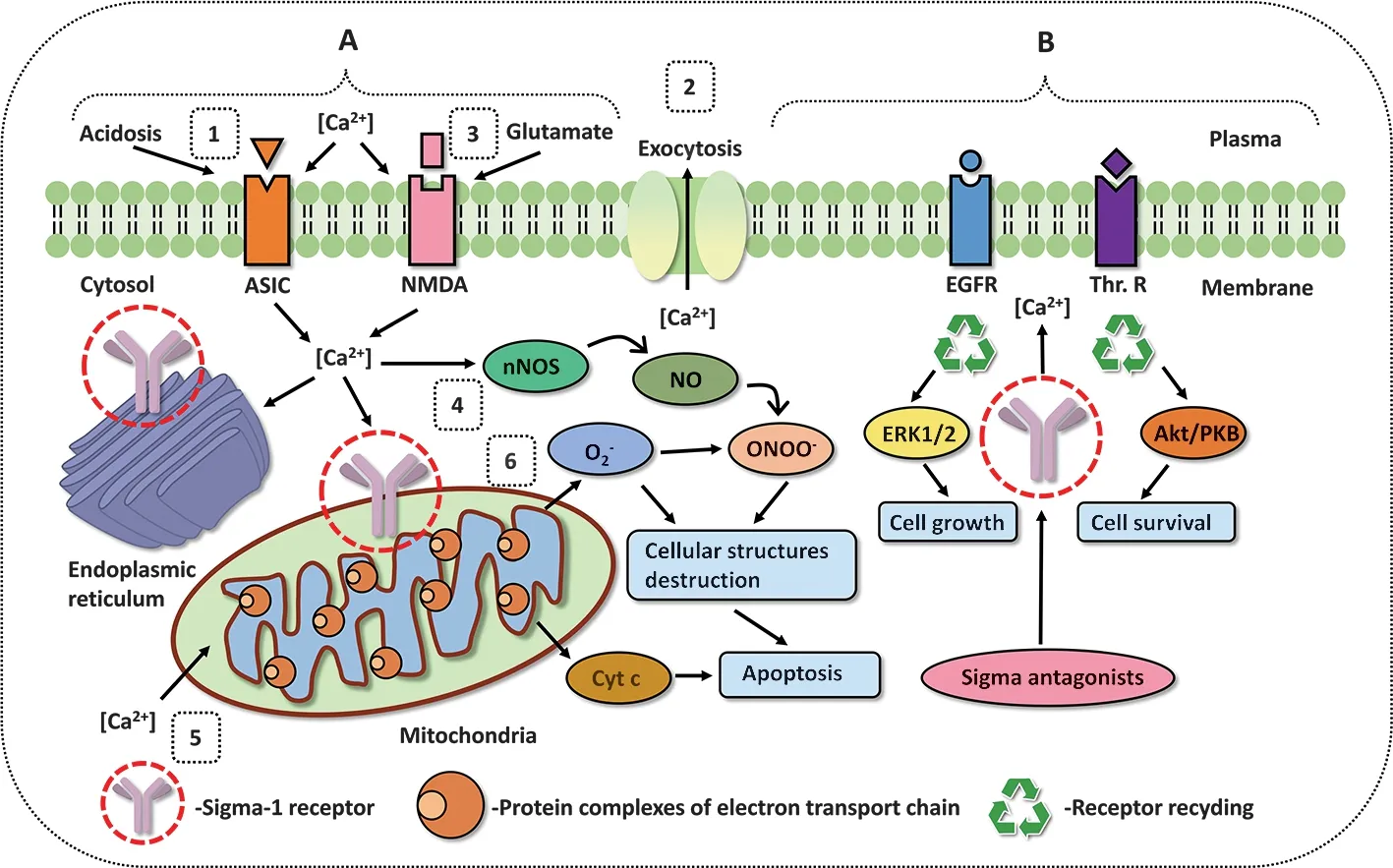
图1 Sigma-1受体发挥作用的相关分子机制[15] A:缺血-再灌注损伤 B:Sigma-1受体参与细胞膜上表皮生长因子受体、Thromb受体再循环过程,进而调控ERK1/2和Akt/PKB信号通路 1.酸中毒导致细胞内Ca2+超载;2.谷氨酸通过胞吐作用释放;3.谷氨酸与NMDA受体结合,引起Ca2+的流入;4.Ca2+激活神经元型一氧化氮合酶;5.Ca2+经过VDAC通路进入线粒体;6.Ca2+水平升高导致氧化呼吸链中ROS和Cyt c的释放 ASIC:酸敏感离子通道;NMDA:N-甲基-D-天冬氨酸受体;EGFR:表皮生长因子受体;Thr.R:thromb受体;ERK:细胞外调节蛋白激酶;Akt:蛋白激酶;nNOS:神经元型一氧化氮合酶;NO:一氧化氮
2.1 抗氧化应激作用
细胞氧化还原过程中会产生活性氧簇(reactive oxygen species,ROS),体内的抗氧化剂分子与ROS相互作用,以维持氧化应激的平衡。氧化应激失调将导致视网膜疾病的发生[16]。Sigma-1受体可调节氧化应激的水平和抗氧化相关蛋白的表达,进而发挥保护作用。在视网膜神经节细胞和661W细胞系中,Sigma-1受体激动剂(+)-PTZ可降低氧化应激相关蛋白的表达,包括蛋白激酶R样内质网激酶、肌醇需酶-1、转录激活因子-6和C/EBP同源蛋白[17]。同时,Sigma-1受体的激活可提高抗氧化相关基因的表达,包括核因子E2相关因子2、过氧化氢酶(catalase,CAT)、醌氧化还原酶-1(quinone oxidoreductase-1,NQo-1)和血红素氧合酶(hemeoxygenase,HO)[18]。Sigma-1受体在内质网膜上充当分子伴侣辅助蛋白质折叠,抑制未折叠蛋白质反应[19]。敲除Sigma-1受体基因后,小鼠视网膜Müller细胞中ROS水平升高,抗氧化基因如铜锌超氧化物歧化酶、CAT、NQo-1、HO、谷胱甘肽S转移酶和谷胱甘肽过氧化物酶表达下降[7]。在大鼠视网膜小胶质细胞中,Sigma-1受体激动剂(+)-PTZ抑制脂多糖诱导的细胞内ROS水平升高,延缓了一氧化氮(NO)的释放[20]。在大鼠视网膜神经节细胞中,Sigma-1受体激活后可阻断酸感应离子通道和N-甲基-D-天门冬氨酸受体通路,减少Ca2+的内流,进一步降低胞质内NO和ROS水平[21]。
2.2 抗炎作用
炎症反应是视网膜疾病发病的关键因素,胶质神经细胞是视网膜中分泌炎性细胞因子的重要细胞类群[22]。在视网膜Müller细胞中,激活Sigma-1受体可阻断特异性促炎因子的分泌[23],包括巨噬细胞炎症蛋白-1γ(macrophage inflammatory protein-1γ,MIP-1γ)、MIP-2、MIP-3α和白细胞介素-12(interlukin-12,IL-12)。另一项研究表明,Sigma-1受体激动剂(+)-PTZ可显著抑制视网膜小胶质细胞的形态变化,减少了脂多糖诱导的炎性细胞因子和趋化因子的释放,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-10和单核细胞趋化蛋白-1[20]。同时,Sigma-1受体激动剂(+)-PTZ降低了c-Jun氨基末端酶和细胞外调节蛋白激酶的磷酸化,这两者都与炎症反应密切相关。炎症引起的缺血缺氧可导致细胞内外水分积聚,引起细胞毒性肿胀。Sigma-1受体激动剂PRE-084可抑制大鼠视网膜Müller细胞渗透性肿胀,其机制可能为Sigma-1受体调节离子通道,后续的离子外流一定程度上平衡了细胞内外的渗透压力梯度[24]。因此,抗炎是Sigma-1受体的一个重要生物学功能。
2.3 抗凋亡作用
视网膜变性疾病与凋亡密切相关。在病理条件下,视网膜细胞会发生程序性凋亡,以减轻炎症反应[25],过度的凋亡则会加剧病情进展。Sigma-1受体激动剂盐酸角质碱可减轻光照导致的小鼠视网膜感光细胞损伤,稳定感光细胞层的整体结构,降低细胞凋亡过程中关键效应蛋白酶Caspase3/7的活性[26]。在Aβ肽诱导的大鼠视网膜病变模型中,Sigma-1受体激动剂PRE-084通过调控凋亡相关的细胞因子以及凋亡蛋白Bax的表达,从而发挥神经保护作用[27]。Ha等[28]发现,Sigma-1受体基因敲除模型小鼠12月龄时的视网膜电图b波振幅和暗视阈反应显著降低。Ha等[29]还发现Sigma-1受体基因敲除小鼠视网膜中Bcl-2 mRNA水平在6周龄时开始下降,24周龄和52周龄时Bcl-2蛋白表达下降更为明显。转录组测序结果表明,Sigma-1受体激动剂(+)-PTZ可降低Ins2Akita/+糖尿病小鼠促凋亡基因的表达,例如CASP8/FADD样凋亡调节因子和丝氨酸苏氨酸激酶-3,并增加抗凋亡基因真核翻译延长因子-1的表达,从而发挥抗凋亡作用[17]。
Sigma-1受体可对神经系统发挥保护作用,且其作用的分子机制十分复杂。Sigma-1受体基因敲除可引发各种病理变化。然而,疾病是一个系统性过程,研究者通过构建疾病动物模型来探究Sigma-1受体在实际疾病中的作用。
3 Sigma-1受体在视网膜疾病治疗中的应用前景
3.1 糖尿病视网膜病变
在Ins2Akita/+糖尿病视网膜病变小鼠模型中,腹腔注射Sigma-1受体激动剂(+)-PTZ可维持视网膜结构的完整性和各层的厚度,减轻神经节细胞的丢失;视网膜中ROS和活性氮的含量也相应减少,从而延缓了糖尿病视网膜病变引起的视网膜形态结构改变[30-31]。Sigma-1受体敲除后,糖尿病小鼠视网膜中神经节细胞凋亡增加,显示了Sigma-1受体在视网膜中具有潜在的保护作用[32]。
3.2 视网膜色素变性
研究表明,经Sigma-1受体激动剂(+)-PTZ处理后,视网膜色素变性(rd10)模型小鼠的视网膜电图明显改善,视锥和视杆细胞的功能得到了恢复,视锥细胞丢失减少,视网膜厚度更接近野生型小鼠[33-34]。相反,Sigma-1受体敲除后,其对rd10小鼠视网膜的保护作用被逆转[35]。
3.3 青光眼
Sun等[36]应用巩膜表层静脉烧烙法构建慢性高眼压小鼠模型,发现小鼠视网膜中Sigma-1受体表达在第1周时下降,在负反馈调节的作用下于第8周时升高;该研究还发现Sigma-1受体激动剂孕烯醇酮可显著降低小鼠眼压,上调小鼠视网膜中Sigma-1受体的表达,提高视网膜神经节细胞的存活率,延缓神经节细胞的死亡,维持视网膜内丛状层的厚度。另一项研究发现,Sigma-1受体敲除后,小鼠的眼压升高,表明Sigma-1受体对眼压具有经常性调节作用[32]。
4 总结与展望
Sigma-1受体在眼科具有广阔的应用前景,可通过抗氧化应激、抗炎症反应、抗细胞凋亡等途径对糖尿病视网膜病变、视网膜色素变性、青光眼视神经退行性病变等起保护作用。以往的研究主要关注其在大脑和神经系统退行性疾病中的作用,而其在眼部的作用机制值得进一步深入研究,以期寻找治疗视网膜疾病的新靶点。未来的研究还可应视网膜疾病以外的其他眼球部位延伸,以期推动Sigma-1受体相关眼科药物的临床转化。
利益冲突所有作者均声明不存利益冲突

