基于生物信息学探讨祖卡木颗粒对急性肺损伤的保护机制
李亚楠,李丝雨,刘国秀,李易轩,季志红 ,李柯翱 ,于静 ,王燕平 ,翟华强,,王永炎
1.北京中医药大学中药学院,北京 102488;2.北京中医药大学中药调剂标准化研究中心,北京 102488;3.新奇康药业股份有限公司,新疆 乌鲁木齐 830011;4.新疆医科大学维吾尔医学院,新疆 乌鲁木齐 830011;5.中国中医科学院中医临床基础医学研究所,北京 100700
祖卡木颗粒收载于《中华人民共和国卫生部药品标准·维吾尔药分册》,是《国家基本药物目录(2018版)》《国家急(抢)救药品直接挂网采购示范药品目录》收录的维药重点品种,发展历史悠久,临床疗效优良,临床价值突出[1]。祖卡木颗粒对上呼吸道感染疗效良好,且被新疆维吾尔自治区卫生健康委员会列为治疗新型冠状病毒肺炎(COVID-19)的推荐方药[2]。在COVID-19发生过程中,新型冠状病毒感染会引起机体肺部免疫细胞的过度激活,导致急性肺损伤(acute lung injury,ALI)[3]。ALI发病率和病死率高、预后差,给全球公共卫生事业带来巨大挑战[4]。前期研究表明,祖卡木颗粒对肺损伤具有抗炎和免疫调节作用,其作用机制可能与TLR4/MyD88/NF-κB 信号通路[5]及调节Th1/Th2平衡有关[6]。
目前,系统生物信息学已成为一种成熟的方法用于在分子水平上系统揭示中药复方治疗疾病的物质基础和药效机制研究。网络药理学构建了多组分和多靶点模型,能够更好地阐明疾病和药物相关的基因、蛋白质和代谢物之间的复杂相互作用,十分适合研究中药的复杂作用机制[7]。GEO数据库具有真实临床样本的基因芯片数据,可通过筛选正常组和疾病组的差异表达基因(DEGs)反映疾病分子生物学特征[8]。本研究联合网络药理学和GEO数据芯片,预测祖卡木颗粒治疗ALI的主要生物活性化合物、潜在靶点和信号通路,揭示其可能的分子作用机制,并通过动物体内实验进行初步验证,旨在阐释祖卡木颗粒治疗ALI可能的作用机制。
1 材料与方法
1.1 祖卡木颗粒化学成分及作用靶点获取
通过TCMSP (https://old.tcmsp-e.com/tcmsp.php)[9]查询祖卡木颗粒中6味组方药物薄荷、甘草、罂粟壳、大枣、山柰、大黄的化学成分,并以口服生物利用度(OB)≥30%且类药性(DL)≥0.18为条件进行成分筛选。对于TCMSP数据库未收录的4味药物睡莲花、破布木果、蜀葵子、洋甘菊,通过中国知网(CNKI)、万方数据知识服务平台、PubMed数据库检索其化学成分,并以CAS号或标准化学名称于TCMSP数据库中检索,收集并整理其基本化学信息。通过TCMSP 和SwissTargetPrediction 平台(http://www.swisstargetprediction.ch/)预测祖卡木颗粒活性成分的靶点信息,汇总所有靶点信息,使用UniProt数据库(https://www.uniprot.org/)uqf 靶点蛋白信息转化为标准基因名,设置靶点种属来源为“Homo Sapiens”(人类),获得祖卡木颗粒的作用靶点。
1.2 急性肺损伤相关靶点获取
通过GeneCards(https://www.genecards.org/)和OMIM(https://omim.org/)数据库检索“Acute lung injury”,并以相关性评分(relevance score)取3倍中位数为筛选条件选取GeneCards数据库获得的靶点,对2个数据库得到的靶点进行合并、去重后得到ALI的疾病靶点。
1.3 GEO芯片数据分析急性肺损伤差异表达基因
在GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)以“Acute lung injury”为关键词搜索,选择种属为“Homo Sapiens”(人类),下载编号为GSE10474[10]、GSE2322[11]、GSE3037[12]的芯片数据,以获得ALI和正常样本的mRNA表达谱。利用GEO2R在线分析平台进行数据集的差异分析,并以|logFC|>1、P<0.05为条件筛选DEGs,对3个数据集的DEGs进行合并和去重,获得ALI 的DEGs。使用Sangerbox3.0(http://vip.sangerbox.com/login.html)的生信绘制工具包绘制DEGs火山图和热图。
1.4 祖卡木颗粒治疗急性肺损伤关键靶点获取
运用jvenn 在线工具(http://www.bioinformatics.com.cn/static/others/jvenn/example.html)对祖卡木颗粒的潜在作用靶点与ALI相关靶点和显著差异基因同时取交集,三者的交集基因即为祖卡木颗粒治疗ALI的关键靶点。
1.5 关键靶点蛋白相互作用网络分析
使用STRING(https://cn.string-db.org/)数据库对关键靶点进行分析,将Organism(种属)设为“Homo Sapiens”(人类),置信度设置为0.4,下载蛋白相互作用(PPI)网络的TSV 文件,并利用Cytoscape3.7.2软件绘制PPI网络图。通过MCODE插件进行模块分析,高级选项设置为节点评分cutoff=0.2、程度cutoff=2、K-core=2,最大深度=100。利用CytoHubba插件选取PPI网络中最大团中心度(MCC)排序前10位节点作为核心靶点。
1.6 GO与KEGG通路富集分析
通过DAVID 数据库(https://david.ncifcrf.gov/)对关键靶点进行富集分析,设置筛选条件为P<0.05,分别选取生物过程(BP)、分子功能(MF)、细胞组成(CC)中P值排名前10 位条目及P值排名前20 位KEGG信号通路,利用微生信网站进行可视化分析。
1.7 中药-活性成分-关键靶点-疾病网络和靶点-通路网络构建
利用Cytoscape3.7.2软件构建中药-活性成分-关键靶点-疾病网络和关键靶点-通路网络,并计算每个节点(成分、靶点、通路)的度值。
1.8 实验验证
1.8.1 动物
SPF级SD雄性大鼠42只,体质量180~200 g,购自北京斯贝福实验动物技术有限公司,动物生产许可证号SYXK(京)2020-0033。饲养于北京中医药大学动物饲养中心恒温(24~26 ℃)、恒湿(30%~40%)环境,自由摄食饮水,适应性饲养1周后进行实验。动物实验已通过北京中医药大学动物伦理委员会批准(BUCM-4-2022011901-1098)。
1.8.2 仪器与试药
WZ-0C6微量注射泵(浙江史密斯医学仪器有限公司),SorvallST8R高速冷冻离心机(赛默飞世尔科技有限公司),QB-9002 微量快速震荡仪(Kylin-Bell Lab Instruments),EG1160 生物组织包埋机(德国Leica),2720型PCR仪(美国ABI),RM2016病理切片机(德国Leica),system electrophoresis Mupid(Mupid 2plus)电泳槽(日本TaKaRa),vortex mixer(Voltex-Genie2)漩涡混合器(美国SI),Roche LightCycler®480 Ⅱ实时荧光定量PCR 系统(瑞士Roche),倒置光学显微镜(日本Nikon)。
祖卡木颗粒(6 g/袋、无蔗糖,新奇康药业股份有限公司,批号201140),醋酸地塞米松片(0.75 mg×100片,天津天药药业股份有限公司,批号CD200410b01),脂多糖(10 mg/瓶,Sigma,批号20220314),注射用青霉素钠(160万单位/瓶,江西省科达动物药业有限公司,批号20200917),组织细胞固定液(500 mL/瓶,北京百瑞极生物科技有限公司,批号20211213)。
1.8.3 分组及给药
将42只大鼠随机分为造模后6 h组和72 h组,再分别分成4个亚组,即假手术组、模型组、地塞米松组和祖卡木颗粒组,给药组分别予相应药物进行预防性治疗。祖卡木颗粒组予祖卡木颗粒混悬液(温水配制,0.25 g/mL)1.62 g/kg灌胃,地塞米松组予醋酸地塞米松混悬液0.5 mg/kg灌胃,假手术组和模型组均予生理盐水灌胃(4 mL/kg),1次/d,连续5 d。
1.8.4 造模
末次给药1 h后,除假手术组外,其余各组使用微量注射泵以脂多糖(5 mg/kg)气管滴入法复制ALI模型,使药物均匀分布于肺组织。假手术组予等量生理盐水。造模结束后用医用缝合针线缝合好伤口后,使用75%医用酒精进行消毒并腹腔注射青霉素钠以防止感染。
1.8.5 取材
分别于造模后6、72 h进行取材。使用1%戊巴比妥钠(30 mg/kg)将大鼠麻醉后通过腹主动脉取血的方式处死。摘取大鼠肺脏,用生理盐水洗净表层血迹并用滤纸吸干表层液体,于4%多聚甲醛固定液中固定右肺中叶,其余叶片于液氮中急冻后转存于-80 ℃备用。
1.8.6 HE染色观察与评价
肺组织样本固定24 h后制作HE染色切片,于显微镜下镜检并拍照。参照2011年美国胸科学会病理评分方法[13]对肺组织损伤进行评分,评估指标包括肺泡壁塌陷、肺泡间隔增厚、肺间质水肿、炎性细胞浸润和出血,按病变程度轻重分别计0~4分,计算总分。
1.8.7 RT-qPCR检测
取存于-80 ℃肺组织,用Trizol提取样品RNA,反转录为cDNA,RT-qPCR 分别检测造模后6 h 肺组织CD14 mRNA表达和造模后72 h肺组织CD80、CD86 mRNA表达。引物由北京天一辉远生物科技有限公司提供,引物序列见表1。

表1 各基因引物序列
1.8.8 统计学方法
使用GraphPad Prism 7软件进行分析。计量资料用-±s表示,符合正态分布样本组间比较采用方差分析,并进行方差齐性检验。P<0.05表示差异有统计学意义。
2 结果
2.1 祖卡木颗粒活性成分及其靶点
通过TCMSP获取薄荷、甘草、罂粟壳、大枣、山柰、大黄6味药物化学成分信息,筛选得到各药物活性成分,分别为薄荷10个、甘草92个、罂粟壳11个、大枣29个、山柰2个、大黄15个。通过检索已发表文献获取睡莲花、破布木果、蜀葵子、洋甘菊化学成分信息,经过筛选获得活性成分,分别为睡莲花8个、破布木果9个、蜀葵子7个、洋甘菊5个。汇总10味药物的所有活性成分,删除重复成分,共获得祖卡木颗粒活性成分174个。汇总174个成分的作用靶点,删去重复靶点后共得到825个作用靶点,见表2。

表2 祖卡木颗粒药物活性成分和靶点数
2.2 急性肺损伤相关靶点
通过OMIM、GeneCards数据库分别获得ALI靶点354、7 504个,对relevance score取3倍中位数,得到990个靶点,合并、去重后获得1 253个ALI相关基因。
2.3 GEO差异分析与交集分析
利用GE02R 在线工具对数据集进行差异分析,GSE10474数据集共得到DEGs 231个(P<0.05),其中上调基因146个,logFC>1的有4个;下调基因85个,logFC<-1的有8个。GSE3037数据集共获取DEGs 438个(P<0.05),其中上调基因283个,logFC>1的有58个;下调基因155个,logFC<-1的有3个。GSE2322数据集共得到差异基因1 370 个(|logFC|>1、P<0.05),上调基因485个,去重后得到365个;下调基因885个,去重后得到682个。汇总3个数据集的DEGs,去重后获得1 084个。见图1。
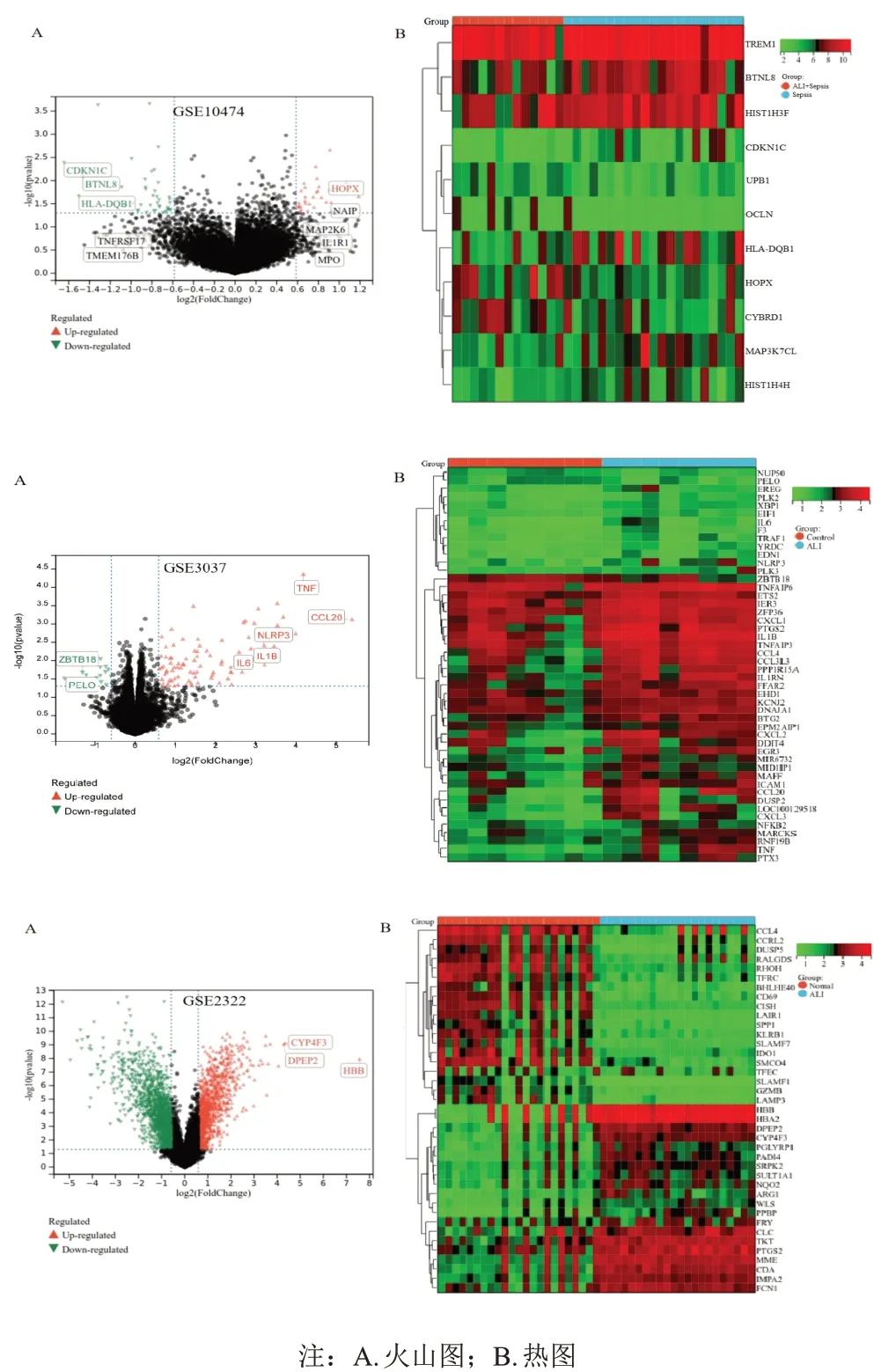
图1 GEO数据库3个数据集差异表达基因
2.4 药物靶点与疾病靶点交集基因
将祖卡木颗粒药物靶点与ALI的疾病靶点、DEGs分别取交集,其中祖卡木颗粒药物靶点与ALI疾病靶点有264个交集,交集靶点与DEGs取交集得到46个表达具有显著差异的基因,作为祖卡木颗粒治疗ALI关键靶点,韦恩图见图2。关键靶点的表达信息见表3,显著上调和下调的基因各23个。

图2 祖卡木颗粒药物靶点-ALI靶点差异基因韦恩图
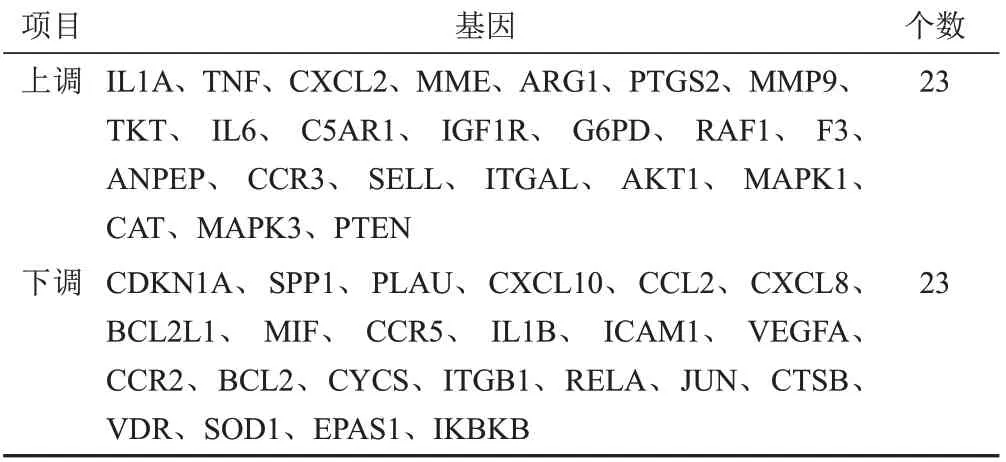
表3 祖卡木颗粒治疗ALI关键靶点差异表达信息
2.5 关键靶点蛋白相互作用网络
关键靶点PPI 网络(见图3A)包含46 个靶点和487条边。根据CytoHubba(MCC算法)筛选前10位靶点作为核心靶点(见图3B),得出该网络核心蛋白质。根据MCODE模块分析得到2个模块(见图4)。模块1包含26个靶点,得分为13.52分;模块2包含11个靶点,得分为9分。

图3 祖卡木颗粒治疗ALI关键靶点PPI网络与核心靶点

图4 祖卡木颗粒治疗ALI关键靶点MCODE模块分析
2.6 GO和KEGG通路富集分析结果
关键靶点GO富集分析得到394个条目,其中BP条目327个,涉及炎症反应、信号转导、RNA聚合酶Ⅱ启动子转录的正调控、基因表达的正调控、凋亡、细胞对脂多糖的反应等;CC条目30个,与细胞质、质膜、细胞外隙等有关;MF条目37个,与蛋白质结合、金属离子结合相关。P值前10位条目见图5。
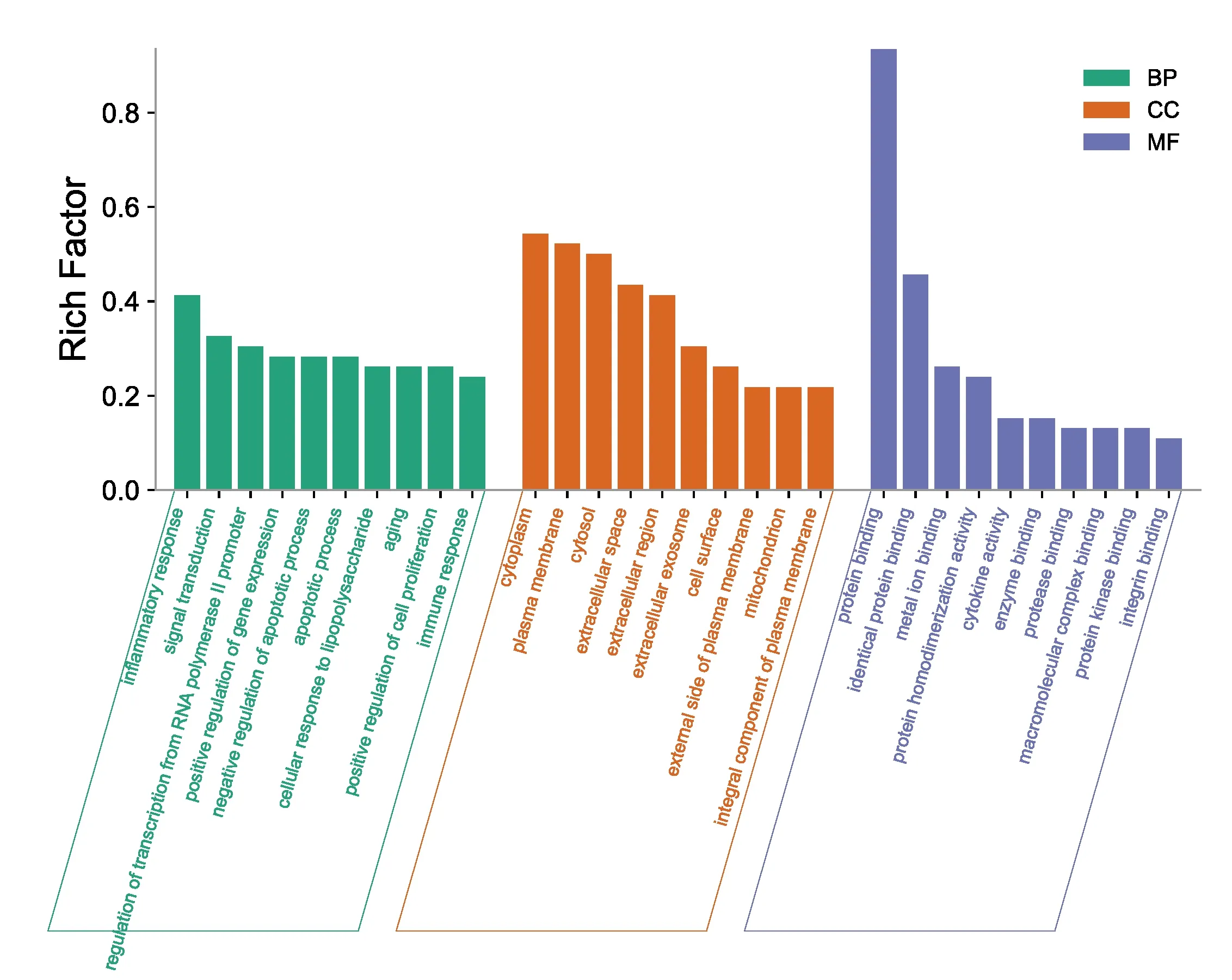
图5 祖卡木颗粒治疗ALI关键靶点GO富集分析
关键靶点KEGG通路富集分析得到137条信号通路(P<0.05),包括晚期糖基化产物-晚期糖基化终末产物受体(AGE-RAGE)、肿瘤坏死因子(TNF)、白细胞介素(IL)-17、Toll样受体、NOD样受体等信号通路,P值前20位信号通路见图6。祖卡木颗粒治疗ALI的机制可能与上述信号通路密切相关。

图6 祖卡木颗粒治疗ALI关键靶点KEGG通路富集分析
2.7 中药-活性成分-关键靶点-疾病网络和关键靶点-通路网络
祖卡木颗粒治疗ALI的活性成分-关键靶点-疾病网络见图7,根据度值大小对活性成分进行排序,前3位活性成分为槲皮素、芦丁、山柰酚,前10位活性成分信息见表4。关键靶点-通路网络见图8。

图7 祖卡木颗粒治疗ALI中药-活性成分-关键靶点-疾病网络

图8 祖卡木颗粒治疗ALI关键靶点-通路网络

表4 祖卡木颗粒治疗ALI中药-活性成分-关键靶点-疾病网络度值前10位活性成分
2.8 实验验证结果
2.8.1 祖卡木颗粒对模型大鼠肺组织形态的影响
假手术组大鼠肺组织形态正常,肺泡结构完整、大小均一,肺泡腔内无炎性细胞浸润。模型组大鼠肺泡结构明显塌陷,肺泡腔变小并伴有炎性细胞浸润和肺间质变厚;祖卡木颗粒组和地塞米松组大鼠肺组织形态与肺泡结构变化较模型组有所减轻,表现为肺间质充血减轻,炎性细胞浸润减少。见图9、图10。造模后6 h和造模后72 h,模型组肺组织损伤评分均明显高于假手术组(P<0.01),祖卡木颗粒组和地塞米松组均明显低于模型组(P<0.05,P<0.01),祖卡木颗粒组与地塞米松组差异无统计学意义(P>0.05)。见表5。
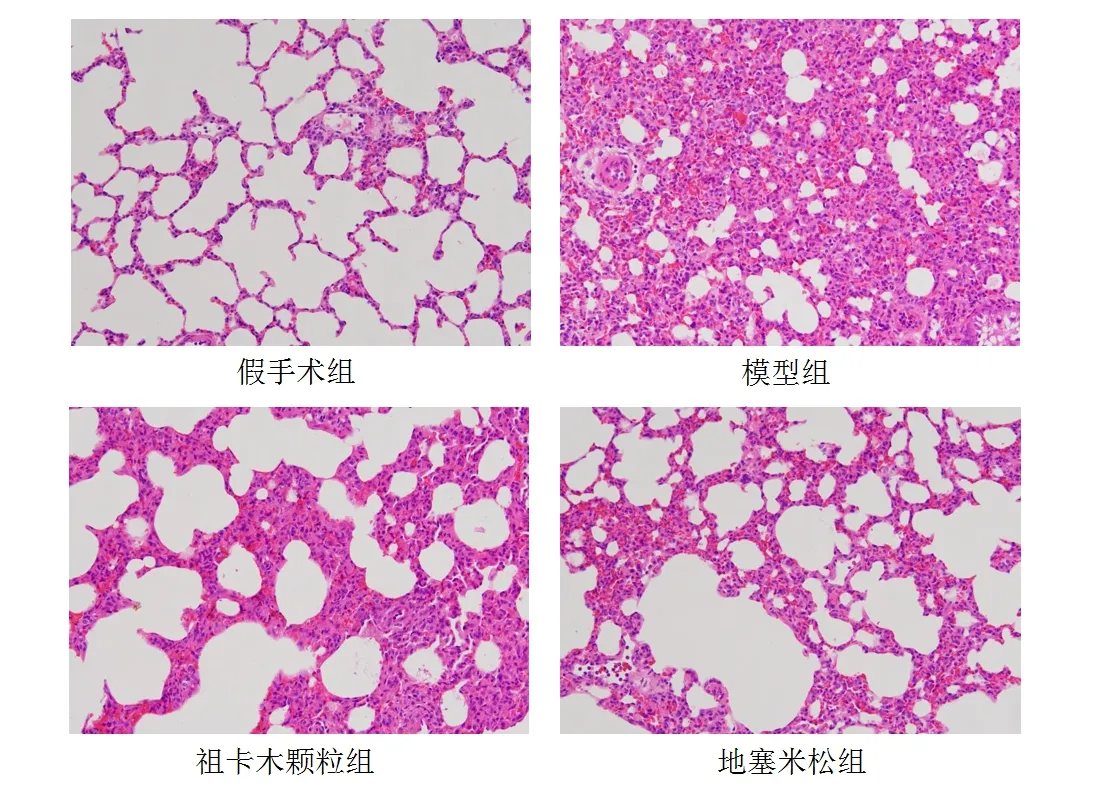
图9 造模后6 h各组大鼠肺组织形态(HE染色,×200)

图10 造模后72 h各组大鼠肺组织形态(HE染色,×200)
表5 各组大鼠不同时点肺组织损伤评分比较(±s,分)

表5 各组大鼠不同时点肺组织损伤评分比较(±s,分)
注:与模型组比较,*P<0.05,**P<0.01
造模后72 h 1.667±2.081**6.250±0.000 3.500±2.380**3.200±1.862**组别假手术组模型组祖卡木颗粒组地塞米松组只数4566造模后6 h 1.333±1.527**5.750±1.643 4.000±2.236*3.000±2.449*
2.8.2 祖卡木颗粒对模型大鼠肺组织CD14 mRNA表达的影响
造模后6 h,各组大鼠肺组织CD14 mRNA表达见表6。模型组大鼠肺组织CD14 mRNA表达明显高于假手术组(P<0.01),祖卡木颗粒组和地塞米松组明显低于模型组(P<0.05),祖卡木颗粒组与地塞米组差异有统计学意义(P<0.05)。
表6 各组大鼠造模后6 h肺组织CD14 mRNA表达比较(±s)
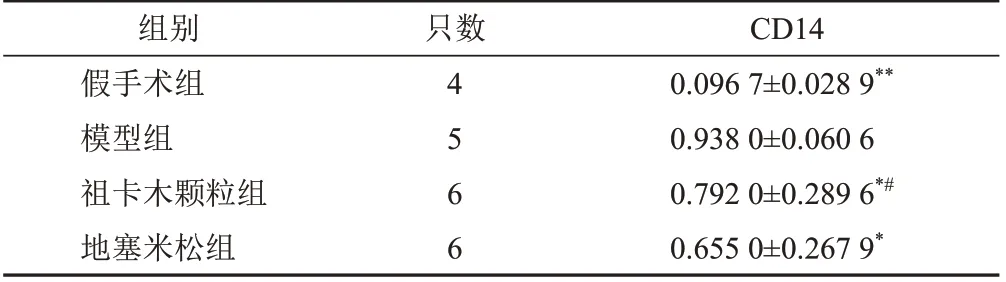
表6 各组大鼠造模后6 h肺组织CD14 mRNA表达比较(±s)
注:与模型组比较,*P<0.05,**P<0.01;与地塞米松组比较,#P<0.05
CD14 0.096 7±0.028 9**0.938 0±0.060 6 0.792 0±0.289 6*#0.655 0±0.267 9*组别假手术组模型组祖卡木颗粒组地塞米松组只数4566
内毒素是造成ALI的主要原因之一。CD14作为细胞表面的一种模式识别受体能够识别、结合脂多糖复合物[14]。脂多糖与细胞表面的模式识别受体CD14受体结合后,活化细胞内信号,释放大量炎性细胞因子,引起炎症反应[15]。祖卡木颗粒能有效抑制ALI大鼠肺组织CD14 mRNA表达,从而减轻ALI炎症反应。
2.8.3 祖卡木颗粒对模型大鼠肺组织CD80、CD86 mRNA表达的影响
造模后72 h,各组大鼠肺组织CD80、CD86 mRNA 表达水平见表7。与假手术组比较,模型组CD80、CD86 mRNA表达均显著升高(P<0.01)。与模型组比较,祖卡木颗粒组和地塞米松组CD80和CD86 mRNA表达均下降(P<0.01,P<0.05),祖卡木颗粒组与地塞米松组差异无统计学意义(P>0.05)。
表7 各组大鼠造模后72 h肺组织CD80、CD86 mRNA表达比较(±s)

表7 各组大鼠造模后72 h肺组织CD80、CD86 mRNA表达比较(±s)
注:与模型组比较,*P<0.05,**P<0.01
组别假手术组模型组祖卡木颗粒组地塞米松组CD86 0.606 7±0.089 6**1.472 5±0.606 7 0.828 0±0.115 2*0.820 0±0.131 8*只数4566 CD80 0.620 0±0.087 2**3.020 0±1.436 0 1.148 3±0.493 4**1.181 7±0.595 1**
CD80和CD86是T淋巴细胞最重要的共刺激分子,主要表达在抗原提呈细胞如巨噬细胞、树突状细胞表面,与相应配体(CD28)结合后促进T淋巴细胞活化,启动适应性免疫应答,调节Th细胞分化,从而调节Th1、Th2和Th17反应[16]。CD80和CD86诱导核因子-κB和炎性细胞因子产生,在肺部炎症和气道反应中起重要作用[17]。二者表达失衡会引起机体异常免疫应答反应[18]。祖卡木颗粒能有效抑制ALI大鼠肺组织CD80和CD86 mRNA表达升高,从而减轻肺部炎症。
3 讨论
ALI是由肺炎和吸入引起的直接损伤和全身感染、败血症、创伤引起的间接损伤引起的一种呼吸系统急危重症[19]。ALI病因复杂,包括肺免疫稳态失调、全身炎症、器官炎症和功能细胞凋亡障碍等,最终导致器官衰竭危及生命[20]。目前临床采用生命维持和抗感染治疗,主要分为机械通气疗法和药物疗法[21]。药物包括皮质醇类、他汀类药物和β-激动剂等,但常出现耐药性、代谢紊乱、胃肠道紊乱等不良反应[22]。因此,在分子水平上了解ALI发病机制,发现具有诊断和预后作用的生物标志物,对于开发新的治疗药物十分关键[23]。中药对免疫系统具有双向调节作用,在脓毒症并发ALI治疗中具有独特优势[24]。ALI可归属中医学“喘证”“暴喘”“喘脱”范畴,其病机可概括为热、毒、痰、瘀,治以清热解毒、祛痰化瘀,常用药物包括大黄、甘草等[25]。
为阐明祖卡木颗粒对ALI的保护作用及机制,本研究利用系统生物信息学筛选祖卡木颗粒的有效入血成分,获得174个药物活性成分和46个差异基因,并构建中药-活性成分-关键靶点-疾病网络。槲皮素、木犀草素、山柰酚、柚皮素、番泻叶苷等是祖卡木颗粒抗脂多糖诱导ALI的有效成分,说明祖卡木颗粒具有防治ALI的药理成分基础。槲皮素可通过抗炎、调节氧化应激、抗纤维化来保护内毒素造成的ALI,其相关机制涉及JAK2/STAT3信号通路[26]、TLR4/NF-κB信号通路[27]、Nrf-2/ARE 信号通路[28]等。木犀草素能抑制TLR4/NF-κB和PI3K/Akt介导的MAPK信号通路保护ALI[29]。TNF、VEGFA、IL6、IL-1β、AKT1是祖卡木颗粒抗ALI的关键靶点。IL-6、IL-1β、TNF-α等炎症因子在ALI发病中起着关键作用。VEGFA可诱导生理或病理性的新血管生成,进而促进肺血管通透性,加重肺水肿症状[30]。GO富集分析显示,炎症反应、细胞凋亡、细胞对脂多糖的反应等在祖卡木颗粒抗ALI的生物过程中发挥重要作用。KEGG通路富集分析显示,AGE-RAGE、IL-17、TNF、Toll样受体、NOD样受体等信号通路[31]在祖卡木颗粒治疗ALI中发挥关键作用。晚期糖基化终末产物的可溶性受体(sRAGE)是肺上皮损伤的标志。sRAGE 与表面活性蛋白(SP-D)联合,可作为脓毒症的生物标志物[32]。IL-17可诱导肺部和气道炎性介质的释放。Th17/Treg平衡是早期ARDS/ALI的重要风险指标[33]。Th17细胞在急性呼吸窘迫综合征患者外周血中显著增加[34]。血清IL-17水平可反映ALI患者病情严重程度[35]。罗艳等[36]研究认为,罗格列酮能显著减轻脂多糖诱导的新生鼠ALI炎症,其机制与降低IL-17A有关。Toll样受体4(TLR4)参与先天免疫并通过识别脂多糖或细菌内毒素介导炎症反应,TLR4过度激活会触发多种炎症因子产生[37]。
ALI可以通过一系列免疫信号通路导致机体炎症反应失控。机体受到感染时,通过模式识别受体识别病原体的固有免疫系统作为第一道防线,启动炎症反应,同时诱导共刺激分子表达和抗原提呈细胞成熟,活化T细胞从而引起机体的适应性免疫应答[38]。CD14是模式识别受体中的一种,能单独或与TLR4共同识别脂多糖,启动炎症反应[39]。金肇权等[40]研究表明,CD14-TLR4-NF-κB通路参与脂多糖诱导的ALI炎症反应。在脓毒症患者体内CD86明显升高,可用于预测早期脓毒症的发生[41]。脂多糖诱导的ALI小鼠的肺和脾树突状细胞上CD80和CD86表达升高,用白藜芦醇预处理能降低共刺激分子的表达,减轻ALI[42]。因此,本研究通过气管滴注脂多糖建立ALI大鼠模型对祖卡木颗粒进行药效学评价,结果表明,祖卡木颗粒能有效缓解脂多糖引起的ALI,并显著抑制肺组织中CD14和共刺激分子CD80、CD86 mRNA表达,减轻机体免疫细胞的过度应激反应,避免细胞因子风暴的发生。
综上所述,本研究采用生物信息学方法预测祖卡木颗粒抗ALI的活性成分、有效靶点和信号通路,并通过ALI大鼠模型进行初步验证。结果表明,槲皮素、木犀草素、山柰酚和番泻叶苷可能是祖卡木颗粒抗ALI的主要活性成分,祖卡木颗粒能够有效抑制ALI大鼠肺组织CD14、CD80、CD86 mRNA表达,其机制可能与IL-17、Toll样受体、NOD样受体等免疫信号通路有关。本研究可为祖卡木颗粒的基础研究及临床应用提供思路和依据,但仍存在一定的局限性。复方药味众多,成分复杂,网络药理学方法并不能准确反映复方君臣佐使的作用;数据库筛选的成分未必与实际发挥作用者一致;脂多糖诱导的ALI大鼠模型在病理机制方面与临床ALI患者不完全相同。药效学实验未对更多信号通路进行验证,后续将开展更深入的研究。

