发酵料中促平菇生长菌株的分离与鉴定
张俊杰,王京琪,刘 芹,刘 晴,崔 筱,张玉亭,吴 杰,孔维丽
(1.郑州轻工业大学 食品与生物工程学院,河南 郑州 450000;2.河南省农业科学院 植物营养与资源环境研究所,河南 郑州 450002)
平菇(Pleurotus ostreatus)又名侧耳,是国内广泛栽培的一种可食用的担子菌,其美味可口、营养丰富,受到人们的喜爱[1]。河南省人口接近1 亿,郑州市拥有超过1 千万的人口,平均每天需要消费200多t 平菇[2]。1972 年,河南省农业农村厅刘纯业[3]在河南省南阳市开创了以生料为主要原料的平菇栽培技术。1988年,邱贵根[4]开始不断改进栽培技术,用熟料方式栽培平菇,并获得了理想的试验结果。发酵料栽培平菇是通过培养料短时发酵开放接种种植平菇的一种方式,与生料、熟料栽培方式相比,不需要高温灭菌和无菌接种环节,具有工艺简单、菌丝生长快、成本低、生产效率高等一系列优点。2000 年以后发酵料栽培平菇技术在整个平菇生产过程中占据较为重要的地位[5]。KONG 等[6]研究发现,平菇培养料在发酵制备过程经历了升温、高温、降温过程,温度及理化性质变化与微生物菌落的组成变化显著相关。同时还发现,发酵后的培养料能够抑制霉菌生长并促进平菇生长[7‐8],代谢组分析发现,发酵培养料中含有糖类及其衍生物、氨基酸、肽类及其类似物、维生素等多种平菇生长所需的营养,除此之外还含有植物生长调节剂[如吲哚乙酸(IAA)、茉莉酸和赤霉素]和抑菌物质(如绿原酸、抗生素、白藜芦醇)等[9],适宜浓度的IAA 能够促进平菇生长发育[10]。前人研究表明,假单胞菌(Pseudomonassp.)P7014 诱导杏鲍菇菌丝生长及早期子实体形成[11];平菇覆土栽培过程中假单胞菌P2-10 通过分泌1-氨基环丙烷-1-羧酸(ACC)脱氨酶降解平菇产生的ACC、减少平菇乙烯的合成及其对菌丝生长和子实体发育的抑制作用,促进平菇原基分化和子实体生长发育[12‐13];平菇生长过程中接种大豆慢生根瘤菌,通过固氮作用促进平菇菌丝生长,提高其产量及干物质含量、蛋白质含量、矿物质含量[14]。那么在发酵过程中哪些微生物群体分泌了IAA,这些微生物与平菇菌丝能否共同生长,是否能促进平菇生长,尚未见有相关研究。鉴于此,从不同发酵时期平菇培养料分离微生物,检测其分泌IAA 的能力并筛选出对平菇生长有促生作用的菌株,鉴定其分类地位,为开发促平菇生长的微生物制剂、推动发酵料工厂化栽培平菇奠定基础。
1 材料和方法
1.1 材料
1.1.1 供试菌株及培养基 平菇菌株黑平17 由河南省食用菌种质资源库提供,供试微生物菌株来源于2021 年9 月河南省农业科学院现代农业科技试验示范基地平菇培养料不同发酵时期的样品。LB固体培养基及液体培养基(1 L)[15]:蛋白栋10 g,酵母提取物5 g,NaCl 10 g,补足水至1 L,用1 mol/L 的NaOH 调节pH值至7.0~7.2;固体培养基在以上成分的基础上加入12 g 琼脂粉,装后121℃灭菌20 min,备用。
1.1.2 试验试剂 主要试剂包括0.5 mol/L FeCl3溶液、Salkowaki 显色液、10 mg/mL L-色氨酸溶液、1 mg/mL IAA 标准溶液、GUTC(异硫氰酸胍)提取缓冲液、GUTC 洗涤缓冲液、硅藻土悬液、75%乙醇、0.8%生理盐水、甘油。
1.2 方法
1.2.1 菌株的初步分离与纯化、保藏 菌株分离:采取稀释涂布平板分离法[16]对不同时期平菇发酵料中的菌株进行分离。称取样品10 g至装有90 mL无菌水的锥形瓶中,吸取500 µL 样品悬液注入装有4.5 mL 无菌水试管中,吹吸至充分混匀,即制成10-2稀释度的样品悬液,用相同的方法依次制成10-3、10-4、10-5、10-6、10-7的样品悬液。用无菌吸枪头分别从10-3、10-4、10-5、10-6、10-7稀 释 度 的 试 管 中 吸 取200µL 样品悬液涂布于LB 平板上,涂布均匀,每个稀释度分别涂布3 个平板。于30 ℃恒温箱中倒置培养。培养后从平板上挑取形态不一致的单菌落至LB 斜面上,S 形划线培养并进行保存。菌株纯化及保藏:采用3次划线法纯化分离出的菌株,纯化后再次挑取单菌落接种至斜面上,放入30 ℃培养箱内培养后进行室温保存。再采用-80 ℃冰箱冻结法对菌株进行长时间保藏。
1.2.2 促生菌分泌IAA 的定性及定量测定 挑取120 株菌进行IAA 定性测定,活化待测菌株,挑取单菌落接种在LB 液体培养基(含100 mg/L L-色氨酸)中,放入摇床180 r/min、30 ℃振荡培养2 d 后吸50µL 菌悬液滴于白色陶瓷板上,同时加入50 µL Salkowski 显色液,以50µL 10、20、30、40、50、60 mg/L IAA标准溶液滴于陶瓷比色板上再加入等量比色液作为对照。记录编号,在室温避光的条件下等待30 min,观察显色程度,若变红则证明能够产IAA。对定性试验中有分泌IAA 能力的细菌进行定量测定,细菌培养条件均与定性测定保持一致。以IAA质量浓度为横坐标、OD530为纵坐标绘制标准曲线。挑取单菌落接种至含有100 mg/LL-色氨酸的LB 液体培养基中,摇床振荡培养到对数生长期。将菌液以4 000 r/min 离心15 min,取3 mL 上清液与等量的显色溶液混合,将灭菌后的LB 液体培养基和显色液以1∶1 的比例混合作对照,在室温下避光30 min,测量OD530,并进行数据采集。再用标准曲线进行分析,得到不同菌株的IAA含量[17‐18]。
1.2.3 GUTC 法提取菌株总DNA 参照张俊杰[19]的方法提取菌株总DNA:将所筛选的菌株接种至LB液体培养基中,于30 ℃、180 r/min 摇床振荡培养48 h。吸取1.5 mL 菌液至离心管中,12 000 r/min 离心1 min,弃去上清。吸取800 µL 灭菌的生理盐水(0.8%)洗涤菌体并振荡均匀,12 000 r/min 离心1 min,然后弃掉上清液。总共进行3 次洗涤。添加800µL GUTC 提取缓冲液,再加入100µL 的硅藻土悬浮液,充分振荡后,室温保存一晚。取出过夜破壁的菌体,振荡悬浮,13 000 r/min 离心4 min,弃上清。加入600 µL GUTC 洗涤缓冲液,振荡悬浮,13 000 r/min 离心4 min,共洗涤2 次;弃去上清加入600 µL 75% 乙 醇,振 荡 悬 浮,13 000 r/min 离 心4 min,弃上清,共洗涤2 次。离心管放置冷冻干燥机内干燥4 h 至硅藻土变白。将经灭菌的ddH2O 添加到冷冻干燥后的离心管中,并振荡均匀。在60 ℃的恒温水浴锅中保持40 min,12 000 r/min 离心3 min。用无菌枪头将上清液吸入PCR 无菌试管,即可获得DNA。采用1%的琼脂糖凝胶电泳技术,对DNA 含量及纯度进行分析。将3µL DNA 与相同体积Buffer 混合后点样,第1 个孔点250 bp DNA Ladder,100 V 电泳30 min,并用紫外分析仪观察结果。
1.2.4 PCR扩增、测序及16S rRNA基因系统发育分析 使 用 正 向 引 物P1(5′-AGAGTTTGATCC‐TGGCTCAGAACGAACGCT-3′)和反向引物P6(5′-TACGGCTACCTTGTTACGACTTCACCCC-3′)进 行16S rRNA 基因扩增[19]。所有供试菌株PCR 产物的测序、系统发育分析参照ZHANG 等[20]的方法。PCR产物用1%琼脂糖凝胶电泳鉴定后,送至北京擎科生物技术有限公司进行序列分析。利用DNAMAN软件对测序结果进行拼接,并在NCBI 上进行同源序列的比较,下载菌株序列相似性较高的16S rRNA基因序列,在MEGA 7.0 软件中构建NJ 系统发育树[21]。
1.2.5 平菇促生试验 平菇促生试验参考刘国丽等[22]的方法。挑取待测菌株接种于LB 液体培养基中,摇床振荡培养至对数生长期,收集1 mL原菌液,剩余菌液于12 000 r/min 离心1 min,收集上清液。用记号笔在PDA 平板十字划线,并在十字线上距平板中央2.5 cm 处,分别划一道3 cm 长并垂直于十字的线,分别吸取10 µL 原菌液、上清液至3 cm 标记处划线。然后用直径为5 mm 的灭菌打孔器取大小一致的黑平17 接入平板中央。25 ℃培养箱里正置培养1 d 后,再将其倒置培养。以不接原菌液、上清液的平板作为对照组(CK)。培养7 d 后的平板与CK 进行对比,用0.02 mm 精度的游标卡尺测量黑平17菌丝长度。平菇的菌丝长度越长,表明菌株对它的促进作用越强。根据促生率筛选对黑平17 具有促进作用的细菌。促生率=(处理组菌丝长度-对照组菌丝长度)/对照组菌丝长度×100%。
1.3 数据处理
试验数据使用IBM SPSS statistics 26 和Microsoft Excel 2013进行统计及差异显著性分析。
2 结果与分析
2.1 120株菌产IAA定性与定量测定结果
从分离纯化的菌株中挑取了不同时期的120株菌,进行定性测定,结果表明,120株菌中共有116株菌产生显色反应,即证明这116 株菌有产生IAA 的能力。根据所比对的一系列对照组的显色程度来看(随着IAA 质量浓度的增加,所显示的颜色加深),有88 株菌的IAA 显色程度低,为较浅的粉红色,28 株菌的IAA 显色程度相对较高。其中,AFX-13-3的显色程度最深,为深玫红色,另有XWW-4-3、AMB-8-2、AMB-10-2、ST-3-2、ST-4-2 五株菌的显色程度仅在AFX-13-3之下。
绘制的标准曲线如图1 所示,其OD530与IAA 质量浓度呈现的线性关系为y=0.023 3x-0.029 5(R²=0.999 4)。挑取定性测定后产IAA 显色程度相对较高的28 株菌进行定量测定,测定其OD530值后,根据线性关系计算IAA 质量浓度。如图2 所示,所筛选的28 株菌的IAA 质量浓度均在10 mg/L 左右或以上,其中有9 株菌的IAA 质量浓度在20 mg/L 以上,分别是AFX-13-3、XWW-4-3、LTX-11-3、AMB-8-2、AMB-10-2、AMB-14-3、ST-1-2、ST-3-2、ST-4-2。AFX-13-3产IAA的能力最强,IAA平均质量浓度达到 85.18 mg/L;AMB-10-2、ST-3-2、AMB-8-2、XWW-4-3 产IAA 的能力仅次于AFX-13-3,其IAA平均质量浓度分别为39.35、34.12、30.94、30.71 mg/L;剩余4 株菌ST-1-2、ST-4-2、LTX-11-3、AMB-14-3产IAA 的能力相对较弱,其IAA 平均质量浓度分别为24.41、24.09、22.26、21.94 mg/L。
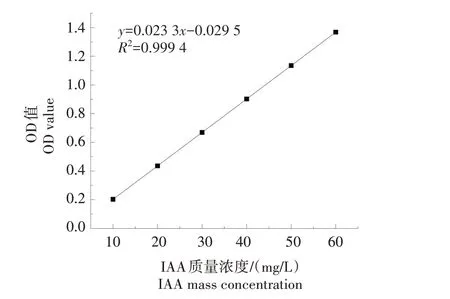
图1 不同质量浓度IAA标准曲线Fig.1 Different mass concentrations of IAA standard curve

图2 筛选28株菌的产IAA能力定量测定Fig.2 Quantitative determination of IAA‑producing capacity of 28 strains
2.2 筛选25株菌的16S rRNA基因的测序及系统发育分析
根据定性的结果,挑取产IAA 能力较明显的25株菌进行16S rRNA 基因扩增和测序(另有3 株菌AMB-1-2、LHS-2-2、ST-1-2 未进行测序),初步判断其分类地位。如图3 所示,ST-8-2、XWW-14-2、AMB-10-2、AFX-29-1、AFX-23-1、AFX-9-2 与Bacillus velezensisCR-502T聚为一支,序列相似性为100%,可鉴定为Bacillus velezensis(贝莱斯芽孢杆菌)。ST-10-2 与Bacillus siamensisKCTC 13613T聚为一支,其序列相似性达100%,可鉴定为Bacillus siamensis(暹罗芽孢杆菌)。ST-3-2、ST-4-2、AMB-8-2 与Bacillus haynesiiE-1T16S、Bacillus licheniformisNG4-13T等菌株聚在一起,其序列相似性为97.3%,可初步鉴定为Bacillus(芽孢杆菌属)。AFX-19-3与Bacillus pumilusATCC 7061T、Bacillus aerophilus28KT聚为一支,序列相似性为100%,可鉴定为Bacillus(芽孢杆菌属)。AFX-13-3 与Priestia megateriumATCC 14581T、Priestia aryabhattaiB8W22T等菌株聚为一个分支,其序列相似性为100%,可鉴定为Priestia(巨大芽孢杆菌属)。XWW-11-2、LTX-3-2 与Bacillus tropicusMCCC 1A01406T、Bacillus cereusJCM 2152T等 菌 株 聚 在 一起,其序列相似性为99.9%,可鉴定为Bacillus(芽孢杆 菌 属)。LHS-4-3、LTX-12-3、AMB-19-3 与Glutamicibacter mishraiS5-52T聚为一个分支,其序列相似性达100%,可鉴定为Glutamicibacter mishrai(脂肪性谷氨酸杆菌)。LHS-2-3、LHS-8-2、XWW-1-3、XWW-4-3、LTX-11-3 与Glutamicibacter halophytocolaKLBMP 5180T聚为一个分支,序列相似性为99.9%,可鉴定为Glutamicibacter(谷氨酸杆菌 属)。LTX-1-2、LTX-9-2 与Pseudomonas plecoglossicidaFPC951T为同一分支,其序列相似性为99.4%,可初步鉴定为Pseudomonas(假单胞菌属)。AMB-14-3 与Empedobacter brevisLMG 4011T聚为同一分支,序列相似性为99.7%,可鉴定为Empedobacter(短隐杆菌属)。
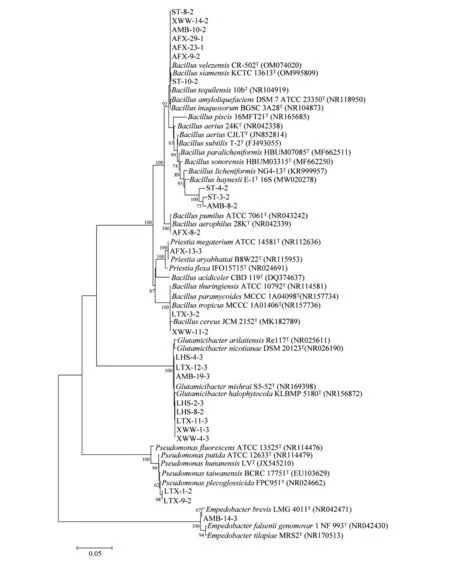
图3 筛选25株菌的16S rRNA基因NJ系统发育树Fig.3 NJ phylogenetic tree of 16S rRNA gene for 25 strains
2.3 平菇促生效果
如图4 所示,根据定性定量结果筛选的产IAA能力较强的8株菌,不论是原菌液还是上清液,都对平菇有着促生作用。其中XWW-4-3、AFX-13-3、LTX-11-3 对平菇的促生效果最显著,其原菌液对平菇的促生率分别为54.77%、50.16%、21.50%,上清液对平菇的促生率为50.96%、26.27%、39.65%。根据系统发育树可知,XWW-4-3、LTX-11-3 属于谷氨酸杆菌属,AFX-13-3属于巨大芽孢杆菌属。对平菇促生效果较显著的菌株有AMB-8-2、ST-3-2,其原菌液对平菇的促生率分别为14.49%、10.51%,上清液对平菇的促生率为10.51%、1.91%,这2 株菌皆属于芽孢杆菌属。ST-4-2、AMB-10-2 原菌液对平菇的促生作用则不太明显,促生率分别为2.23%、1.12%,均属于芽孢杆菌属。而AMB-14-3 则存在区别,原菌液对平菇的促生率为3.19%,促生率相对较低。而在上清液试验中,其对平菇的促生率为22.77%,促生作用较明显。但总体而言,不论是原菌液还是上清液,都对平菇具有促生效果,同时这也可以初步证明,相对于CK 组而言,对平菇的促生效果是菌株生长过程中分泌到培养基中的代谢产物在发挥作用。
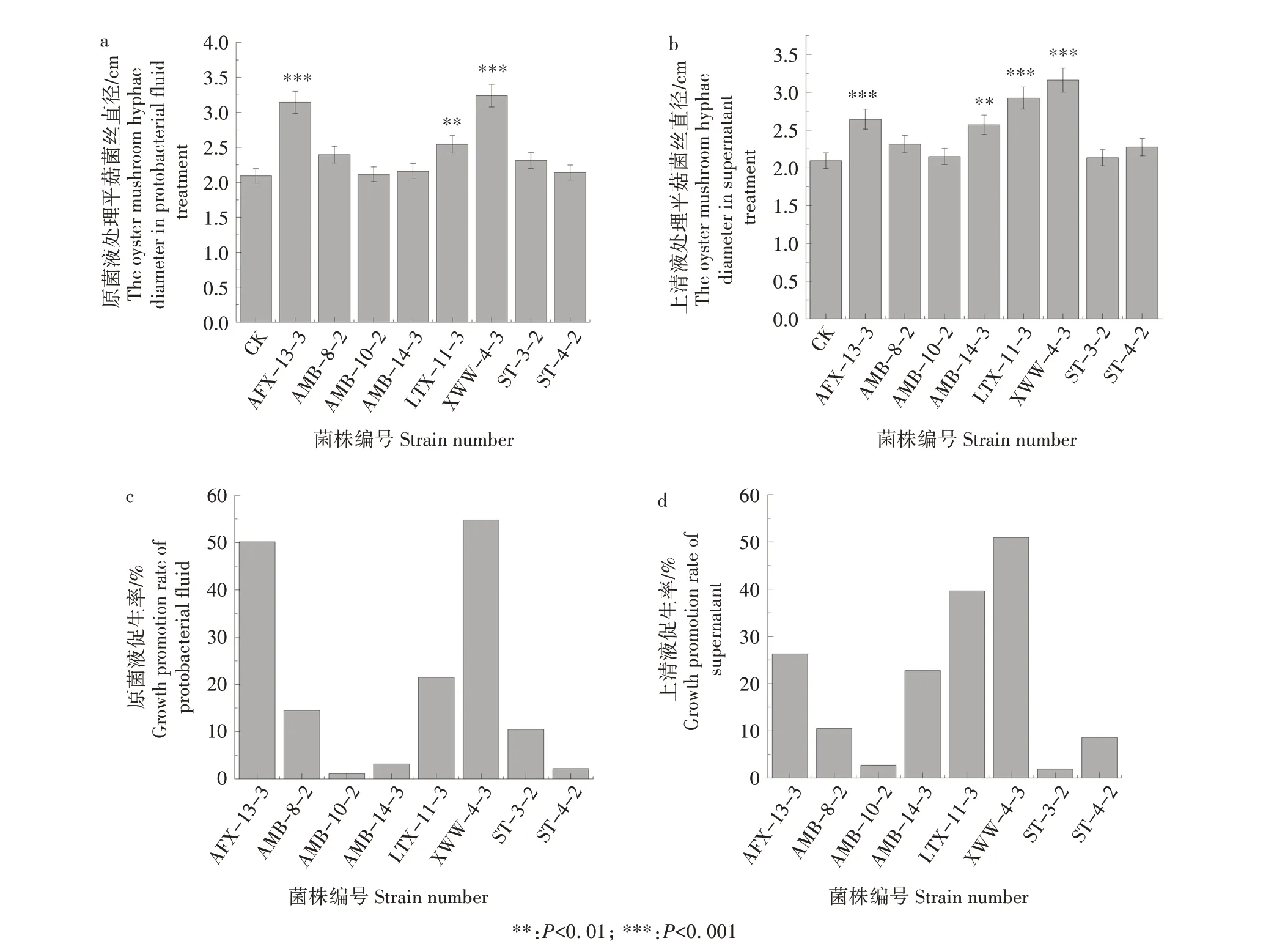
图4 平菇促生效果比较Fig.4 The growth‑promoting effect of strains on oyster mushroom
3 结论与讨论
本试验从不同时期的平菇发酵料中分离出了多种促生优势菌株。首先,采集不同时期的平菇发酵料样品,采取稀释涂布平板法分离得到120株菌。其次,利用显色反应进行产IAA 能力的定性测定及定量测定。然后,利用GUTC 法提取产IAA 能力强的菌株DNA,继而进行16S rRNA 基因测序,并基于构建的16S rRNA基因进化树进行系统发育分析,确定其分类地位。最后筛选产IAA 能力强的菌株应用于平菇的促生试验。结果表明,所挑选的120 株菌中有116 株菌具有分泌IAA 或其类似物的能力,尤其菌株AFX-13-3、XWW-4-3、AMB-8-2、AMB-10-2、LTX-11-3、AMB-14-3、ST-3-2、ST-4-2 分泌IAA 的能力较强。在进行平菇促生试验后,AFX-13-3、XWW-4-3、LTX-11-3 对平菇有较好的促生作用。经过16S rRNA基因系统发育分析,AFX-13-3 属于巨大芽孢杆菌属,XWW-4-3、LTX-11-3 属于谷氨酸杆菌属,这能够初步证明,在不同时期的发酵料中,对平菇促生效果最为明显的是巨大芽孢杆菌属和谷氨酸杆菌属。因此,平菇培养料发酵过程中含有产生IAA 的微生物,并且这些微生物与平菇共生长代谢产生IAA 促平菇生长。由此可见,微生物在发酵培养料栽培平菇过程中起着十分重要的作用。经研究发现,随平菇菌丝生长有8 种细菌的基因相对丰度增加,细菌的代谢物对平菇的生长发育具有显著的影响[23],本研究再一次证明利用细菌-真菌共生系统提高食用菌产量是可行的。
平菇是世界上栽培规模最大的食用菌之一,也是我国发展速度较快、栽培面积较广的食用菌种类。本研究筛选出的具有较好促生效果的菌株,未来可以用于制备功能菌剂并添加到平菇发酵料中,发挥促平菇生长的作用,从而带来良好的经济效益。

