可注射矿化胶原水凝胶修复大鼠颅骨临界性骨缺损的研究*
张悦 王征
创伤、手术和癌症等原因造成的骨缺损一直是困扰骨科医生的临床问题。对于小的骨缺损,人体的骨组织可以再生修复[1],但是在临界性骨缺损甚至更大范围骨缺损的情况下,必须使用天然骨移植物或合成材料来修复缺损,才能实现骨再生。天然骨移植包括自体骨移植、同种异体骨移植和异种骨移植,但因受到来源不足、术后并发症、免疫排斥反应及存在共患病可能等原因使得天然骨在临床中应用较少[2-3]。不同于天然骨来源受限,骨修复的合成材料来源广泛,并且可以通过调控材料的特性参数使其更接近自然骨,以此大大降低疾病传播风险和免疫原性[4-6]。因此,在临床上针对去骨瓣减压术造成的颅骨临界骨缺损的修复主要是利用仿生支架[7]。
由有序排列的Ⅰ型胶原和纳米羟基磷灰石组成的矿化胶原(mineralized collagen,MC),采用独特的体外仿生矿化技术,通过纳米钙磷盐和胶原分子组装而成,其化学组成和结构与人体天然松质骨相似[8]。研究证实,矿化胶原人工骨修复材料不但具有优秀的诱导成骨活性,而且在体内最终能够完全降解吸收,是一种理想的骨修复材料[9-10]。
为了将MC 固定于骨缺损位置并持续停留一段时间,笔者选择了具有良好生物相容性和可降解性的海藻酸钠(Alginate,ALG)作为载体,通过局部生理浓度的Ca2+使ALG形成固态凝胶[11]。本实验将MC与ALG按特定比例混合后制备的MCA 胶体悬浮液填充到临界性骨缺损部位,以达到骨修复的目的。
1 材料与方法
1.1 主要动物、试剂与仪器
实验动物:15只成年雄性SD大鼠,体重280 ~ 300 g,购于斯贝福(北京)生物技术有限公司,所有实验均经中国人民解放军总医院动物实验伦理委员会批准(许可证号SQ 2022541)。
主要试剂:DMEM基础培养基、胎牛血清、胰蛋白酶(美国GIBCO公司);海藻酸钠(上海阿拉丁生化科技股份有限公司);Ⅰ型胶原(河北考力森生物科技有限公司);青霉素-链霉素(博奥拓达科技有限公司);CCK-8 试剂盒(日本同仁化学研究所);氯化钙(CaCl2·5H2O)、磷酸(H3PO4)、乙酸(CH3COOH)(国药集团股份有限公司)。
主要仪器:扫描电子显微镜(日本电子公司);投射电子显微镜(日本电子公司);磁力搅拌器(上海思乐仪器有限公司);冷冻干燥箱(北京博医康实验仪器有限公司);高速离心机(台湾益弘仪器股份有限公司);高效液相色谱仪(美国安捷伦公司);Micro-CT(美国GE 公司);光学显微镜(日本OLYMPUS公司)。
1.2 MCA水凝胶制备方法
1.2.1 MC制备
将0.6 gⅠ型胶原海绵裁剪成小块,加入至1 L 冰醋酸溶液(0.5 mol/L)中。室温下使用磁力搅拌将所得混合物充分混合10 h以上,避光。随后加入120 mL氯化钙水溶液(0.5 mol/L),避光持续搅拌1 ~ 2 h。再加入72 mL磷酸水溶液(0.5 mol/L),继续搅拌1 ~ 2 h。用0.5 mol/L 浓度的氢氧化钠溶液将混合体系pH调至10,搅拌10 h。将体系溶液移到离心管中,离心速度在8 000 ~ 12 000转/分钟,测量离心后上清液pH,并加入与上清液等体积的超纯水,充分搅拌后再次离心,重复多次直至上清液pH为7左右。使用冻干机冷冻干燥48 h去除残留水分,使用玛瑙研磨钵研磨30 min[8,12]。
1.2.2 MCA制备
将15 mg ALG混入1 mL超纯水中,然后磁力搅拌10 min以形成稠密的混合物。随后将200 mg的MC粉末加入ALG溶液中,持续磁力搅拌30 min。用于体外实验时使用1.8 mM的CaCl2溶液进行交联反应,形成固态凝胶,用于体内实验时利用局部体液中的Ca2+进行交联[13]。
1.3 扫描电子显微镜和投射电子显微镜观察
使用扫描电子显微镜(SEM)和投射电子显微镜(TEM)观察海藻酸钠水凝胶和MCA的形貌,利用安装在SEM和TEM上的EDS装置进行元素分析。
将制备的MC沉淀物滴在铜网上,干燥处理后TEM观察。海藻酸钠水凝胶和MCA经Ca2+溶液交联后用超纯水清洗(洗涤3 次,每次5 min),随后进行脱水干燥处理用于SEM观察交联状态和元素分析。
1.4 细胞增殖实验
MCA 浸提液按照GB/T 16886.12-2000 要求,以0、100、200 mg/mL标准将钴-60灭菌后的MCA放入无血清细胞培养基中,在37℃细胞培养箱中放置48 h 后,以8000转/分钟的速度离心收集浸提液。然后,将L929 细胞接种于96 孔板(~5 000 细胞/孔),在细胞培养基中培养。24 h后,用MCA浸提液代替培养基继续培养48 h。最后将浸提液吸出,用无菌PBS 洗涤2 次后加入含10%CCK-8 的培养基,在37 ℃下培养1 h,在450 nm波长下测定吸光度。
1.5 MCA体内降解实验
为了评估MCA 的体内生物安全性及降解性,将MCA溶液注射到小鼠右侧腹部皮下,利用局部生理Ca2+诱导交联反应,进而在原位形成水凝胶植入物。注射第3、7、60 d时将注射MCA 水凝胶部位的皮肤及皮下残留的植入物一同取下,用4%多聚甲醛固定24 h。梯度脱水后将样品包埋于石蜡中,切片后采用HE染色进行观察。
1.6 MCA水凝胶在大鼠颅骨缺损模型中的修复作用
将15 只大鼠标号后采用简单随机方法分成3 个实验组,对照组、ALG 水凝胶组和MCA 水凝胶组,每组5 只。大鼠在进行颅骨缺损造模前,在手术室适应1 周。使用七氟烷呼吸麻醉并维持麻醉,碘伏消毒备皮,切开颅顶皮肤及骨膜,充分暴露颅骨。使用直径5 mm的环形骨钻在大鼠颅骨顶部钻出两个对称的缺损,避免损伤脑膜[14]。在缺损处填充ALG 水凝胶(15 mg/mL)、MCA(ALG,15 mg/mL;MC,200 mg/mL)后逐层缝合骨膜和皮肤。分别在第2、4、8 周处死大鼠,取出主要脏器(心、肝、脾、肺、肾、脑)和颅骨,4%多聚甲醛中固定24 h。颅骨标本进行Micro-CT 扫描后放入10%EDTA 脱钙,石蜡包埋,切片后进行HE染色。
1.7 Micro-CT扫描
采用X 射线显微断层扫描(Micro-CT)扫描大鼠颅骨缺损区域,通过不同阶段的X射线吸收检测骨形成。扫描步骤为每节20 μm。采用三维重建成像软件对各实验组修复效果进行分析。
1.8 再生骨的组织学染色及评价
术后2、4、8 周采集颅骨标本,用4%甲醛固定24 h,用10%乙二胺四乙酸脱钙1 个月。梯度脱水后,将样品包埋于石蜡中,沿靠近植入体中心的冠状位方向用切片机切成3 μm厚度的切片。采用HE染色进行组织学评价,并用光学显微镜对切片进行观察。
2 结果
2.1 MCA扫描电镜观察及元素分析
将MC 和ALG 按比例混合后制成MCA,扫描电子显微镜观察显示,与ALG 水凝胶(见图1C)光滑的表面相比,混有矿化胶原的MCA表面粗糙(见图1F),可以观察到MC颗粒(见图1F黑色箭头)。从能量色散光谱(EDS)图中观察到MCA 中密集而均匀的Ca/P 信号,结果说明MC 均匀地分散在水凝胶中(见图1D-H)。另外,对ALG 水凝胶和MCA 中钙磷含量进行测定,MCA 中钙和磷含量(Ca:wt%=24.76%,P:wt%=13.70%)高于ALG水凝胶(Ca:wt%=6.13%,P:wt%=3.42%)(见图1I、J)。

图1 A. MCA未经Ca2+交联的可注射状态;B. MCA经Ca2+交联的固体状态;C. ALG 表面的扫描电镜图;D. ALG 中Ca 分布情况,EDS图片;E. ALG中P分布情况,EDS图片;F. MCA表面的扫描电镜图(黑色箭头指示的是MC 颗粒);G. MCA 中Ca 分布情况,EDS 图片;H. MCA 中P 分布情况,EDS 图片;I. ALG 中Ca/P 含量;J. MCA中Ca/P含量
2.2 MCA生物相容性实验
MCA 浸提液与L929 细胞孵育48 h 后,空白对照组(0 mg/mL)细胞增殖率为100%,100 mg/mL组为99.62%,200 mg/mL 组为99.95%,MCA 水凝胶细胞毒性评级为1级,无细胞毒性(见图2A)。MCA水凝胶皮下注射部位皮肤HE 染色结果显示残存的MCA 植入物周围形成纤维包裹,植入物内部结构均匀,注射部位皮肤和植入物周围均未发现炎症或病变(见图2E)。皮下注射MCA第3天和第7 天,注射部位皮肤HE 染色结果中未见明显的炎症反应(见图2C、D)。
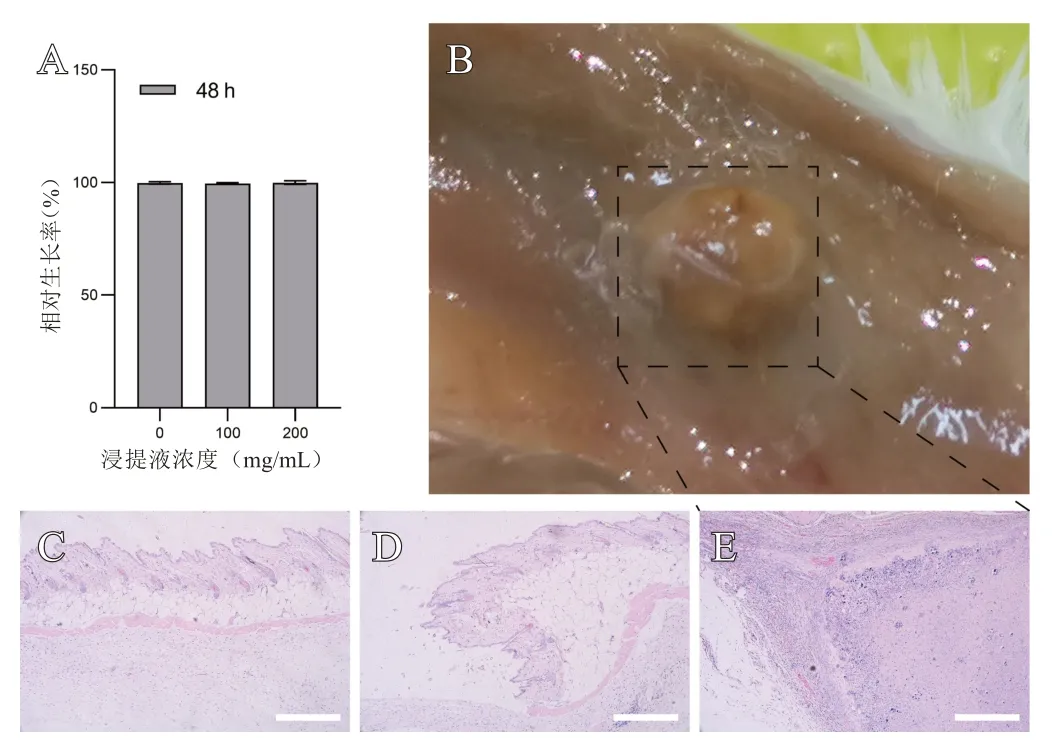
图2 A. 不同浸提液浓度的细胞增殖率;B. 小鼠皮下注射MC@MAH水凝胶第60天时解剖图;C. 注射MC@MAH水凝胶第3天时注射部位皮肤的HE染色;D. 注射MC@MAH水凝胶第7天时注射部位皮肤的HE染色;E. 注射MCA第60天皮肤的HE染色(比例尺:200 μm)
2.3 颅骨临界骨缺损修复效果
从Micro-CT扫描的3D重建结果发现,与对照组相比,MCA 组在术后2 周和4 周时,原颅骨缺损中心位置出现了新生的骨组织。在术后第8 周时,原颅骨缺损处形成了更多的新生骨组织(见图3),说明含有MC 的水凝胶具有成骨作用。用HE 染色进行组织学观察,发现在第2 周时MCA 组颅骨缺损处的MCA 凝胶已经开始降解,同时有细胞向MCA凝胶内部生长现象,这说明MCA有很好的降解性和组织相容性(见图4)。实验组大鼠的主要脏器HE 染色结果显示各脏器,特别是颅骨缺损部位下方的大脑皮质,细胞结构完整,形态规则,核质界限清晰,细胞之间结合紧密(见图5)。

图3 将ALG水凝胶和MCA填充于颅骨缺损处与对照组相比,第2、4、8周的颅骨临界骨缺损修复的Micro-CT 3D图片(红色虚线表示临界颅骨缺损范围)
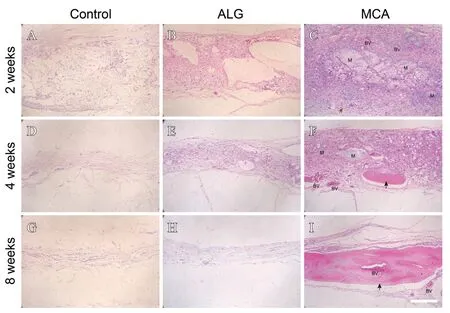
图4 将ALG水凝胶和MCA填充于颅骨缺损处与对照组相比,第2、4、8周的颅骨临界骨缺损修复的HE染色图片(比例尺:200 μm)

图5 将对照组和各个实验组大鼠的主要脏器(心、肝、脾、肺、肾、脑)进行HE染色图片(比例尺:200 μm)
3 讨论
为了满足颅骨缺损修复的目的,开发一种在结构和生物学性能上都能模仿天然骨,同时满足不同形状骨缺损的水凝胶骨修复材料是十分必要的[15]。本研究中使用的矿化胶原(MC)采用仿生策略制备,结合海藻酸盐(ALG)制备的水凝胶具有可注射性,并且不受骨缺损形状的限制。这归因于ALG在与Ca2+结合前是流体状态,并且ALG具有良好的生物相容性和降解性[11]。另外,在ALG中加入MC时并不会使其发生交联反应,也不会干扰凝胶的交联过程[16]。相较于其他的利用光和热产生交联作用的水凝胶,ALG水凝胶的另一大优势在于可以利用体内生理的Ca2+浓度产生交联作用,更方便后期向骨缺损部位再次补充MCA。
大量研究工作表明,利用仿生原理制备的MC 具有天然骨结构和生物学性能,并且被广泛用于多种复合骨修复材料中[17-19]。MC中所包含的胶原、钙和磷是成骨过程所需原料,并且MC 在骨缺损部位能更好地降解及促进新生骨的形成[20-21]。本研究的降解实验和骨缺损修复结果也同样证实这一结论。首先,小鼠右侧腹部皮下注射MCA 后60 d,仍然观察到大量残留的MCA,HE 染色结果显示残留的MCA 内部结构均匀。其次,使用MCA 修复,颅骨临界骨缺损2 周时,HE 染色结果显示MCA 被分割成多个小的MCA团块。随着修复时间的延长,MCA逐步被分解吸收。第8 周时,相较于皮下注射第60 天HE 染色结果,填充于骨缺损处的MCA 已全部被分解吸收,取而代之的是新生骨和血管。由此可见,MCA 在骨缺损部位可以缓慢降解,促进新生骨和血管的形成。
在本研究中,为了评价MCA 对骨再生的影响,在SD大鼠颅骨临界骨缺损中植入MCA。使用MCA 修复颅骨临界骨缺损2 周时,HE 染色结果显示MCA 被分割成多个小的MCA团块,同时有细胞向MCA内部生长以及新生血管形成,这对骨再生至关重要[22]。第4 周时,骨缺损处残留少许MCA,同时出现新生骨。新骨的形成不是从原生骨的断裂端开始,而是从缺损中心开始,说明新骨的形成是由MCA 诱导的。移植8 周后,Micro-CT 和HE 染色结果分析显示,MCA组缺损处再生出许多新生骨和血管。这一结果可以证明MCA 具有很好的骨传导性和成骨特性,可以促进营养物质和成骨细胞向水凝胶内部转移。与MCA 组相比,ALG组和对照组的缺损区域主要为纤维组织填充,仅在边缘处有极少量的新骨形成。
在这项工作中,体内实验结果表明MCA 显著改善了临界尺寸颅骨缺损的骨再生。然而,MCA 仍有不足之处。与水凝胶相关的最突出的问题是机械强度不足,这使得水凝胶不适合用于承重部位的骨缺损修复[23]。第8 周时骨再生明显,但仍有少部分缺损未被修复,这一结果的原因可能是MCA的迁移和骨再生所需原料的需求量增加[15]。在后续研究中,可以在未修复的缺损处再次注射MCA,观察其再修复的效果。另外,还可以增加MCA中MC的含量,研究增加MC含量后对水凝胶交联程度的影响,并与MCA再注射相对比,比较两种方式的骨修复效果。
本研究将ALG 溶液与MC 两者结合制备出流体状MCA水凝胶,注射至骨缺损部位后,体内的Ca2+与流体状MCA 水凝胶中的ALG 通过交联效应在骨缺损处原位形成固态MCA 水凝胶。MCA 在活体内表现出良好的生物相容性和促进骨再生能力,是一种安全可靠的骨修复材料。

