LncRNA在急性痛风性关节炎发病中的表达研究*
张丽萍,何志艳,苏东文,鲍艳媛,谢招虎,向 前,李兆福,4△
(1.云南省滇南中心医院红河哈尼族彝族自治州第一人民医院,云南 个旧 661000;2.云南中医药大学,云南 昆明 650500;3.弥勒市人民医院,云南 弥勒 652300;4.云南中医药大学第一附属医院,云南 昆明 650021)
痛风性关节炎(gouty arthritis,GA)是因尿酸排泄功能异常和(或)嘌呤代谢异常引起血尿酸升高,单钠尿酸盐晶体在关节、滑膜或其它组织、器官等部位沉积,沉积部位出现红、肿、热、痛的急性炎症反应,属于晶体性关节炎范畴[1]。随着经济的发展,人民生活水平的提高,近年来痛风的发病率逐年上升。流行病学显示,痛风患者男女性别之比为15 ∶1,发病的平均年龄为48.28岁[2],不同种族痛风的发病率约为0.03%~15.3%[3],在中国,痛风患病率约为1%~3%,并且发病呈逐渐上升和年轻化趋势[4]。GA 具有致残性,且高尿酸血症和心脑血管、痛风性肾病等疾病的发病关系密切,已成为世界范围内医疗领域关注的焦点之一。
既往研究提示GA 的发病和炎症反应、高尿酸血症息息相关,但GA 的发病机制尚未完全被人们所知晓。研究发现长链非编码RNA(long noncoding RNA,LncRNA)与多种炎症信号通路有关,并且参与了多种代谢性疾病和风湿免疫病的发生发展[5-6]。有学者研究发现GA 的急性发作可能和LncRNA 的表达谱有关[7],LncRNA 的异常表达可能是GA 急性发作的关键因素之一,其可能参与了GA 发作的炎症反应过程。因此,从LncRNA 的表型差异角度探讨痛风的发病及防治可能是以后中西医研究的关键点。基于此,本研究拟探讨LncRNA 的表型在AGA 发病中的作用,为临床提供依据。
1 材料与方法
1.1 试验标本 符合纳入标准的AGA(湿热蕴结型)患者及非痛风性关节炎健康人(healthy control,HC)的血液标本。
1.2 试验仪器和试剂 50 mL、15 mL、1.5 mL 普通离心管;50 mL 高效离心管;高原真空采血管(10 mL枸橼酸钠);各量程移液器;吸头(1 000 μL、200 μL等);PCR 管(0.2 mL、1.5 mL);Sep Mate TM tube(15 mL、50 mL);-81℃冰箱;普通冰箱(4℃、-20℃);制冰机;漩涡振荡仪;超净工作台;高速冷冻离心机;淋巴细胞分离液;FBS;DPBS;Trizol 总RNA 提取试剂盒;PCR 相关引物;乙醇;氯仿。
2 试验方法
2.1 病例来源 选择来自门诊的符合病例纳入标准的AGA 患者5 例和来自门诊体检的HC 5 例。
2.2 方法 AGA 患者5 例,予清热通络方配方颗粒(江阴天江药业有限公司)治疗5 d,药物由淡竹叶10 g,石膏30 g,南沙参20 g,黄柏15 g,薏苡仁30 g,法半夏15 g 等10 余味药物组成(每剂320 g);HC 组5例不予任何处理;AGA 服药后转为NAGA(Non-acute gouty arthritis)组。采集AGA 组、HC 组、NAGA 组的外周空腹静脉血7 mL(EDTA-K2 抗凝)。
2.3 标本采集和处理
2.3.1 PBMC 的分离 将7 mL 的新鲜血液用移液器转入50 mL 离心管中,加入同等量的DPBS 后轻轻摇晃使2 者混匀;将50 mL 高效离心管置于离心管架上,用移液器将淋巴细胞分离液缓慢加入高效离心管中间的小孔中,连续缓慢加入淋巴细胞分离液,直至液面没过离心管的隔板;将和DPBS 混匀后的血浆沿着高效离心管的管壁缓慢加入高效离心管中后静置5 min;称取上一步高效离心管的重量,配平后放入高效离心机进行离心(3 500 r/min,离心20 min);离心结束后将离心管缓慢取出置于离心架上,可见高效离心管分为4 个层面(最底层为沉积的红细胞,倒数第2 层为分离液,倒数第3 层为PBMCs,倒数第4层为血清),此时用移液枪吸去最顶层的淡黄色液体,将倒数第3 层的PBMCs 移入15 mL 离心管中;15 mL 离心管的重量,配平后离心机离心(3 500 r/min,离心5 min);离心结束后倒去上清液,留下离心管最底层的白色沉积物;用1 mL 的DBPS 将离心管底层的白色沉积物吹散,配平后,重复上述过程再离心一次;倒去离心后的上清液,留下白色沉积物,用1 mL DPBS 吹散后,转入1.5 mL 的离心管中;配平后放入小型离心机继续离心(3 500 r/min,离心5 min);离心结束弃其上清液,用枪头吸干白色沉积物周围的液体,之后用振荡器振开沉积物,并加入1 mL RNA 裂解液,吹打均匀至细胞完全裂解,室温静置5 min,标记好信息后放入-81℃冰箱冻存。
2.3.2 总RNA 的提取 取出保存在-81℃中的PBMCs,室温静置5 min;加200 μL 氯仿至解冻的PBMCs中,并震荡15 s 以便核酸、核蛋白能完全分离,室温静置10 min;配平后离心(12 000 r/min,离心15 min),离心后可见液体分为3 层,吸取最上层(含有RNA)至新的1.5 mL 的EP 管;往装有RNA 的1.5 mL EP 中加入等量的异丙醇,混匀后室温静置10 min;配平后离心机离心(12 000 r/min,离心10 min);离心结束后吸去上清液,加75%的乙醇1 mL 至1.5 mL 的EP 管中,震荡混合均匀后,低温离心(12 000 r/min,离心5 min);离心后吸去上清液后将离心管倒置风干;加入30 μL 左右的无酶水,混匀后室温静置10 min 使RNA 充分溶解后保存到-81℃冰箱中。
2.3.3 基因检测 由上海康成生物工程有限公司完成。(1)检测RNA 质量:降解RNA 并用Agilent ND-1000 检测降解是否完全及测定浓度。(2)RNA 的标记、杂交:用Arraystar RNA Flash Labeling Kit 对RNA 样本进行标记,用Agilent SureHyb 对样本进行杂交实验。(3)采集数据和对数据进行标准化处理:洗涤芯片后,用Agilent DNA Microarry Scanner 扫描芯片,读取数值后获得原始数据。用软件Agilent Feature Extraction(v11.0.0.1)采集芯片的探针信号。用Agilent GeneSpring GX v12.1 软件对芯片的数据进行标准化处理。(4)挑选差异表达LncRNAs:用v12.1 软件选取差异表达的LncRNA(2 组样本间差异表达的筛选条件为:P<0.05 和Fold Change>2)。
2.4 统计分析 采用SPSS 23.0 统计软件,符合正态分布或近似正态分布,两组之间进行比较采用独立样本t 检验,计量资料用(±s)表示;不符合正态分布用秩和检验,以中位数(P25,P75)即[M(P25,P75)]表示,P<0.05 具有统计学意义。
3 结果
3.1 病例一般情况分析 本部分研究共纳入5 例AGA 患者及5 例HC,所有入组对象均为男性,纳入对象的年龄无统计学差异(P>0.05),详见表1。
表1 入组对象基本情况比较(±s)
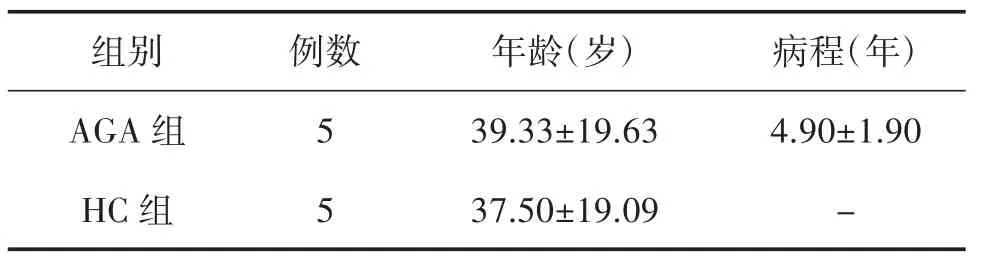
表1 入组对象基本情况比较(±s)
注:AGA 组和HC 组比较,P>0.05。
?
3.2 AGA 组和HC 组的LncRNA 表型差异情况 分别提取AGA 组和HC 组PBMC 中总RNA 并进行基因芯片测序,按照设定的筛选条件(P<0.05 和Fold Change>2),和HC 组比较,AGA 组具有表型差异的LncRNA 共有2 364 条,其中1 174 条表达上调,1 190 条表达下调。AGA 组表达上调的前10 位见表2,表达下调的前10 位见表3,具有表型差异的火山图见图1、聚类分析图见图2。
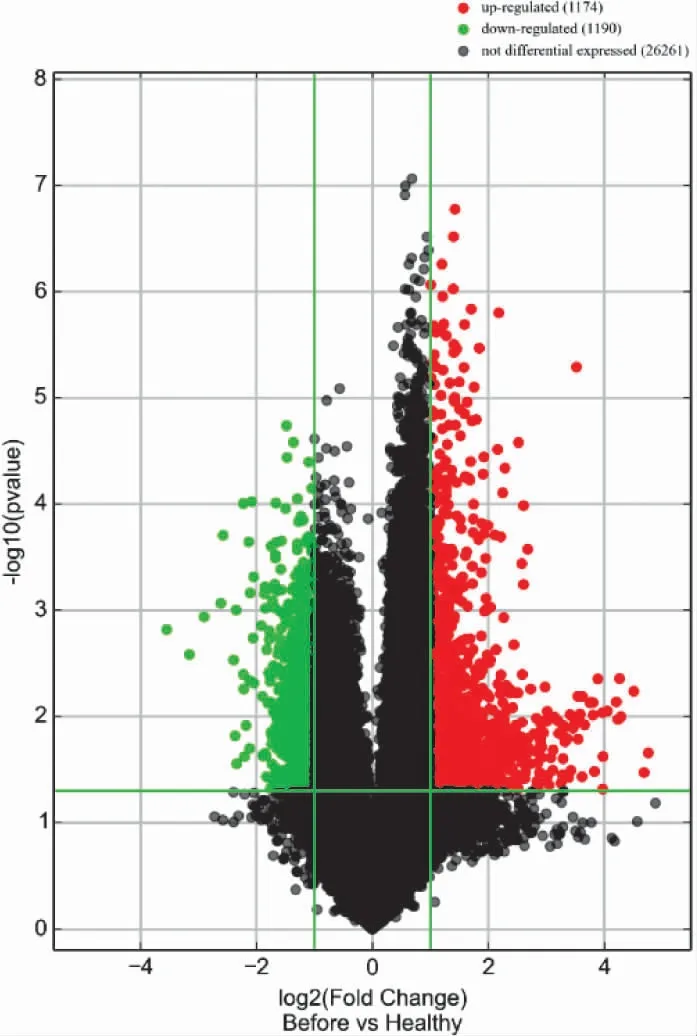
图1 和HC 组比较,AGA 组有表型差异的火山图
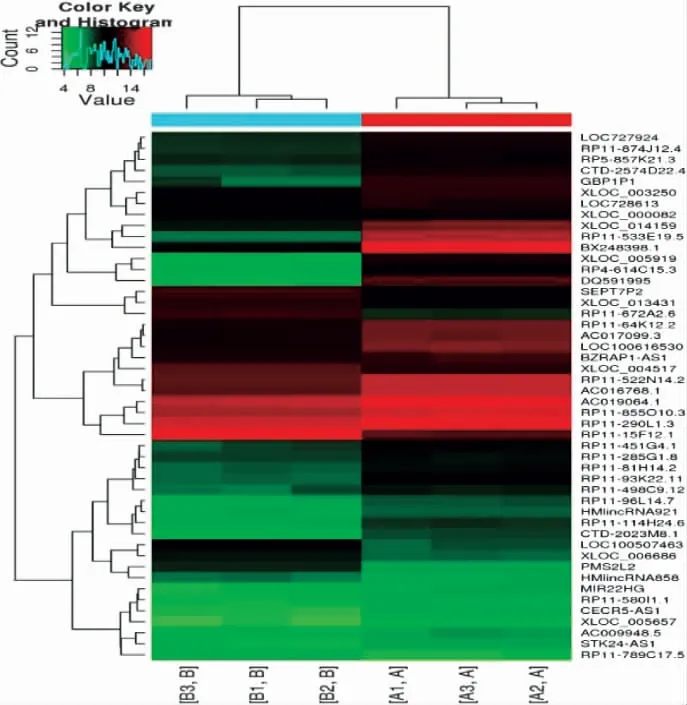
图2 和HC 组比较,AGA 组有表型差异的聚类分析图
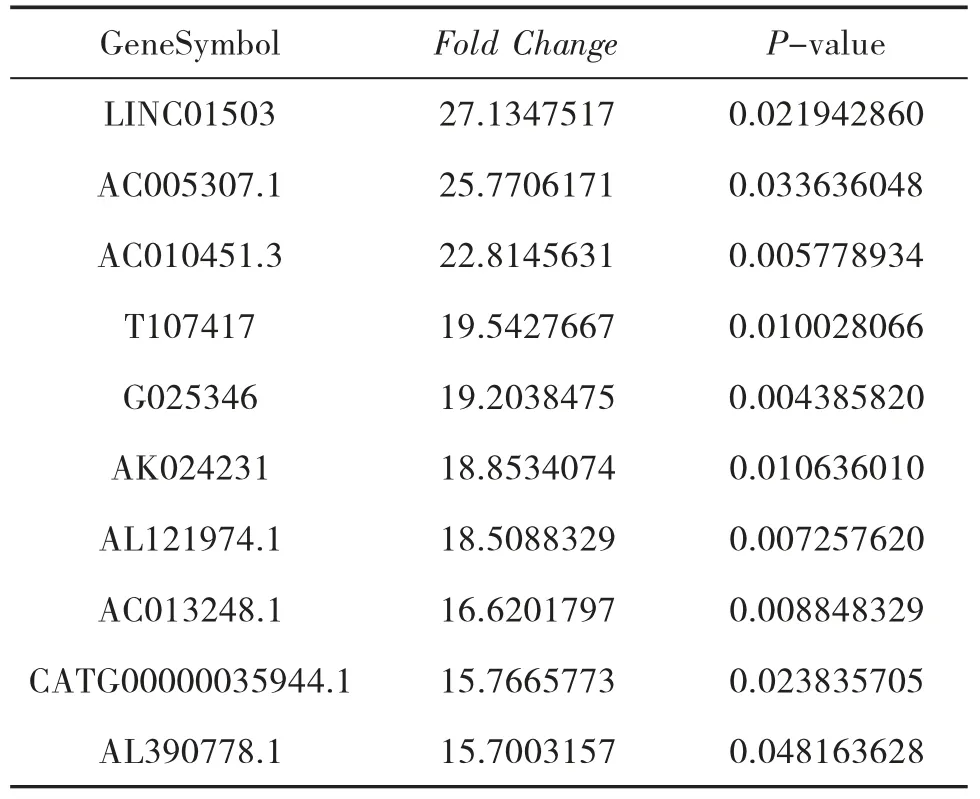
表2 和HC 组比较,AGA 组表达上调的LncRNA
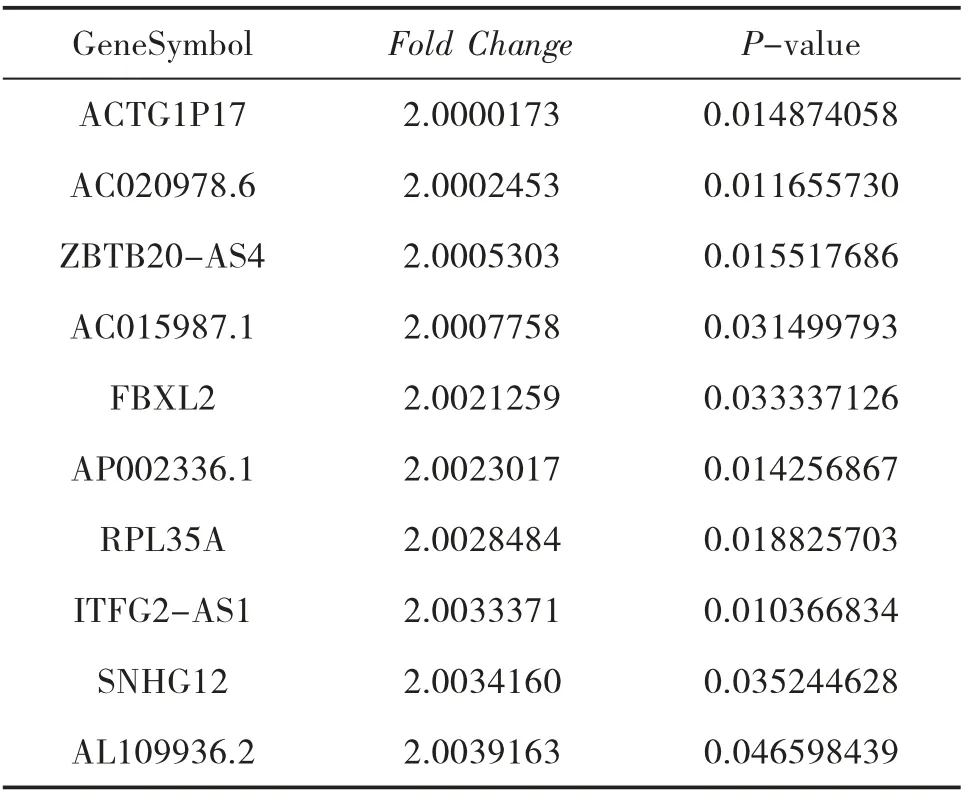
表3 和HC 组比较,AGA 组表达下调的LncRNA
3.3 NAGA 组和HC 组的LncRNA 表型差异情况 提取NAGA 组PBMC 中总RNA 并进行基因芯片测序,按照设定的筛选条件(P<0.05 和Fold Change>2),与HC 组比较,NAGA 组具有表型差异的LncRNA 共有802 条,其中147 条表达上调,655 条表达下调。NAGA 组表达上调的前10 位见表4,表达下调的前10位见表5,具有表型差异的火山图见图3、聚类分析图见图4。
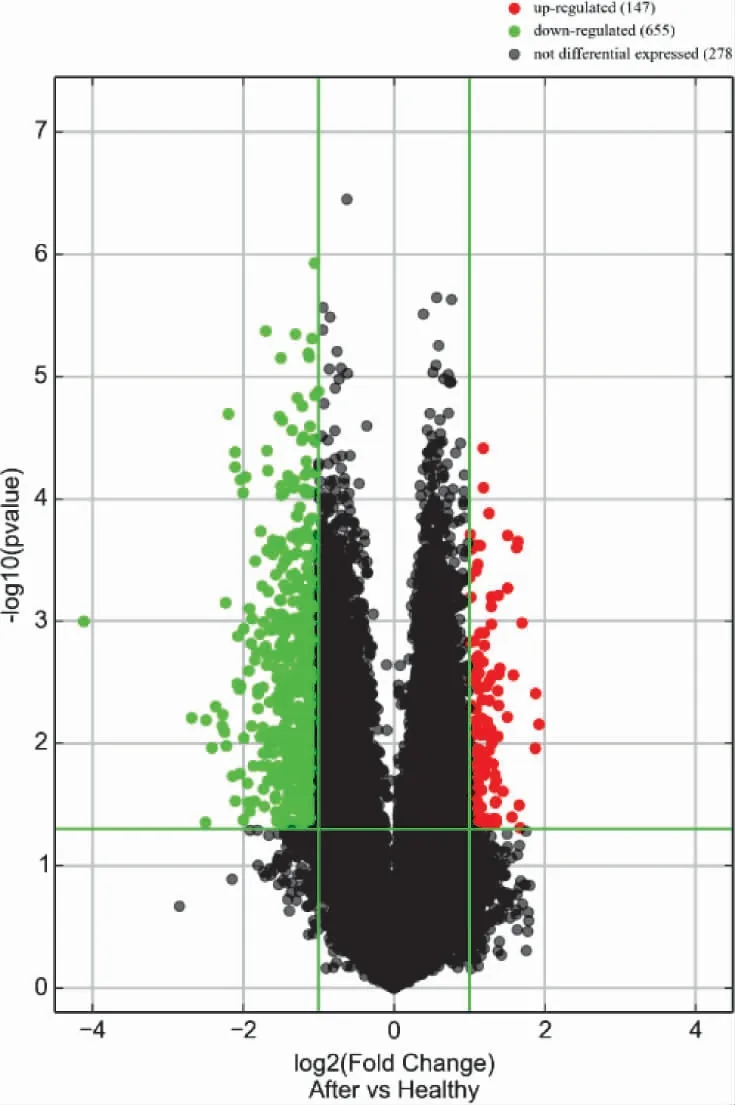
图3 和HC 组比较,NAGA 组有表型差异的火山图

图4 和HC 组比较,NAGA 组有表型差异的聚类分析图

表4 和HC 组比较,NAGA 组表达上调的LncRNA
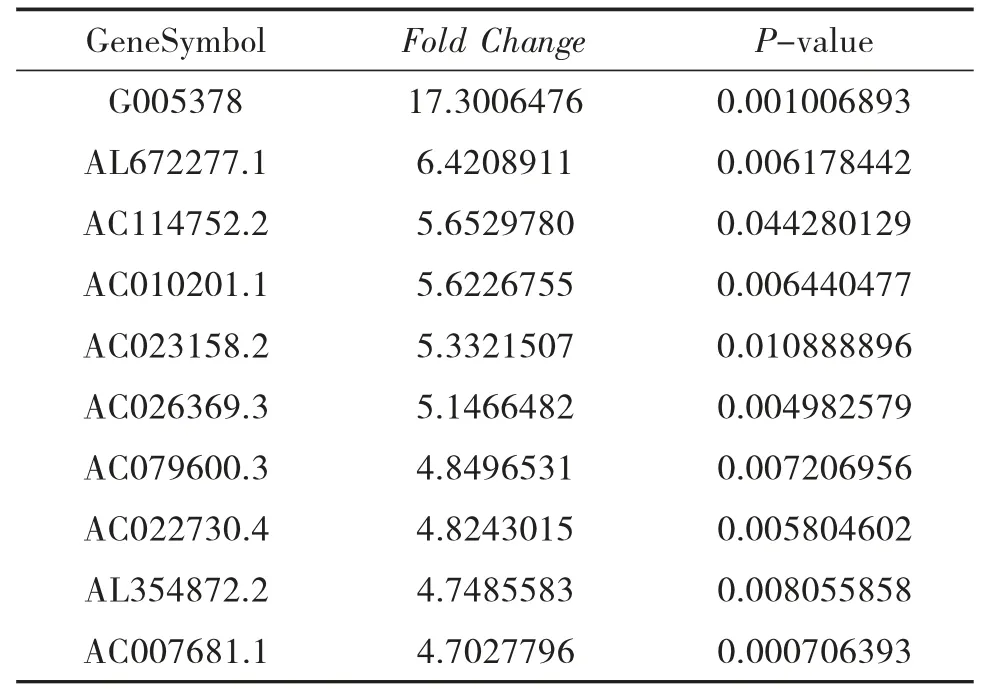
表5 和HC 组比较,NAGA 组表达下调的LncRNA
3.4 NAGA 组和AGA 组的LncRNA 表型差异情况 通过和AGA 组比较,按照设定的筛选条件(P<0.05 和Fold Change>2),NAGA 组具有表型差异的LncRNA 共有171 条,其中30 条表达上调,141 条表达下调。表达上调的前10 位见表6,表达下调的前10位见表7,具有表型差异的火山图见图5、聚类分析图见图6。
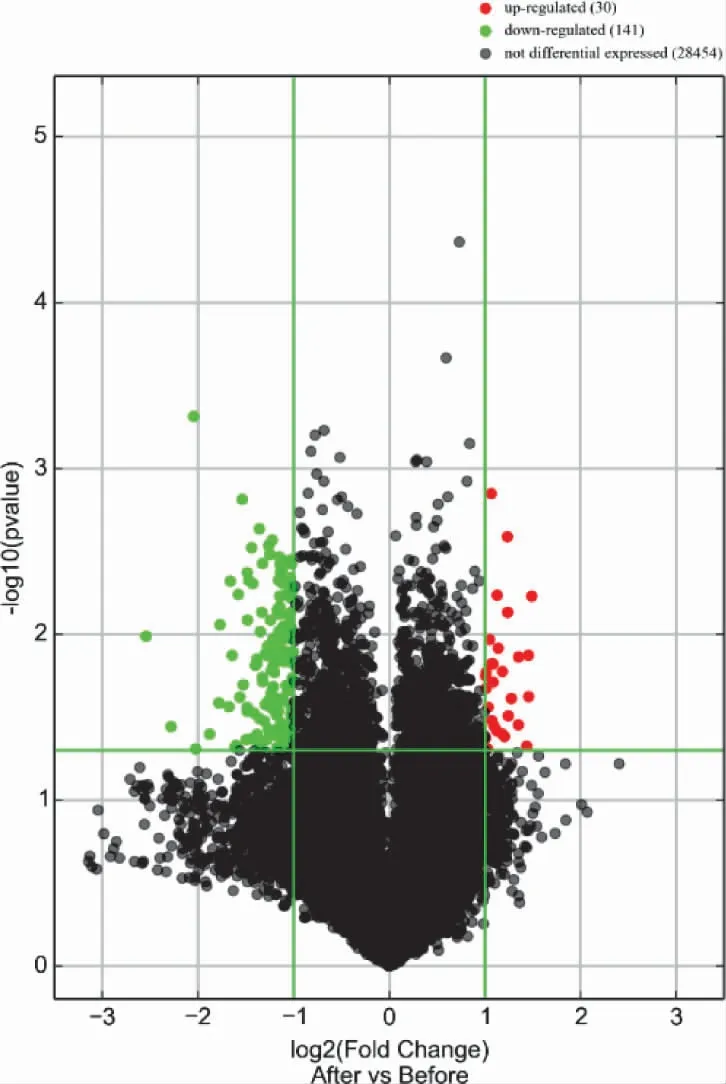
图5 和AGA 组比较,NAGA 组有表型差异的火山图
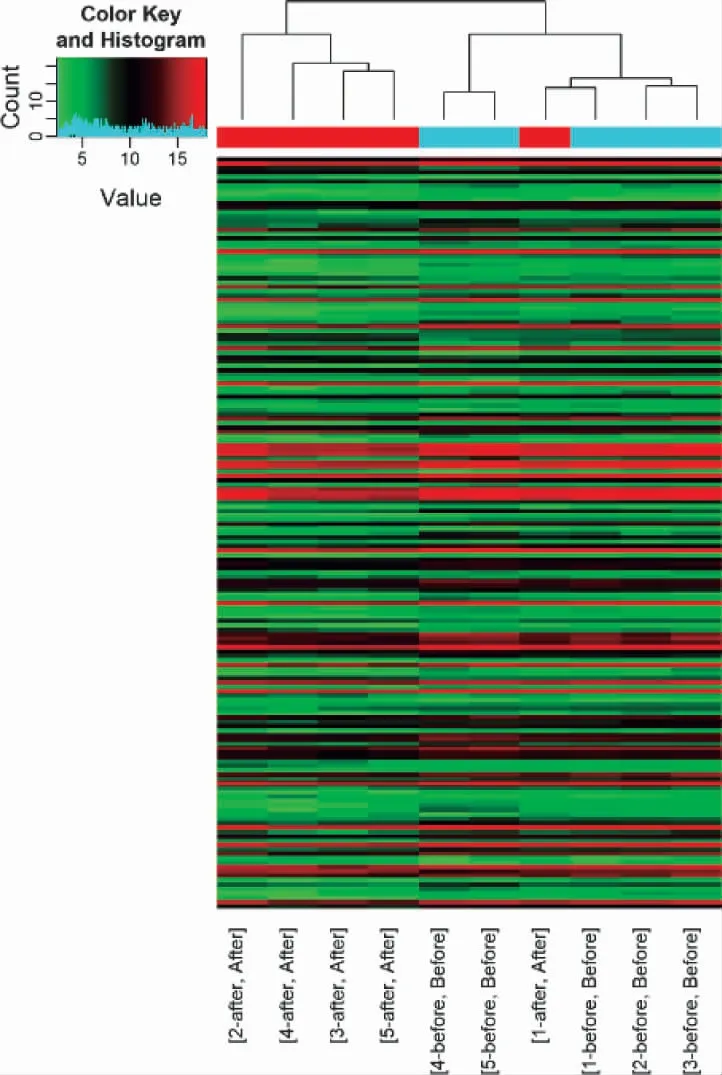
图6 和AGA 组比较,NAGA 组有表型差异的聚类分析图
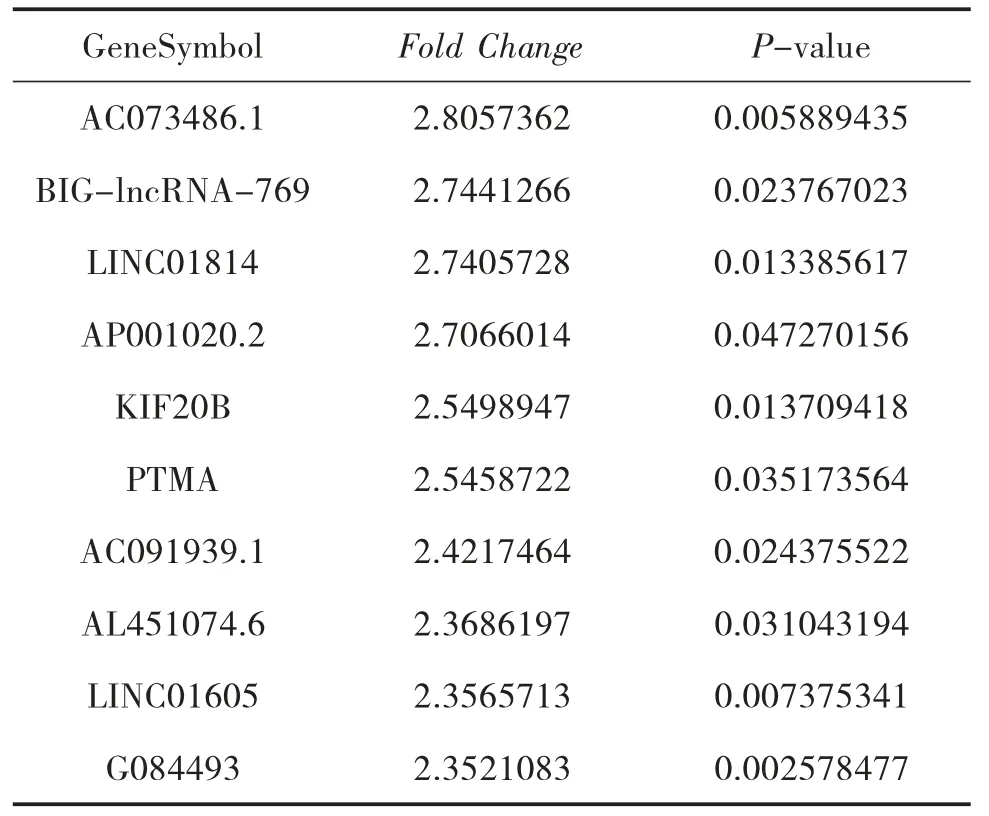
表6 和AGA 组比较,NAGA 组表达上调的LncRNA
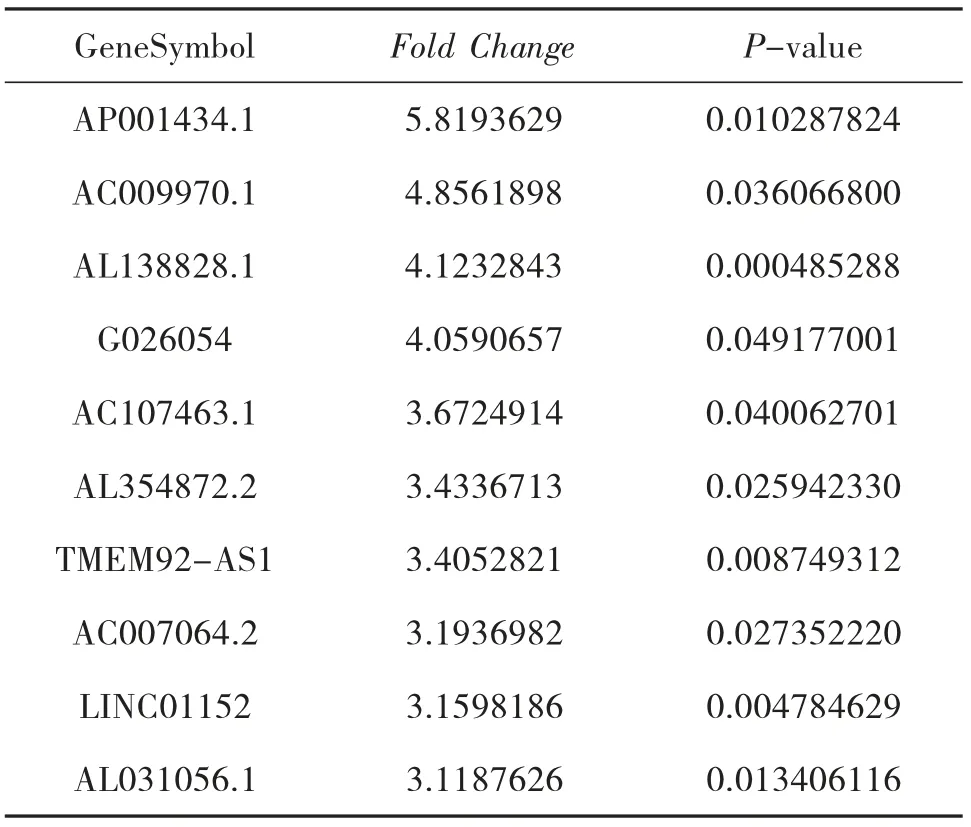
表7 和AGA 组比较,NAGA 组表达下调的LncRNA
3.5 AGA 组和NAGA 组具有关联的LncRNA 用维恩图(VENNY2.1)构建AGA 组、NAGA 组、HC 组三组之间的联系,通过对比我们发现AGA 组、NAGA 组共有79 条LncRNA 存在关联。在AGA 组表达下调,而在NAGA 组表达上调的LncRNA 共有11 条;在AGA组表达上调,而在NAGA 组表达下调的LncRNA 共有68 条;排名前10 位的LncRNA 情况见表8、表9;三组之间的思维导图见图7。

图7 AGA 和NAGA 具有关联的LncRNA 思维导图

表8 AGA 组和NAGA 组具有关联的LncRNA 情况1
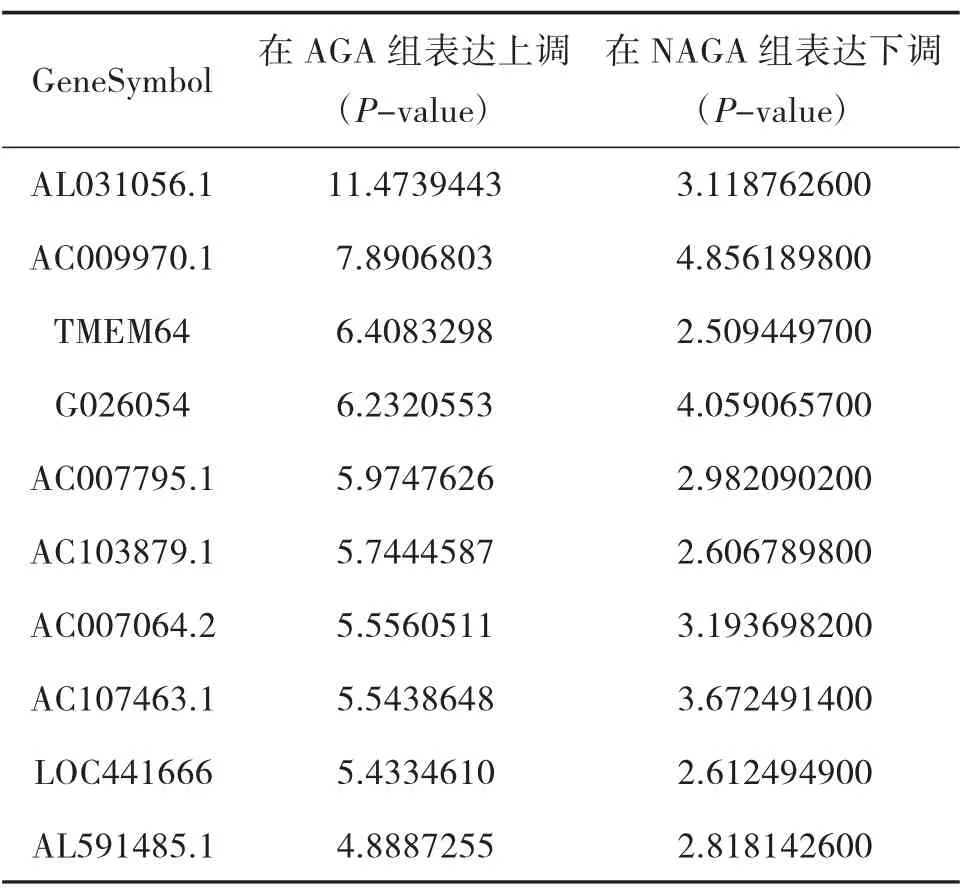
表9 AGA 组和NAGA 组具有关联的LncRNA 情况2
4 讨论
本研究结果显示:(1)AGA 患者和HC 的LncRNA 表达谱具有明显差异,AGA 患者有表达差异的LncRNA 共有2 364 条,1 174 条表达上调,1 190 条表达下调,其中LINC01503 较HC 表达上调了27 倍,T024665 较HC 表达下调了11 倍。(2)NAGA 患者和HC 的LncRNA 表达谱有明显差异,NAGA 患者有表达差异的LncRNA 共有802 条,147 条表达上调,655条表达下调,其中AL031056.1 较HC 表达上调了3.7倍,G005378 较HC 表达下调了17 倍。(3)AGA 患者和NAGA 患者的LncRNA 表达谱具有明显差异,具有表达差异的LncRNA 共171 条,AGA 患者表达上调的有30 条,NAGA 患者表达下降的有141 条,AGA患者表达上调倍数最高的LncRNA 为AC073486.1,其上调了2.8 倍,AP001434.1 是NAGA 患者下调倍数最高的,下调了5.8 倍。(4)通过构建AGA 组、NAGA 组、HC 组3 组之间的联系,我们发现存在关联的LncRNA 共有79 条。11 条LncRNA 在AGA 组表达下调,而在NAGA 组表达上调,其中AC100814.1在AGA 组下调3 倍,在NAGA 组表达上调了2.7 倍;68 条LncRNA 在AGA 组表达上调,在NAGA 组表达下调,其中AL031056.1 在AGA 组上调11 倍,在NAGA 组表达下调了3 倍。研究提示LncRNA 的表型差异可能和痛风的急性发作有关。
传统中医并没有GA 的病名,根据本病的发病特点和临床表现,大多归属于中医“脚气”“白虎病”“痹证”“历节”等范畴[8]。诸多中医学者虽对GA 有不同的认识,但不难发现,GA 的急性发作主要和脾虚、湿热、痰瘀等因素密切相关[9-14]。
LncRNA 是长度不低于200 个核苷酸,没有蛋白编码功能的非编码RNA 分子序列,是基因转录组的重要组成部分[15]。LncRNA 种类繁多、数量庞大,可以通过多种形式参与调控基因的表达模式,在表观遗传、转录、转录后及蛋白编码水平发挥着重要作用[16]。有研究提示LncRNA 与多种炎症信号通络有关,随着基因组学的发展,越来越多研究发现LncRNA 参与了炎症反应、免疫类疾病、肿瘤疾病的发生、发展[17]。
GA 是具有遗传倾向的和多种外界因素有关的复杂性疾病[18],在LncRNA 和GA 的研究中发现,LncRNA 的表达谱和GA 的发病有关[19],但目前国内关于LncRNA 表达谱和GA 发病机制的报道不多,目前人们对它在GA 发病过程中的所扮演的角色及作用机制尚未明确,期待后续有更多的学者加入该研究,以期从新的途径了解GA,找到有效诊治及预防该病的方法。

