巨噬细胞表型转换对系统性硬化症胞葬功能的调控机制研究*
杜萌萌,康冰心,李松伟
(1.河南中医药大学第一附属医院,河南 郑州 450000;2.河南省中医院,河南 郑州 450000)
系统性硬化症(systemic sclerosis,SSc)是一种以局部或广泛性皮肤增厚和纤维化为征象的自身免疫性疾病[1]。本病起病隐匿,患病早期因症状不明显常常被忽视,晚期容易累及多器官系统及组织(如皮肤、心、肺、肾、消化道等),并发多系统的纤维化,预后较差,致死率高,已经成为当今社会的临床难点和研究热点,因此阐明其发生机制及调控因素具有重要的临床意义[2-3]。
胞葬作用是系统性硬化症出现自身免疫逃逸、炎症和纤维化的主要诱导因素[4]。巨噬细胞极化可以影响细胞表面受体的表达,引起巨噬细胞表型转换,而巨噬细胞表型转换是调控胞葬作用的关键机制[5-6]。阐明系统性硬化症疾病进程中巨噬细胞表型转换对胞葬功能的调控机制,是防治该种疾病的关键。本研究采用HE 染色、反转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)、酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA)、流式细胞术等检测方法,观察系统性硬化症疾病进程中巨噬细胞表型转换、胞葬功能和炎性纤维化因子的协同关系,探究巨噬细胞表型转换调控胞葬功能对系统性硬化症疾病进展的影响,阐明系统性硬化症疾病进展的病理机制,为该疾病的临床治疗提供新的干预思路和有效靶点。
1 材料与方法
1.1 实验动物 选用清洁级BALB/c 雌性小鼠80只,鼠龄6~8 周,体质量20 g(斯贝福)。
1.2 药物 注射用盐酸博来霉素溶液:用移液枪吸取博来霉素原液(日本化药株式会社生产;批号:740130)100 μL,于10 mL 磷酸盐缓冲液(phosphate buffer saline,PBS)中混匀,配制成1 000 μg/mL 浓度的博来霉素溶液,分装后放置于-80 ℃保存。
1.3 分组及造模 将80 只BALB/c 小鼠随机分为空白组和模型组,分笼普通饲料喂养,背部脱毛处理。脱毛区中央,空白对照组背部注射生理盐水0.1 mL/(200 g·d),系统性硬化症模型组背部注射博来霉素0.1 mL/(200 g·d)。
1.4 取样及检测指标 每组分别于注药后第7、14、21、28 d 取样6 只,7%水合氯醛(360 mg/kg)腹腔注射麻醉,颈椎离断处死。
HE 染色:取造模部位皮肤组织100 mg,10%多聚甲醛固定、二甲苯脱蜡,梯度乙醇脱水,石蜡包埋、切片。苏木精染色,盐酸乙醇分化,氨水返蓝,伊红染色,自来水冲洗,脱水,透明,晾干,封片,于显微镜下观察皮肤局部病理改变,测量真皮厚度。
荧光TUNEL:取造模部位皮肤组织100 mg,10%多聚甲酸固定、二甲苯脱蜡,梯度乙醇脱水,石蜡包埋、切片。水化后,PBS 反复浸洗,加100 μL TUNEL反应混合液于标本上,加盖玻片在37℃暗湿盒中反应1 h,反应终止后进行酶标、PBS 浸洗、DAB 显色(避光),然后进行苏木素复染、封片。光学显微镜下观察,绿色为凋亡细胞,用Image proplus 6.0 软件处理分析,统计细胞凋亡指数(apoptosis index,AI)。
ELISA:抽取心包血1 mL,3 000 r/min 离心,取上清。将稀释好的标准品和样品进行孔板加样,37℃孵育90 min;吸板、加生物素标记抗体、洗板、加过氧化物酶标记的亲和素(ABC)、洗板、加底物(TMB)和终止液,根据酶标仪器操作方法,上机检测OD 值(450 nm)处,血清胞葬桥连分子(GAS6 和MFG-E8)及血清炎症因子(IL-17、IL-6、TNF-α、MMP-9 和TGF-β1)的表达水平。
RT-PCR:造模部位皮肤进行液氮急冻,RT-PCR检测模型组、空白对照组小鼠皮肤组织中巨噬细胞极化因子Arg-1、iNOS 的mRNA 水平。采用Trizol 试剂分别提取两组小鼠皮肤组织总RNA,逆转录合成cDNA,加入正向和反向引物以及SYBR 后,实时定量PCR 进行扩增。根据q-PCR 引物设计相关原则设计相应的目的基因和内参基因的上游、下游基因(引物序列见表1),以β-actin 为内参,用相对定量方法(2-△△Ct)计算目的基因mRNA 的相对表达量。
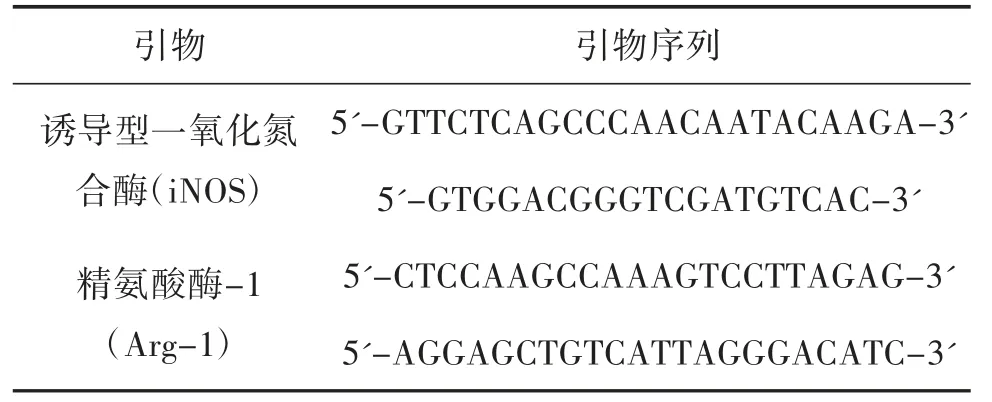
表1 引物序列
流式细胞术:注药后第28 天每组分别取样6 只,抽取心包血1 mL,流式细胞术检测心包血全血细胞表面受体(清道夫受体SR-B1、SR-A1 和ITGβ5)的表达水平。
胞葬功能评价:注药后第28 天每组分别取样10只,提取空白组和模型组小鼠原代骨髓巨噬细胞和Jurkat 细胞(J),诱导Jurkat 细胞(J)凋亡,分为空白M0 型巨噬细胞+Jurkat 细胞组(M0+J)、空白M0 型巨噬细胞+凋亡Jurkat 细胞组(M0+appJ)、M1 型巨噬细胞+Jurkat 细胞组(M1+J)、M1 型巨噬细胞+凋亡Jurkat 细胞组(M1+appJ),将巨噬细胞和Jurkat 细胞共培养90 min,转速3 000 r/m,离心5 min 取上清,流式细胞术评估胞葬作用,用吞噬指数(phagocytosis index,PI)评估巨噬细胞对Jurkat 细胞的胞葬能力。
1.5 统计学分析 采用统计学软件SPSS 25.0 进行数据分析。计量资料以均数±标准差(±s)表示,用重复测量数据的方差分析检验多组间多时间点各指标变化差异,采用单因素方差分析检验多组间各指标变化差异,组间及组内两两比较均采用LSD-t 检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 HE 染色、荧光TUNNEL 组间比较:模型组小鼠与对照组相比,皮肤真皮层厚度明显增加,胶原纤维增生,炎症细胞浸润,巨噬细胞凋亡指数、凋亡细胞密度增加。组内比较:空白组皮肤组织在各个观察时间点均未见明显改变,组织结构完整,真皮稍有增厚,无明显炎症细胞浸润及巨噬细胞凋亡改变。模型组出现真皮厚度、胶原纤维增生、炎症细胞浸润现象,且巨噬细胞凋亡指数、凋亡细胞密度增加,呈时间依赖性,见图1、图2。
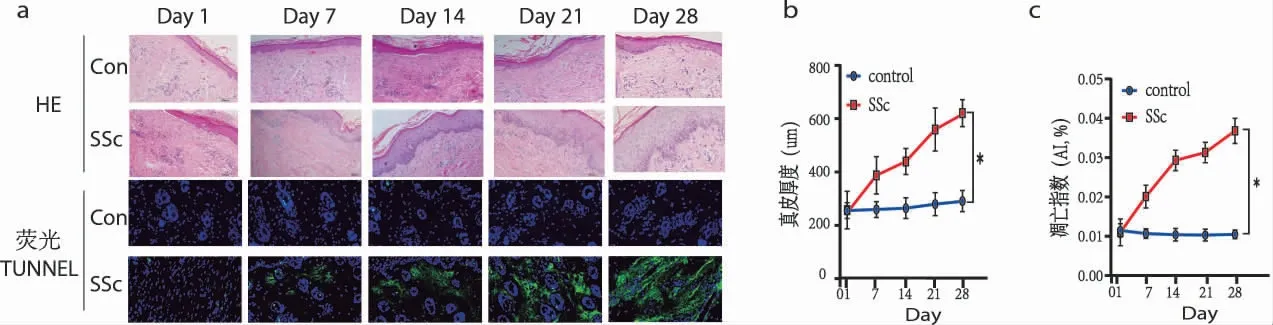
图1 皮肤组织HE 及荧光TUNNEL 染色(×200)
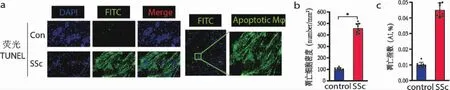
图2 荧光TUNEL 检测皮肤组织巨噬细胞凋亡
2.2 ELISA 组间比较:模型组与空白组对比具有统计学意义。组内比较:空白组血清中IL-17、IL-6、TNF-α、MMP-9、TGF-β1、GAS6 和MFG-E8 的表达在各个时间点均无明显变化;模型组血清中炎性纤维化因子表达升高、胞葬桥连分子表达下调,且均呈时间依赖性。见图3。
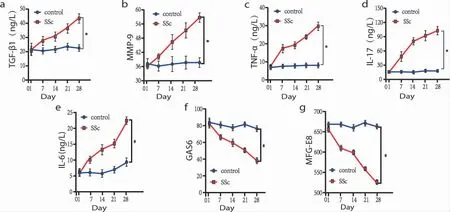
图3 ELISA 检测血液上清细胞因子表达水平
2.3 RT-PCR 检测 组间比较:与空白对照组比较,模型组皮肤组织中Arg-1 mRNA 的表达水平下调,而iNOS mRNA 的表达上调(P<0.05)。组内比较:空白组皮肤组织中iNOS、Arg-1 mRNA 的表达在各个时间点均无明显变化,模型组皮肤组织中iNOS mRNA 的表达上升,Arg-1 mRNA 的表达下调,具有时间依赖性。见图4。
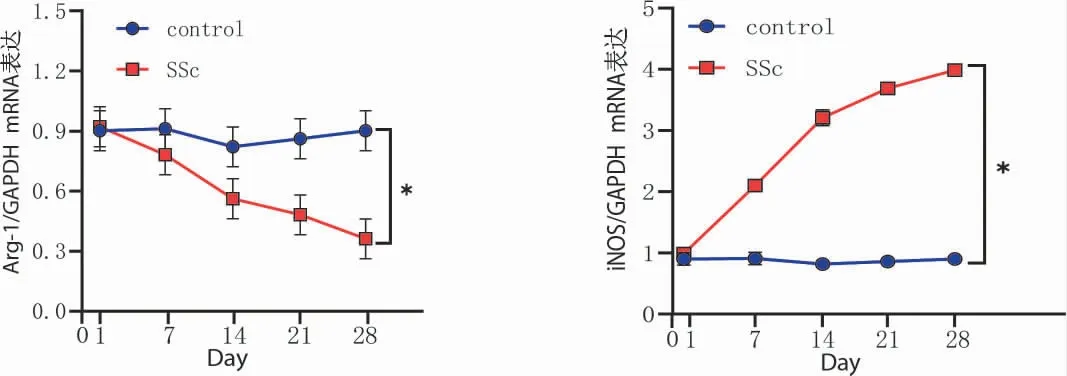
图4 皮肤组织蛋白相对表达量
2.4 流式细胞术 与空白对照组相比,SSc 模型组小鼠心包血分化巨噬细胞的PI 下降;空白组、模型组对凋亡Jurkat 细胞的胞葬能力均高于对Jurkat 细胞的胞葬能力;模型组巨噬细胞PI 较空白对照组降低,P<0.05。与空白对照组相比,模型组细胞表面清道夫受体SR-B1、SR-A1 和ITGβ5 的表达下调,具有统计学意义(P<0.05)。见图5。
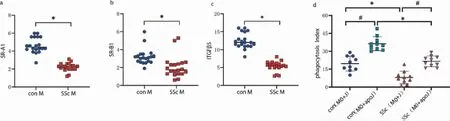
图5 巨噬细胞清道夫受体、胞葬能力表达水平
3 讨论
SSc 是自身免疫紊乱的一种病理反应,以局部或广泛性皮肤增厚与纤维化为征象,病变部位主要集中在皮肤、肺、肾等多组织器官。本研究中,SSc 模型组HE 染色显示模型组小鼠背真皮厚度较对照组皮肤明显增加(P<0.05),且模型组的皮脂腺、毛囊等皮肤附属器明显减少,脂肪层厚度变薄并被纤维组织包绕,符合SSc 病理表现。荧光TUNNEL 显示模型组小鼠病变局部皮肤除了纤维化改变之外,伴随巨噬细胞凋亡,巨噬细胞凋亡指数升高、凋亡细胞密度增加等病理表现。研究表明,在SSc 的病变过程中,机体炎性改变会导致巨噬细胞向促炎表型M1 型转化,进而引起细胞凋亡、皮肤纤维化改变。
SSc 发病机制尚未完全明确,推测可能与炎症反应、细胞外基质沉积、免疫紊乱、环境等多种因素相关,自身免疫导致的炎症和细胞因子失调是其最关键的病理机制[7]。最新研究表明,巨噬细胞是SSc 免疫功能的关键效应细胞,也是SSc 皮肤纤维化过程中最重要的调控因素,巨噬细胞凋亡会导致机体免疫下降,巨噬细胞极化诱导促炎和促纤维化介质释放,导致皮肤组织胶原堆积和纤维化[8-9]。此外,巨噬细胞的凋亡也会引起免疫微环境的紊乱,导致巨噬细胞极化,巨噬细胞可以分化为促炎(M1 型)和抑炎(M2 型)两种表型[10-11]。在发病早期,M1 型巨噬细胞招募炎性细胞以对抗病原体,发挥促炎效果,起主导作用;等病原消灭后,M2 型巨噬细胞抑制炎性细胞的募集,发挥抗炎效果,起主导作用[12]。持续不断的M1 型活化会造成组织损伤,导致免疫、炎症和纤维化改变。在本研究中,皮肤组织中M1 型巨噬细胞极化标志物iNOS 的mRNA 表达上调、M2 型巨噬细胞极化标志物Arg-1的mRNA 表达下调,表明在SSc 患者M1 型巨噬细胞极化因子分泌增加,巨噬细胞向M1 型定向极化,进而促进了炎性、纤维化因子表达上调和免疫紊乱,导致SSc 病情进展。M1 型促炎细胞会引起机体炎性改变,因此,在M1 型巨噬细胞极化过程中,血清IL-17、IL-6、TNF-α、MMP-9、TGF-β1 等炎症、纤维化因子表达上调(P<0.05),表明在SSc 发病过程中,巨噬细胞以M1 型极化为主,M1 型极化与炎性改变呈正相关,引起纤维化改变,导致SSc 疾病的发生发展。
胞葬作用(efferocytosis)是指吞噬细胞将衰老、死亡的细胞吞噬、降解,防止继发坏死、炎症的过程,是维持正常生理学中组织内稳态和疾病后恢复内稳态的关键因素[13-14]。生理状态下,巨噬细胞通过胞葬作用有效清除凋亡细胞(apoptotic cell,AC)及其有害释放因子,维持机体正常的免疫稳态。在胞葬过程“eat me”阶段,巨噬细胞通过细胞表面清道夫受体与AC表面的桥连分子生长停滞特异性蛋6(recombinant growth arrest specific protein 6,GAS6)和乳脂球表皮生长因子8(milk fat globule epidermal growth factor 8,MFG-E8)结合,加速吞噬体组装和酸化,从而促进AC 降解,见图6[15]。巨噬细胞表面受体(尤其是清道夫受体)及其桥连分子的表达水平是调节胞葬作用的关键分子。阐明系统性硬化症疾病进展过程中,清道夫受体及其桥连分子对巨噬细胞极化及胞葬功能的调控机制,是防治该种疾病的关键。在SSc 疾病进展过程中,巨噬细胞表型转换可以影响细胞表面受体的表达,导致胞葬作用受损,进而引起自体免疫性疾病和组织受损,成为导致系统性硬化症出现自身免疫逃逸、炎症和纤维化的关键机制[16]。巨噬细胞表面受体(尤其是清道夫受体)及其桥连分子在胞葬作用的过程中发挥了重要作用。本研究结果显示,与空白组相比,SSc 模型组清道夫受体(SR-B1、SR-A1 和ITGβ5)、胞葬桥连分子(GAS6 和MFG-E8)的表达均下调,PI 明显下降,表明清道夫受体的受损影响了胞葬桥连分子的表达水平,引起PI 下降,损伤胞葬功能,进而导致SSc 疾病的发生发展。且本研究数据表明,清道夫受体与M1 型极化因子表达呈负相关。
综上所述,疾病早期,清道夫受体抑制及巨噬细胞M1 型定向极化共同导致巨噬细胞凋亡,损伤巨噬细胞胞葬功能,引起系统性硬化症的炎症反应和皮肤纤维化进展。
4 展望
尽管相关研究表明:在SSc 发病的早期阶段,清道夫受体诱导巨噬细胞M1 型极化、抑制胞葬,导致疾病进展;疾病后期巨噬细胞M2 型极化发挥抗炎效果,促进SSc 病情恢复。但在SSc 后期,巨噬细胞胞葬在疾病回复过程中发挥了怎样的作用,巨噬细胞M2型极化是否有助于增强胞葬功能、调节免疫,减轻SSc 的皮肤纤维化症状,有待进一步探讨。

