氮素在大麦生长发育过程中的作用及响应机制
梁志浩 郭爱奎 张英虎 乔海龙 沈会权
摘要:氮素作为大麦生长和发育所必需的大量营养元素,是大麦生长和产量形成的首要限制因子。为明确氮素对大麦生长发育的作用及大麦自身对氮素吸收利用的机制,提高大麦氮素利用效率。基于文献资料,梳理归纳了氮素在大麦生长发育过程中的作用及响应机制等方面的相关研究进展,对氮素在大麦生长发育过程中的作用、大麦响应氮信号的生理机制和大麦氮素响应的分子调控机制等方面进行了概述,并提出了“双减”政策下提高大麦氮素利用效率、创制氮素高效利用新种质的主要方向。
关键词:大麦;氮素;生长发育;响应机制;研究进展
中图分类号:S512.3 文献标志码:A 文章编号:2097-2172(2023)06-0567-06
doi:10.3969/j.issn.2097-2172.2023.06.017
Effects and Response Mechanism of Nitrogen in the Growth and
Development of Barley
LIANG Zhihao, GUO Aikui, ZHANG Yinghu, QIAO Hailong, SHEN Huiquan
(Jiangsu Coastal Area Institute of Agricultural Sciences, Yancheng Jiangsu 224002, China)
Abstract: As one of the most important plant nutrients for growth and development of barley, nitrogen is the primary limiting factor for barley growth and yield formation. In order to understand the effects of nitrogen on the growth and development of barley and the mechanism of nitrogen uptake and utilization in barley so as to increase the nitrogen utilization efficiency of barley, based on the literature review, the research progress of the role and response mechanism of nitrogen in the growth and development of barley was summarized in this paper, the role of nitrogen in the growth and development of barley and the physiological and molecular mechanisms of barley responses to nitrogen was reviewed, and the development of Chinese barley in the future in terms of improving nitrogen utilization efficiency and creating new germplasm for efficient nitrogen utilization was prospected.
Key words: Barley; Nitrogen; Growth and development; Response mechanism; Research progress
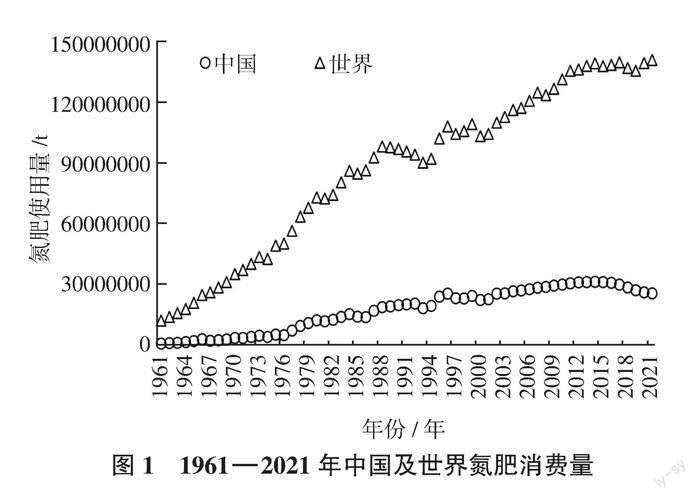
大麥作为世界上第四大耕作谷物,在食用、酿酒、饲用方面发挥着重要作用。氮素作为最重要的植物养分之一,直接影响到大麦的生长发育及后期的产品品质。中国作为世界上最大的氮肥消费国家,化学氮肥在粮食产量增加的过程中发挥着不可替代的作用,20世纪70年代末以来,中国粮食产量大幅度提高,除农村政策调整、品种更新、农田水利建设等因素外,化肥的投入,特别是氮肥投入持续大量增加是一个关键因素。1961年,中国氮肥用量约占世界氮肥用量的5%,1980年上升至20%[1 ]。而在2002年,中国的氮肥用量达到了2.53×107 t,约占世界氮肥用量的30%[2 ],这种高占比现象一直持续到2014年。2015年,农业农村部提出“化肥减量提效”行动方案后,中国化肥使用量开始逐年下降,至2021年,中国氮肥使用量占世界比重下降至22%,但用量仍居高位(图1)。有研究表明,中国粮食年产量从1981年(3.25亿t)至2015年(6.04亿t)增长了86%,而氮肥消费量却增长了近2倍[3 ],而且高产品种对氮肥的依赖性更强。农民为了获得作物高产,过量施肥现象相当普遍[4 ],如现阶段江苏沿海地区大麦氮素施用量已经达到230 kg/hm2。啤酒大麦籽粒蛋白质含量要求适中,含量在90~120 g/kg为宜,蛋白质含量过高会对制麦、糖化、发酵、啤酒的泡沫、风味和非生物稳定性产生很大的影响。大麦籽粒的蛋白质含量随着施氮量增加而增多,尤其是在生长后期施氮对其籽粒蛋白质含量的增加作用最为明显,因此氮素的过量使用将严重影响啤酒大麦的品质。2015年农业农村部提出的“化肥减量提效”的行动方案要求减少化肥用量,提高化肥利用效率。要提升化肥利用效率,除了推进施肥方式和肥料种类的转变,更需要提高作物自身对氮素吸收利用的能力。因此,明确氮素对大麦生长发育的作用及大麦自身对氮素吸收利用的机制,提高大麦氮素利用效率,对降低国产大麦生产成本、提高大麦品质具有重要指导意义。
1 氮素对大麦生长发育的作用
氮素是大麦生长和发育所必需的大量营养元素,是大麦生长和产量形成的首要限制因子[5 ]。氮素的生理功能主要有以下两方面。一是生物体结构和功能的重要组成元素。如氮素是蛋白质、核酸、叶绿素、酶、维生素、生物碱和激素等代谢产物的主要成分[6 ]。其中蛋白质是构成原生质的物质基础,约含有16%~18%的氮,蛋白态氮通常占大麦全氮的80%~85%;核酸也是大麦生长发育和遗传的基础物质,约含有15%~16%的氮,核酸态氮占大麦全氮量的10%左右;叶绿体是绿色植物进行光合作用的场所,叶绿体中的叶绿素a和叶绿素b均含有氮;氮也是植物体内许多酶的重要成分,后者参与大麦体内一系列的生化反应,控制许多重要物质的形成和转化过程,并影响多种新陈代谢过程;氮也是一些植物激素的组成成分,如赤霉素和细胞分裂素中均含有氮。同时,氮是大麦体内多种维生素的成分,维生素B1、维生素B2、维生素B6等均含有氮,它们可以作为辅酶,参与大麦的新陈代谢。此外,氮素还是ATP、FAD、NAD、NADP、磷脂和各种生物碱等重要化合物的组成成分。二是作为信号物质,通过信号传导途径调控包括新陈代谢、养分分配、生长和发育等多种生物学过程。大麦所吸收利用的无机态氮素中,NO3-是重要组成部分;除了作为营养源,NO3-也是大麦体内多种生理和分子过程中关键的信号物质,其可以激活大麦体内数以百计的基因表达,其中包括NO3-自身的吸收、转运和同化基因[7 ],通过解除种子休眠来调控发芽[8 ],促进大麦叶片伸展[9 ],诱导开花[10 ],调控根系生长发育及其构型[11 ]。对基因转录组的分析表明,在植物所表达的所有基因中,大约有10%受到NO3-调控[7 ]。
2 大麦响应氮信号的生理机制
氮素在大麦生长的全生育期都起到了至关重要的作用,是大麦能否正常生长的决定性元素之一,特别是在大麦根系形成与生长、叶片发育及光合作用强度、生长发育过程中的氮素同化等方面发挥着举足轻重的作用。
2.1 大麦根系形态对氮素的响应
养分对大麦生长至关重要,在不同的营养条件下,大麦根系生长也不相同,从而形成不同的根系形态,使大麦适应不同的生长条件。早期对水稻的研究表明,在添加氮素后,根系的根表面积、侧根长度和根系生物量较缺氮条件下的根系有显著升高[12 ]。大麦也有相同现象发生,不仅如此,低氮条件下,与细胞分裂素合成相关的基因表达受到抑制,使得大麦根系中细胞分裂素含量降低[13 ],从而使得总根长、主根长和侧根长均增加[14 ]。在其他作物如玉米中,人们发现氮高效品种的总根长、平均根长、侧根密度等生理指标在相同氮素施用条件下均高于氮低效品种[15 ],说明外界及植物体内的氮素含量均会影响根系结构。
2.2 大麦叶片生长发育及光合作用对氮素的响应
氮是叶片中氨基酸、蛋白质、各种辅酶、光合色素及叶绿素等参与叶片生长发育、光合作用的物质的组成元素,在植物生长发育过程中有重要作用。
研究表明,低氮胁迫会破坏大麦叶绿体被膜,此时可观察到叶片变黄,这是叶绿素降解的结 果[16 ]。叶绿素降解后,含氮化合物会被再次利用生成类黄酮,这种现象的发生,可能是在无氮的情况下,过量的碳被用于合成类黄酮等多酚物质,从而达到新的碳氮平衡。若此时恢复正常供氮,叶绿体功能可以得到恢复,叶绿素含量上升,而多酚类物质含量下降[17 ]。
核酮糖-1,5-二磷酸羧化酶(Rubisco)是叶片中一种重要的光合酶,是大麦叶片中最大的可重复利用氮存储库,其可以与CO2中的C结合,同时也存储着35%的叶片总氮和70%的叶绿体氮[18 ],为维持叶片中碳氮平衡的重要环节。在低氮胁迫下,Rubisco活性受到抑制,光合强度下降,叶片对CO2的吸收利用能力降低,加速了叶片衰老速率和Rubisco降解速率[19 ]。
2.3 大麦相关同化代谢酶对氮素的响应
植物吸收的自然界无机态氮主要分为硝态氮(NO3-)和铵态氮(NH4+)2种,其中硝态氮在硝酸还原酶(NR)和亚硝酸还原酶作用下还原成铵态氮,铵态氮则在谷氨酰胺合成酶(GS)作用下形成谷氨酰胺,共同完成植物吸收外界无机态氮并同化为植物可直接利用的有机态氮的过程。
硝酸还原酶作为氮代谢的限速酶,是氨同化过程中的第1个关键酶[20 ],硝酸还原酶活性可反应植株当前氮素条件是否适宜。研究发现,在低氮条件下,大麦体内硝酸还原酶活性降低,尤其是在大麦同化作用强烈的灌浆期,低氮条件下硝酸还原酶的活性下降更为明显[21 ]。硝酸还原酶活性不仅受到外界无机态氮含量变化的影响,也受到有机氮含量变化的影响,当大麦根系接收到高浓度谷氨酰胺等含氮有机物信号时,其中的硝酸还原酶活性受到明显抑制[22 ]。
谷氨酰胺合成酶(GS)参与氮的代谢,能够将无机态氮转化为有机态氮,既参与氨的同化,也参与谷氨酰胺的合成[23 ]。高等植物的GS主要分为2类,即GS1(胞质型)和GS2(质体型)。GS1存于根、茎、叶、根瘤等植物组织中,主要同化从土壤中吸收的初级铵及再同化植物体内氮循环途径释放的氮;GS2存在于叶绿体等质体中,可以同化光呼吸过程所释放的氨[24 ]。氮素含量较低或者过高时,大麦体内的GS活性都会受到不同程度的抑制;而在氮素高效利用大麦品种中,体内的GS活性均高于普通品种及氮素利用效率低的品种[25 ],说明GS活性的高低很大程度地影响大麦的氮素利用能力,最终影响大麦的生长发育。
3 大麦氮素响应的分子调控机制
氮素作为决定作物产量和品质的重要元素,其重要性不言而喻[26 ]。植物吸收的无机态氮主要为铵态氮(NH4+)和硝态氮(NO3-),高等植物根系以吸收硝态氮为主[27 ]。大麦根系吸收NO3-是一个主动吸收过程,通过H+/NO3-共轉运跨膜吸收进入根系细胞[28 ]。目前在高等植物体中已知的NO3-吸收转运蛋白有4个家族:硝酸盐转运蛋白1/肽转运蛋白(NPF)家族[29 ]、硝酸盐转运蛋白2(NRT2)家族、氯离子通道(CLC)家族、慢阴离子相关通道同源蛋白(SLC/SLAH)家族[30 - 31 ],其中NPF和NRT2两个家族的转运蛋白是高等植物吸收外界NO3-的主要功能蛋白。高等植物对硝态氮的吸收主要依靠高亲和转运系统(HATS)与低亲和转运系统(LATS)对硝酸盐进行吸收转运,且在低氮条件下高等植物对氮素的吸收转运主要由属于高亲和转运系统的NRT2基因家族完成[32 ]。早期的研究在大麦根系中发现了4个NRT2家族基因(HvNRT2.1-2.4),近期科研人员在大麦中又新发现了6个NRT2家族基因,并将其命名为HvNRT2.5-2.10[33 - 35 ]。
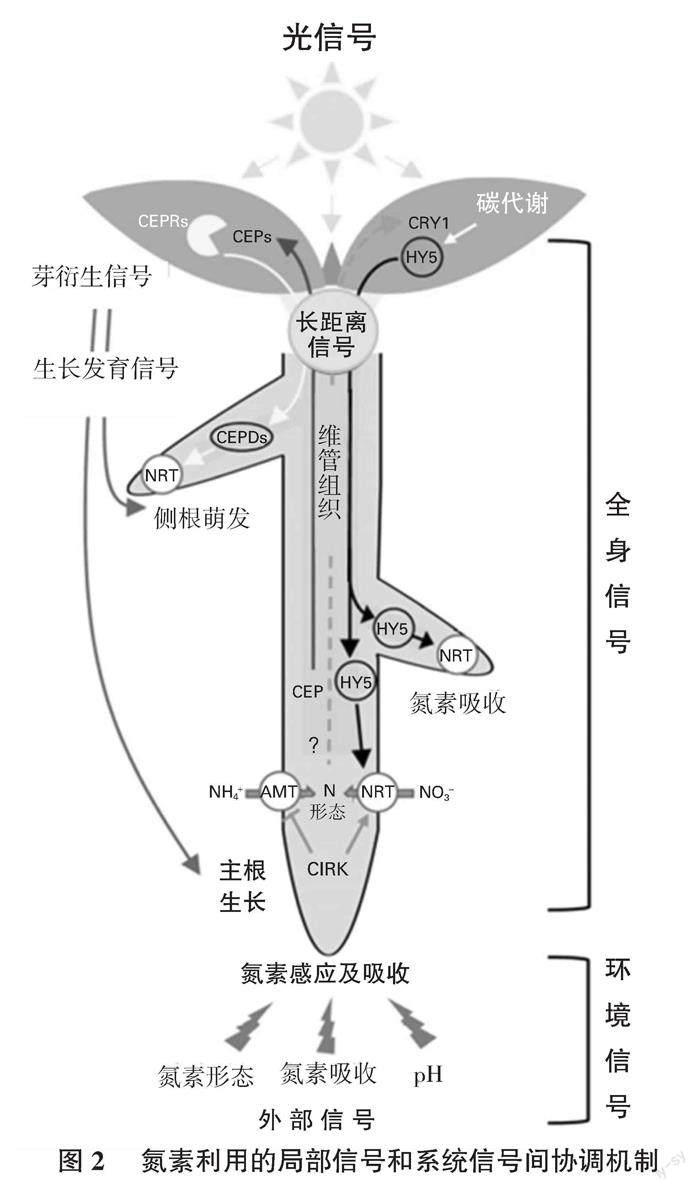
氮素除了作为养分元素被直接吸收利用,它另外一个重要功能是作为信号物质去调控高等植物的生长发育[36 ],高等植物在自身的进化过程中形成了一套对氮素响应和反馈网络。除外部信号外,氮素获取过程还受基因的转录、转录后和蛋白水平的调控,作为对局部氮信号的响应,高等植物也可以激活系统信号来提高自身对外界氮的利用率,这些反应包括根系与地上部之间的交流和分子生化和生理活动的协调,研究发现,根部铵转运蛋白(AMTs)及硝转运蛋白(NRTs)接收到外界氮信号启动氮素吸收机制,并向地上部发送信号,而来自地上部的HY5信号移动到根部,激活NRTs吸收根部的氮。长距离信号可以感知局部氮信号,并根据“根系-地上部-根系”方向传递,激活其下游信号通路,从而适应高等植物的发育和生长[37 ](图2)。前期的研究发现,SPL家族基因在氮素信号调控拟南芥和水稻生长发育过程中起到重要作用[38 ],并且在大麦中分离出17个SPL家族基因,但其具体功能仍需进一步验证[39 ];拟南芥中NLP家族基因在氮素信号系统内起到了核心作用[40 ],而大麦NLP家族基因在氮素信号传导中的关键作用在近期才被人们首次发现[41 ]。
大麦作为世界上第四大耕作谷物,在食用、酿酒、饲用方面发挥着重要作用。氮素作为最重要的植物养分之一,直接影响到大麦的生长发育及后期的产品品质。中国作为世界上最大的氮肥消费国家,化学氮肥在粮食产量增加的过程中发挥着不可替代的作用,20世纪70年代末以来,中国粮食产量大幅度提高,除农村政策调整、品种更新、农田水利建设等因素外,化肥的投入,特别是氮肥投入持续大量增加是一个关键因素。1961年,中国氮肥用量约占世界氮肥用量的5%,1980年上升至20%[1 ]。而在2002年,中国的氮肥用量达到了2.53×107 t,约占世界氮肥用量的30%[2 ],這种高占比现象一直持续到2014年。2015年,农业农村部提出“化肥减量提效”行动方案后,中国化肥使用量开始逐年下降,至2021年,中国氮肥使用量占世界比重下降至22%,但用量仍居高位(图1)。有研究表明,中国粮食年产量从1981年(3.25亿t)至2015年(6.04亿t)增长了86%,而氮肥消费量却增长了近2倍[3 ],而且高产品种对氮肥的依赖性更强。农民为了获得作物高产,过量施肥现象相当普遍[4 ],如现阶段江苏沿海地区大麦氮素施用量已经达到230 kg/hm2。啤酒大麦籽粒蛋白质含量要求适中,含量在90~120 g/kg为宜,蛋白质含量过高会对制麦、糖化、发酵、啤酒的泡沫、风味和非生物稳定性产生很大的影响。大麦籽粒的蛋白质含量随着施氮量增加而增多,尤其是在生长后期施氮对其籽粒蛋白质含量的增加作用最为明显,因此氮素的过量使用将严重影响啤酒大麦的品质。2015年农业农村部提出的“化肥减量提效”的行动方案要求减少化肥用量,提高化肥利用效率。要提升化肥利用效率,除了推进施肥方式和肥料种类的转变,更需要提高作物自身对氮素吸收利用的能力。因此,明确氮素对大麦生长发育的作用及大麦自身对氮素吸收利用的机制,提高大麦氮素利用效率,对降低国产大麦生产成本、提高大麦品质具有重要指导意义。
1 氮素对大麦生长发育的作用
氮素是大麦生长和发育所必需的大量营养元素,是大麦生长和产量形成的首要限制因子[5 ]。氮素的生理功能主要有以下两方面。一是生物体结构和功能的重要组成元素。如氮素是蛋白质、核酸、叶绿素、酶、维生素、生物碱和激素等代谢产物的主要成分[6 ]。其中蛋白质是构成原生质的物质基础,约含有16%~18%的氮,蛋白态氮通常占大麦全氮的80%~85%;核酸也是大麦生长发育和遗传的基础物质,约含有15%~16%的氮,核酸态氮占大麦全氮量的10%左右;叶绿体是绿色植物进行光合作用的场所,叶绿体中的叶绿素a和叶绿素b均含有氮;氮也是植物体内许多酶的重要成分,后者参与大麦体内一系列的生化反应,控制许多重要物质的形成和转化过程,并影响多种新陈代谢过程;氮也是一些植物激素的组成成分,如赤霉素和细胞分裂素中均含有氮。同时,氮是大麦体内多种维生素的成分,维生素B1、维生素B2、维生素B6等均含有氮,它们可以作为辅酶,参与大麦的新陈代谢。此外,氮素还是ATP、FAD、NAD、NADP、磷脂和各种生物碱等重要化合物的组成成分。二是作为信号物质,通过信号传导途径调控包括新陈代谢、养分分配、生长和发育等多种生物学过程。大麦所吸收利用的无机态氮素中,NO3-是重要组成部分;除了作为营养源,NO3-也是大麦体内多种生理和分子过程中关键的信号物质,其可以激活大麦体内数以百计的基因表达,其中包括NO3-自身的吸收、转运和同化基因[7 ],通过解除种子休眠来调控发芽[8 ],促进大麦叶片伸展[9 ],诱导开花[10 ],调控根系生长发育及其构型[11 ]。对基因转录组的分析表明,在植物所表达的所有基因中,大约有10%受到NO3-调控[7 ]。
2 大麦响应氮信号的生理机制
氮素在大麦生长的全生育期都起到了至关重要的作用,是大麦能否正常生长的决定性元素之一,特别是在大麦根系形成与生长、叶片发育及光合作用强度、生长发育过程中的氮素同化等方面发挥着举足轻重的作用。
2.1 大麦根系形态对氮素的响应
养分对大麦生长至关重要,在不同的营养条件下,大麦根系生长也不相同,从而形成不同的根系形态,使大麦适应不同的生长条件。早期对水稻的研究表明,在添加氮素后,根系的根表面积、侧根长度和根系生物量较缺氮条件下的根系有显著升高[12 ]。大麦也有相同现象发生,不仅如此,低氮条件下,与细胞分裂素合成相关的基因表达受到抑制,使得大麦根系中细胞分裂素含量降低[13 ],从而使得总根长、主根长和侧根长均增加[14 ]。在其他作物如玉米中,人们发现氮高效品种的总根长、平均根长、侧根密度等生理指标在相同氮素施用条件下均高于氮低效品种[15 ],说明外界及植物体内的氮素含量均会影响根系结构。
2.2 大麦叶片生长发育及光合作用对氮素的响应
氮是叶片中氨基酸、蛋白质、各种辅酶、光合色素及叶绿素等参与叶片生长发育、光合作用的物质的组成元素,在植物生长发育过程中有重要作用。
研究表明,低氮胁迫会破坏大麦叶绿体被膜,此时可观察到叶片变黄,这是叶绿素降解的结 果[16 ]。叶绿素降解后,含氮化合物会被再次利用生成类黄酮,这种现象的发生,可能是在无氮的情况下,过量的碳被用于合成类黄酮等多酚物质,从而达到新的碳氮平衡。若此时恢复正常供氮,叶绿体功能可以得到恢复,叶绿素含量上升,而多酚类物质含量下降[17 ]。
核酮糖-1,5-二磷酸羧化酶(Rubisco)是叶片中一种重要的光合酶,是大麦叶片中最大的可重复利用氮存储库,其可以与CO2中的C结合,同时也存储着35%的叶片总氮和70%的叶绿体氮[18 ],为维持叶片中碳氮平衡的重要环节。在低氮胁迫下,Rubisco活性受到抑制,光合强度下降,叶片对CO2的吸收利用能力降低,加速了叶片衰老速率和Rubisco降解速率[19 ]。
2.3 大麦相关同化代谢酶对氮素的响应
植物吸收的自然界无机态氮主要分为硝态氮(NO3-)和铵态氮(NH4+)2种,其中硝态氮在硝酸还原酶(NR)和亚硝酸还原酶作用下还原成铵态氮,铵态氮则在谷氨酰胺合成酶(GS)作用下形成谷氨酰胺,共同完成植物吸收外界无机态氮并同化为植物可直接利用的有机态氮的过程。
硝酸还原酶作为氮代谢的限速酶,是氨同化过程中的第1个关键酶[20 ],硝酸还原酶活性可反应植株当前氮素条件是否适宜。研究发现,在低氮条件下,大麦体内硝酸还原酶活性降低,尤其是在大麦同化作用强烈的灌浆期,低氮条件下硝酸还原酶的活性下降更为明显[21 ]。硝酸还原酶活性不仅受到外界无机态氮含量变化的影响,也受到有机氮含量变化的影响,当大麦根系接收到高浓度谷氨酰胺等含氮有机物信号时,其中的硝酸还原酶活性受到明显抑制[22 ]。
谷氨酰胺合成酶(GS)参与氮的代谢,能够将无机态氮转化为有机态氮,既参与氨的同化,也参与谷氨酰胺的合成[23 ]。高等植物的GS主要分为2类,即GS1(胞质型)和GS2(质体型)。GS1存于根、茎、叶、根瘤等植物组织中,主要同化从土壤中吸收的初级铵及再同化植物体内氮循环途径释放的氮;GS2存在于叶绿体等质体中,可以同化光呼吸过程所释放的氨[24 ]。氮素含量较低或者过高时,大麦体内的GS活性都会受到不同程度的抑制;而在氮素高效利用大麦品种中,体内的GS活性均高于普通品种及氮素利用效率低的品种[25 ],说明GS活性的高低很大程度地影响大麦的氮素利用能力,最终影响大麦的生长发育。
3 大麦氮素响应的分子调控机制
氮素作为决定作物产量和品质的重要元素,其重要性不言而喻[26 ]。植物吸收的无机态氮主要为铵态氮(NH4+)和硝态氮(NO3-),高等植物根系以吸收硝态氮为主[27 ]。大麦根系吸收NO3-是一個主动吸收过程,通过H+/NO3-共转运跨膜吸收进入根系细胞[28 ]。目前在高等植物体中已知的NO3-吸收转运蛋白有4个家族:硝酸盐转运蛋白1/肽转运蛋白(NPF)家族[29 ]、硝酸盐转运蛋白2(NRT2)家族、氯离子通道(CLC)家族、慢阴离子相关通道同源蛋白(SLC/SLAH)家族[30 - 31 ],其中NPF和NRT2两个家族的转运蛋白是高等植物吸收外界NO3-的主要功能蛋白。高等植物对硝态氮的吸收主要依靠高亲和转运系统(HATS)与低亲和转运系统(LATS)对硝酸盐进行吸收转运,且在低氮条件下高等植物对氮素的吸收转运主要由属于高亲和转运系统的NRT2基因家族完成[32 ]。早期的研究在大麦根系中发现了4个NRT2家族基因(HvNRT2.1-2.4),近期科研人员在大麦中又新发现了6个NRT2家族基因,并将其命名为HvNRT2.5-2.10[33 - 35 ]。
氮素除了作为养分元素被直接吸收利用,它另外一个重要功能是作为信号物质去调控高等植物的生长发育[36 ],高等植物在自身的进化过程中形成了一套对氮素响应和反馈网络。除外部信号外,氮素获取过程还受基因的转录、转录后和蛋白水平的调控,作为对局部氮信号的响应,高等植物也可以激活系统信号来提高自身对外界氮的利用率,这些反应包括根系与地上部之间的交流和分子生化和生理活动的协调,研究发现,根部铵转运蛋白(AMTs)及硝转运蛋白(NRTs)接收到外界氮信号启动氮素吸收机制,并向地上部发送信号,而来自地上部的HY5信号移动到根部,激活NRTs吸收根部的氮。长距离信号可以感知局部氮信号,并根据“根系-地上部-根系”方向传递,激活其下游信号通路,从而适应高等植物的发育和生长[37 ](图2)。前期的研究发现,SPL家族基因在氮素信号调控拟南芥和水稻生长发育过程中起到重要作用[38 ],并且在大麦中分离出17个SPL家族基因,但其具体功能仍需进一步验证[39 ];拟南芥中NLP家族基因在氮素信号系统内起到了核心作用[40 ],而大麦NLP家族基因在氮素信号传导中的关键作用在近期才被人们首次发现[41 ]。
4 展望
大麦作为我国特粮特经体系中重要一环,其发展越来越受到国家重视。啤酒大麦作为高端啤酒必不可少的原材料,啤酒大麦的品质决定了啤酒的好坏与否。我国对啤酒大麦的需求日益增加,但国内啤酒大麦产业发展却止步不前,从而导致我国啤酒大麦供应的国际依存度也越来越高,从2000年的28.7%到2015年的66.7%,再到2019年的88.0%,引发该现象的主要原因之一是国产大麦在种植时氮素的过量使用使得国产啤酒大麦籽粒蛋白质含量偏高、品质下降,导致国产啤酒大麦的品质仍不如进口啤酒大麦品质,使得国产啤酒大麦产业受到严重冲击。自十八大以来,国家每年都在推进农作物减肥增效计划,在“双减”政策下,如何挖掘大麦自身潜力,降低大麦种植成本是今后需要认真思考的课题。
現阶段提高大麦氮素利用效率和降低氮肥施用量的主要方向有两个方面。一是常规育种技术的应用。该技术仍以杂交为主要技术手段,将生理表型符合要求的优质亲本进行杂交配组,后代筛选辅以分子标记技术,从而保证后代材料中始终拥有调控目标性状的基因片段,常规育种手段难度小、操作简单,但品种育成周期长、效率低,且亲本材料的丰富程度及品质好坏将很大程度上影响后续育成品种的品质,优良性状的聚合难度较大。二是现代技术的应用。其中现代技术在现阶段的应用又主要分为外源添加剂(新型肥料)的合理使用和转基因技术。目前,新型人工添加剂的使用可增加大麦对氮素的利用效率,如使用结节叶藓(Ascophyllum nodosum)提取物为主要成分的生物刺激剂PSI-362可增加大麦在较低氮素环境下的氮素利用效率[42 ],而转基因技术的成功应用使得大麦优质品种的选育有了新的思路,最新研究结果表明,人们通过调节大麦体内与固氮相关的信号物质的表达与活性,可使固氮菌特异结合大麦根系,从而形成大麦-根瘤菌共生体,增加大麦对自然界氮素的利用能力[43 ]。随着现代科技的进步,分子育种会逐渐成为育种工作者主要手段,分子育种的快速、精确、不受环境条件干扰等优点,将为人们从整体、全面的视角解决大麦氮素养分利用这一宏大课题提供无限可能。
参考文献:
[1] 彭少兵,黄见良,钟旭华,等. 提高中国稻田氮肥利用率的研究策略[J]. 中国农业科学,2002,35(9):1095-1103.
[2] FAO. Statistical databases[EB/OL]. (2006-08-26)[2023-03-25]. http://www.fao.org.
[3] AN N, FAN M S, ZHANG F S, et al. Exploiting Co-benefits of increased rice production and reduced greenhouse gas emission through optimized crop and soil management[J]. PLoS One, 2015, 10(10): e0140023.
[4] 王敬国,林 杉,李保国. 氮循环与中国农业氮管理[J]. 中国农业科学,2016,49(3):503-517.
[5] FRINK C R, WAGGONER P E, AUSUBEL J H. Nitrogen fertilizer: retrospect and prospect[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96: 1175-1180.
[6] CRAWFORD N M, FORDE B G. Molecular and developmental biology of inorganic nitrogen nutrition[J]. Arabidopsis Book, 2002, 1: e0011.
[7] BOUGUYON E, GOJON A, NACRY P. Nitrate sensing and signaling in plants[J]. Seminars in Cell & Developmental Biology, 2012, 23(6):648-654.
[8] ALBORESI A, GESTIN C, LEYDECKER M T, et al. Nitrate, a signalrelieving seed dormancy in Arabidopsis[J]. Plant, Cell & Environment, 2005, 28(4):500-512.
[9] VENKATASUBBU T, AHMAD M A, RAVI K, et al. Leaf primordium size specifies leaf width and vein number among row-type classes in barley[J]. the Plant Journal, 2017, 91(4):601-612.
[10] MATHIAS W, ANDREAS M, ANH P, et al. Barley yield formation under abiotic stress depends on the interplay between flowering time genes and environmental cues[J]. Scientific Reports, 2019, 9(1):6397.
[11] ZHANG H, JENNINGS A, BARLOW P W, et al. Dual pathways for regulation of root branching by nitrate[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96: 6529-6534.
[12] WANG X B, WU P, HU B, et al. Effects of nitrate on rice lateral root morphology and nitrogen absorption in rice (Oryza Sativa L.) [J]. Acta Botanica Sinica, 2002, 44: 678-683.
[13] VYSOTSKAYA L, TIMERGALINA L, AKHIYAROVA G, et al. Association of barley root elongation with ABA-dependent transport of cytokinins from roots and shoots under supra-optimal concentrations of nitrates and phosphates[J]. Cells, 2021, 10(11): 3110.
[14] CHUN L, MI G H, LI J S, et al. Genetic Analysis of Maize Root Characteristics in Response to Low Nitrogen Stress[J]. Plant and Soil, 2005, 276: 369-382.
[15] 王 艳,米国华,陈范骏,等. 玉米氮素吸收的基因型差异及其与根系形态的相关性[J]. 生态学报,2003,23(2):297-302.
[16] SOBIESZCZUK-NOWICKA E, WRZESI SKI T, BAGNIEWSKA-ZADWORNA A, et al. Physio-genetic dissection of dark-induced leaf senescence and timing its reversal in barley[J]. Plant Physiology, 2018, 178(2): 654-671.
[17] CARTELAT A, CEROVIC Z G, GOULAS Y, et al. Optically assessed contents of leaf polyphenolics and chlorophyll as indicators of nitrogen deficiency in wheat (Triticum aestivum L.)[J]. Field Crops Research, 2005, 91: 35-49.
[18] KRIEGER-LISZKAY A, KRUPINSKA K, SHIMAKAWA G. The impact of photosynthesis on initiation of leaf senescence[J]. Physiologia Plantarum, 2019, 166(1): 148-164.
[19] H?魻RTENSTEINER S, FELLER U. Nitrogen metabolism and remobilization during senescence[J]. Journal of Experimental Botany, 2002, 53(370): 927-937.
[20] 葉全宝,张洪程,戴其根,等. 施氮水平和栽插密度对水稻生育中后期硝酸还原酶活性的影响[J]. 植物生理学通讯,2005,41(1):41-44.
[21] 徐红卫,王亦菲,刘成洪,等. 大麦小孢子突变体与原始品种中碳氮代谢关键酶活性差异分析[J]. 植物生理学报,2016,52(12):1935-1940.
[22] FAN X R, GORDON-WEEKS R, SHEN Q R, et al. Glutamine transport and feedback regulation of nitrate reductase activity in barley roots leads to changes in cytosolic nitrate pools[J]. Journal of Experimental Botany, 2006, 57(6): 1333-1340.
[23] BEATO VM, REXACH J, NAVARRO-GOCHICOA M T, et al. Boron deficiency increases expressions of asparagine synthetase, glutamate dehydrogenase and glutamine synthetase genes in tobacco roots irrespective of the nitrogen source[J]. 2014, 60(3): 314-324.
[24] MASCLAUX-DAUBRESSE C, DANIEL-VEDELE F, DECHORGNAT J, et al. Nitrogen uptake, assimilation and remobilization in plants: challenges for sustainable and productive agriculture[J]. Annals of Botany, 2010, 105(7): 1141-1157.
[25] 姚立蓉,谢蕾蕾,强 欣,等. 大麦不同氮利用效率品种筛选及GS2基因的表达分析[J]. 核农学报,2017, 31(7):1255-1262.
[26] FRINK C R, WAGGONER P E, AUSUBEL J H. Nitrogen fertilizer: retrospect and prospect[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(4): 1175-1180.
[27] CRAWFORD N M, ANTHONY D M. Molecular and physiological aspects of nitrate uptake in plants[J]. Trends in Plant Science, 1998, 3(10): 389-395.
[28] GLASS A D M, SHAFF J E, KOCHIAN L V. Studies of the uptake of nitrate in barley. Plant Physiology, 1992, 99: 456-464.
[29] L?魪RAN S, VARALA K, BOYER J C, et al. A unified nomenclature of NITRATE TRANSPORTER 1/PEPTIDE TRANSPORTER family members in plants[J]. Trends in Plant Science, 2014, 19(1): 5-9.
[30] OBRIEN JOS?魪 A, VEGA A, BOUGUYON E, et al. Nitrate transport, sensing, and responses in plants[J]. Molecular Plant, 2016, 9(6): 837-856.
[31] NOGUERO M, LACOMBE B. Transporters involved in root nitrate uptake and sensing by Arabidopsis[J]. Frontiers in Plant Science, 2016, 7: 1391.
[32] WILLIAMS L, MILLER A. Transporters responsible for the uptake and partitioning of nitrogenous solutes[J]. Annual Review of Plant Physiology & Plant Molecular Biology, 2001, 52(52): 659-688.
[33] VIDMAR J J, ZHUO D, SIDDIQI M Y, et al. Isolation and characterization of HvNRT2.3 and HvNRT2.4, cDNAs encoding high-affinity nitrate transporters from roots of barley[J]. Plant Physiology, 2000, 122(3): 783-792.
[34] TONG Y P, ZHOU J J, LI Z S, et al. A two-component high-affinity nitrate uptake system in barley[J]. Plant Journal, 2005, 41(3): 442-450.
[35] GUO B J, LI Y, WANG S, et al. Characterization of the Nitrate Transporter gene family and functional identification of HvNRT2.1 in barley(Hordeum vulgare L.)[J]. PLoS ONE, 15(4): e0232056.
[36] FORDE B G. Nitrogen signalling pathways shaping root system architecture: an update[J]. Current Opinion in Plant Biology, 2014, 21:30-36.
[37] XUAN W, BEECKMAN T, XU G H. Plant nitrogen nutrition: sensing and signaling[J]. Current Opinion in Plant Biology, 2017, 39: 57-65.
[38] LI H, HU B, CHU C C. Nitrogen use efficiency in crops: lessons from Arabidopsis and rice[J]. Journal of Experimental Botany, 2017, 68(10): 2477-2488.
[39] TRIPATHI R K, BREGITZER P, SINGH J. Genome-wide analysis of the SPL/miR156 module and its interaction with the AP2/miR172 unit in barley[J]. Scientific Reports, 2018, 8(1): 7085.
[40] KONISHI M, YANAGISAWA S. Arabidopsis NIN-like transcription factors have a central role in nitrate signalling[J]. Nature Communications, 2013, 4: 1617.
[41] GAO Y Y, QUAN S X, LYU B, et al. Barley transcription factor HvNLP2 mediates nitrate signaling and affects nitrogen use efficiency[J]. Journal of Experimental Botany, 2021, 73(3): 770-783.
[42] GO?譙I O, ?覵ANGOWSKI L, FEENEY E, et al. Reducing nitrogen input in barley crops while maintaining yields using an engineered biostimulant derived from ascophyllum nodosum to enhance nitrogen use efficiency[J]. Frontiers in Plant Science, 2021, 12: 664-682.
[43] HASKETT T L, PARAMASIVAN P, MENDES M D, et al. Engineered plant control of associative nitrogen fixation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(16): e2117465119.
收稿日期:2023 - 04 - 08
基金項目:大麦青稞产业技术体系(CARS-05);江苏省特粮特经产业技术体系盐城示范基地(JATS〔2022〕236)。
作者简介:梁志浩(1993 — ),男,湖南常德人,助理研究员,博士,主要从事大麦氮素利用与遗传育种研究工作。Email: 371029677@qq.com。
通信作者:沈会权(1975 —),男,江苏兴化人,研究员,主要从事大麦遗传育种研究工作。Email: jsycshq@163.com。

