红芽芋及荔浦芋叶绿体基因组测序及比较分析
贾芯碧 潘饶 肖遥 罗莎 单楠 孙静宇 汪生林 周庆红 黄英金 朱强龙
关键词:红芽芋;荔浦芋;叶绿体基因组;SSR;SNP;系统发育分析
中图分类号:S632.3 文献标识码:A
芋[Colocasia esculenta (L.) Schoott]为天南星科芋属多年生草本植物,是我国传统的蔬菜兼粮食作物。芋地下球茎具有很高的营养和药用价值,富含淀粉、蛋白质、多糖、维生素和膳食纤维[1],球茎中含有的丰富的粘液物质具有抑制癌细胞转移,增强人体免疫力,降血糖、抗病毒等功效,其花、叶、茎均可入药,可治口渴便秘、消痨散结等症状[2],是食药兼优的上乘佳品。芋在我国有悠久的栽培历史,品种类型丰富多样,其中以多子芋和魁芋最为常见。多子芋主要分布在长江流域,多為三倍体种(2n=3x=42),以子、孙芋为主要食用部分;魁芋主要分布于岭南地区,为二倍体种(2n=2x=28),以食用硕大的母芋为主。江西铅山红芽芋为典型的多子芋类型,红芽白肉,母芋近圆形,芋皮黄褐色,有少量须毛,子芋肥大,多而群生。铅山红芽芋因其肉质细腻,口感松滑,营养丰富而备受大众喜爱,成为江西省名优农产品,2013 年获批国家地理标志农产品[3-4]。广西荔浦芋又名魁芋,白芽白肉,母芋个头硕大,呈椭圆形,芋皮棕色,芋肉具有美丽的紫色槟榔花纹[5]。荔浦芋肉质绵甜,酥黏可口,味道芬芳,被誉为“芋中极品”,被列为广西壮族自治区的地理标志保护产品[6]。红芽芋喜湿怕涝,喜凉怕热[7],一般选用土层深厚肥沃,pH 在5.5~7.5 之间的沙质土壤,进行旱地栽培[8];而荔浦芋喜高温多湿的环境[9],更适合水田种植,栽培时选用石灰性的黏质壤土较为适宜[10],由于它们长期生长环境和栽培条件不同,可能导致2 种芋的遗传和性状具有显著的差异。
叶绿体是绿色植物细胞中参与光合作用和能量代谢最重要的细胞器之一,内含特定的遗传物质。叶绿体基因组编码了约110~134 个基因,这些基因与光合作用、叶绿体转录翻译表达及能量代谢相关。相较于核基因组,叶绿体基因组多为母系遗传,其进化路线独立、进化速率适中、核苷酸替换率较低、基因结构稳定,在系统研究方面易于提供物种进化信息[11]。因此,叶绿体基因组广泛应用于植物物种鉴定及分类、系统进化、遗传差异和多样性分析等研究中[12]。目前,国内外鲜有关于我国特色芋种质资源叶绿体基因组测序和比较分析的研究。此外,荔浦芋和红芽芋虽均为芋属芋种作物,但由于倍性不同,其生物学特性存在显著差异,二者在叶绿体基因组方面的差异并不明确。本研究以江西铅山红芽芋和广西荔浦芋为实验材料,对其叶绿体基因组进行测序、组装、注释和绘制物理图谱,分析其简单重复序列并开发多态性SSR 引物,将红芽芋、荔浦芋与NCBI 数据库中已公布的13 种植物的叶绿体基因组序列信息进行序列比对,对其进行叶绿体基因组基本特征的比较分析,通过遗传多样性滑窗分析鉴别15 种天南星亚科植物叶绿体基因序列的遗传差异,并构建进化树揭示芋在系统发育中的地位及其群体进化关系,为阐明我国特色多子芋和魁芋遗传差异,芋种质资源鉴定、开发、利用以及遗传育种奠定理论基础。
1 材料与方法
1.1 材料
本研究为比较红芽芋(多子芋,三倍体)和荔浦芋(魁芋,二倍体)的叶绿体基因的差异,所用红芽芋品种为赣芋1 号,是江西上饶铅山县的地理标志农产品;荔浦芋采自广西壮族自治区桂林市荔浦市。同时利用30 份从全国搜集的芋核心种质资源品种(表1)对红芽芋和荔浦芋叶绿体基因组中开发的SSR 标记进行多态性检验。于2021 年7 月在田间收集新鲜的叶片,立即冻存于液氮中,然后运至实验室保存在?80 ℃冰箱中直至使用。利用CTAB 改良法提取叶片高纯度基因组DNA[13],并用琼脂糖凝胶电泳和Nanodrop-2000 核酸测定仪检测DNA 的质量和浓度,符合要求的DNA 样品将用于后续实验。
1.2 方法
1.2.1 基因组测序、组装与注释 将红芽芋和荔浦芋的DNA 送至深圳华大基因科技有限公司进行高通量测序,其余稀释到10 ng/μL,分装冻存待用。利用华大基因自主开发的过滤软件SOAPnuke 对原始数据进行过滤,过滤参数为“-n0.01 -I 20 -q 0.3 -A 0.25 -f -r -1 < fq1> -2 < fq2> -C < cleanFq1> -D -o ”。删除匹配上adapter 序列的25%或者以上、质量值低于20 的碱基占整条read 的30%或者以上、碱基N 含量占整条read 的1%或者以上的整条read,得到无杂质的高质量数据。利用Seqtk 软件随机抽取获得1 Gb 的高质量测序数据,采用SPAdes 软件[14]中的Plasmidspades.py 脚本程序将得到的clean reads 组装到contig 序列,用BlastN 软件[15]将其比对到国外发表的芋的叶绿体参考基因组(NC_016753.1),构建出芋叶绿体基因组骨架。使用GapCloser 软件对框架序列上的gap 进行填补。通过CPGAVAS2[16]和GeSeq[17]对2 种芋叶绿体基因组序列进行注释,利用IGV 和Sequin 软件检查和修正注释结果,将最终注释的红芽芋和荔浦芋叶绿体基因组数据提交到NCBI 的GenBank 基因组数据库, 获得基因编号分别为MT447084 和MT447085。最后,使用在线程序OGDRAW[18]( https://chlorobox.mpimp-golm.mpg.de/OGDraw.html)绘制完整的环状叶绿体基因组图谱。
1.2.2 简单重复序列鉴定及标记开发 利用MISA 软件[19]对红芽芋和荔浦芋叶绿体基因组中简单重复序列(SSR)进行鉴定,再利用Primer3软件进行批量化SSR 引物设计,引物挑选标准:引物序列长度为16~24 bp,预计扩增产物片段长度为100~300 bp,TM 值为50~60 ℃,最适为55 ℃,上下游引物的TM值相差不大于3 ℃,GC%为40%~60%;SSR 多态性引物的筛选的条件为:SSR 重复单元包含2~6 个碱基重复,SSR 长度不少于18 bp,富含AT 碱基,且SSR 序列在2 种芋叶绿体基因组上存在差异,它们的侧翼引物将用于后续的多态性验证实验。然后,利用本实验室保存的32 份芋核心种质资源的DNA 样品(表1)对符合筛选条件的SSR 引物进行多态性验证。PCR 扩增反应体系为10 μL,含5 μL 2TSINGKEMaster Mix(Green);前引物0.25 μL(10 μmol/L);后引物0.25 μL(10 μmol/L);0.5 μL 模板DNA;4 μL ddH2O。扩增反应采用以下循环参数:94 ℃预变性2~5 min,94 ℃变性30 s,50~68 ℃退火30 s,30~35 个循环;72 ℃延伸1~2 min,72 ℃终延伸5~10 min。扩增的PCR 产物在8%非变性聚丙烯酰胺凝胶上检测。使用AgNO3 染色12 min后用适量蒸馏水浸洗胶面2 次,每次20~30 s,将胶片浸于NaOH 显影液中不断摇匀,直至显出条带,并拍照记录进行分析。
1.2.3 叶绿体基因组比较分析 为了解芋种内叶绿体基因组的遗传多样性,本研究利用BWA[20]、SAMtools[21]、VarsScan 等软件挖掘红芽芋和荔浦芋2 种类型芋叶绿体基因组中的单核苷酸多态性位点(SNP),并用SNPeff 软件分析SNP 对基因的影响,以解析红芽芋和荔浦芋叶绿体基因组的遗传差异。天南星亚科植物是天南星科植物中数量最多且遗传多样性最高的一类植物,其中多数植物具有很高的经济价值、观赏价值和药用价值。目前,NCBI 数据库中现已收录17 种天南星亚科植物,共13 个属,本研究分别从以上13 个屬中随机挑选一种代表植物参与比较分析。基于本研究中注释的红芽芋和荔浦芋叶绿体基因组信息和数据库中13 个属叶绿体基因组信息,对该15 个叶绿体基因组的基因含量和基因结构信息进行统计分析,并以红芽芋为参照,利用DNASP6 软件进行遗传多样性滑窗分析,鉴别15 种天南星科植物叶绿体基因序列的遗传差异。
1.2.4 系统进化分析 为揭示芋属植物在天南星亚科植物中的进化地位,本研究利用MAFFT 软件[22]对红芽芋、荔浦芋和13 个天南星亚科代表属植物的叶绿体基因组进行完全比对,以泽泻属泽泻( NC_044108.1 ) 和浮萍属浮萍( NC_010109.1)叶绿体基因组作为外群(outgroup),基于极大似然法(ML),自举值(bootstrap)为1000,利用MEGA 软件构建进化树。
2 结果与分析
2.1 红芽芋及荔浦芋叶绿体基因组基本特征
红芽芋和荔浦芋叶绿体基因组均为典型的环状双链四分体结构,全长分别为162 478 bp 和162453 bp(图1),2 种芋叶绿体基因组全长仅相差25 bp。红芽芋和荔浦芋均包括1 个小的单拷贝片段(SSC),长度分别为22 072 bp 和22 187 bp,1 个大的单拷贝片段(LSC,89 808 bp 和89 718 bp)和1 对反向重复序列(IRa 和IRb,25 299 bp 和25 274 bp)(图1)。由此可见,其中SSC 片段长度在2 种芋中差异最大,IR 片段的差异最小。
2 种芋叶绿体基因组均注释到131 个基因(表2),包括86 个蛋白编码基因,37 个tRNA 基因和8 个rRNA 基因。其中86 个蛋白编码基因可分为3 个大类,第一类包含29 个与自我复制相关的基因,包括编码RNA 聚合酶的3 个亚基(大亚基、小亚基和DNA 依赖性RNA 聚合酶);第二类包含45 个与光合作用相关的基因(ATP 合酶亚基、光系统Ⅰ的亚基、光系统Ⅱ的亚基、NADH–脱氢酶的亚基、细胞色素b/f 复合物的亚基、二磷酸核酮糖氧合酶/羧化酶亚基);第三类包括5 个其他编码蛋白质的基因和6 个功能未知的基因。
红芽芋和荔浦芋叶绿体基因组中共有23 个基因含有内含子,其中只有ycf3 和clpP 含有2个内含子(表3)。对二者叶绿体基因组中所有翻译蛋白表达的密码子进行统计发现,亮氨酸Leu 是其中编码率最髙的氨基酸,分别有5056 个和5050 个(表4);半胱氨酸Cys 是编码率最低的氨基酸,均只含606 个;二者叶绿体基因组中的密码子用法有所不同,使用同种密码子数量差异范围为0~12 个。红芽芋和荔浦芋的第三密码子A/T 含量分别为68.09%和68.12%。
2.2 SSR 鉴定及其分子标记开发
鉴定到红芽芋和荔浦芋叶绿体基因组中SSR数量分别为130 和124(表5)。红芽芋SSR 序列绝大部分是单核苷酸重复序列(p1),占65.38%,二核苷酸重复序列(p2)共35 个(26.92%),三核苷酸重复序列(p3)共8 个(6.15%),四核苷酸重复序列(p4)仅2 个(1.54%);位于编码区仅14.62%,而大部分(85.38%)位于非编码区(图2)。荔浦芋SSR 序列中p1 占62.9%,p2 共35 个(28.23%),p3 共10 个(8.06%),p4 仅1 个(0.81%),其中19.35%位于编码区,80.65%位于非编码区(图2)。红芽芋叶绿体基因组中63.08%的SSR 由A/T碱基组成,而荔浦芋重复碱基中A/T 碱基占61.29%(表6)。
根据红芽芋和荔浦芋叶绿体基因组中SSR 序列差异信息,鉴别到38 个SSR 序列在2 个材料的基因组序列之间具有多态性,在多态性SSR 序列两端共设计出191 对SSR 引物,其中31 对符合多态性引物的筛选条件,以32 种芋试验材料的DNA 样品为模板进行PCR 扩增,扩增产物的电泳分析结果表明,其中12 对引物能扩增出稳定、清晰的条带,并具有多态性(表7),每个引物在一份材料中产生0~10 个条带(图3),12 对引物在32 份材料中共扩增出1226 个清晰条带,其中827 条为多态性条带,多态性比率为67.45%。
本研究所搜集的32 份试验材料在芋种群中具有一定代表性,利用其叶绿体基因组SSR 开发标记有助于深入研究我国芋种质资源,因此,本研究基于上述12 对引物对试验材料的遗传分型条带对32 份芋核心种质资源进行了遗传多样性分析(图4),结果表明遗传距离最远的是青岛芋头和于都大野芋,最近的是白肉毛头芋和赣州多子芋,品种间相似性系数在0~0.971 之间,平均值为0.515。在相似性系数为0.480 处可以将供试材料分成3 组。
第Ⅰ组包括18 个品种,92.3%为多子芋品种,其中赣州1 号红芽芋(1)、紫柄芋(10)、紫芽芋(12)、狗爪芋(13)、白肉毛芋(14)、扁母芋(19)等为多子芋类型的典型品种,子芋多、芽色艳丽、芋肉粉质,除粉红佳人(7)、粉红芋2 号(8)和于都大野芋(9)外,其他10 个来源于江西的品种均聚集在该组。
第Ⅱ组包括13 个品种,集中了炮弹芋(17)、泉州魁芋(21)、大香芋(28)和荔浦芋(32)四种魁芋,其中炮弹芋和泉州魁芋相似性最高,相似系数为0.936,来自广西的钦州芋(11)、红嘴芋(16)和荔浦芋(32)3 个品种均聚集在第Ⅱ组。
第Ⅲ组只含于都大野芋(9)一个品种,大野芋[Colocasia gigantea (Blume) Hook. f.]属天南星科、芋属、大野芋种,根茎倒圆锥形,直立,叶丛生,叶片卵状心形,与本研究其他31 份芋材料有较大差异,此外,12 对SSR 引物在于都大野芋(9)上扩增出的多态性条带位点也与其他试验材料的较为不同。
2.3 红芽芋与荔浦芋叶绿体基因组中单核苷酸多态性分析
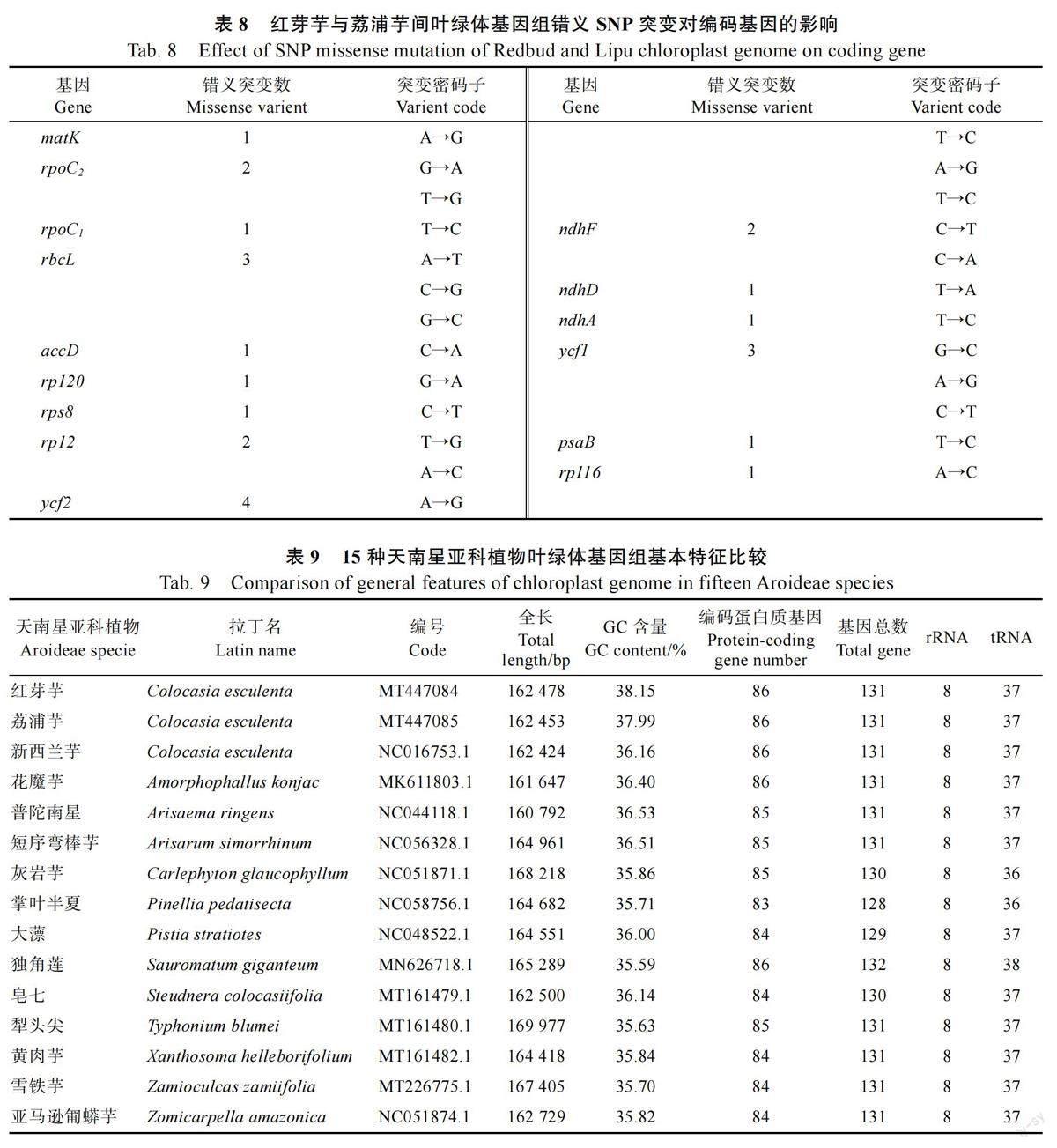
为了比较红芽芋和荔浦芋叶绿体基因组的差异,进一步了解红芽芋和荔浦芋的遗传多样性,本研究对二者的叶绿体基因组进行了单核苷酸多态性分析(SNP)。共鉴别到236 个SNP 位点(图5),其中173 个位点发生在基因间区(intergenicregion),63 个位点发生在基因编码区,致使36个基因发生同义突变(synonymous variant),25个基因发生错位突变(missense variant)(表8),其中,ycf2 是发生错义突变频率最高的基因。此外,rpl16 发生终止密码子提前(stop gained),atpF 发生剪接区突变(splice region variant)。
2.4 芋与天南星亚科植物叶绿体基因组的分析比较
比较红芽芋、荔浦芋及其他13 种天南星科植物叶绿体基因组发现,其叶绿体基因的结构大小及基因种类差异不大(表9)。犁头尖的叶绿体基因组最大,为169 977 bp,普陀南星叶绿体基因组最小,为160 792 bp。红芽芋GC 含量最高,为38.15%,独角莲GC 含量最低,为35.59%。一共注释到128~132 个基因,其中最多的为独角莲(132 个),最少的为掌叶半夏(128 个)。编码蛋白基因数在83~86 之间,掌叶半夏只注释到83个编码基因。13 种天南星亚科植物rRNA 数均为8 个。tRNA 个数在36~38 之间,大多数植物有37 个tRNA,最多的为独角莲(38 个)。
2.5 遗传多样性滑窗分析
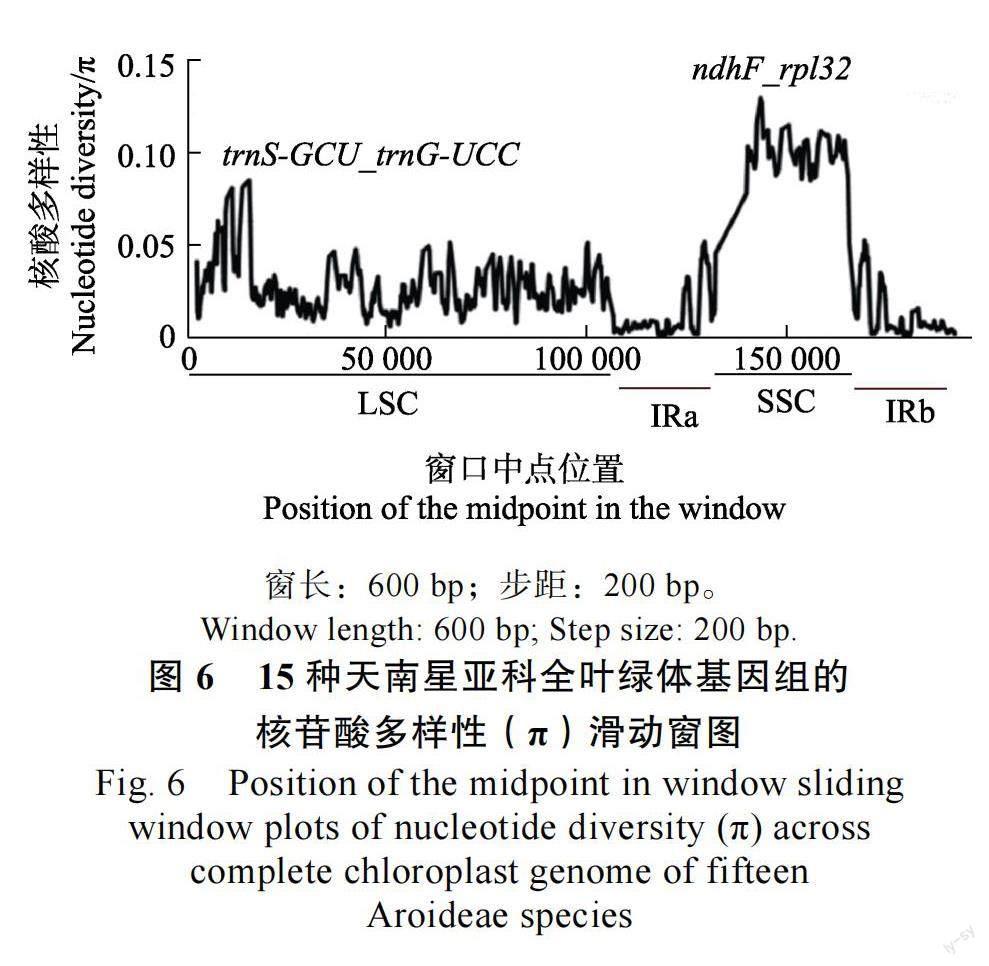
为了明确红芽芋、荔浦芋及其他13 种天南星科植物序列的差异程度,本研究利用DnaSP 6.0软件计算了表9 中15 个植物叶绿体基因组的核苷酸序列遗传多样性Pi 值。结果表明在SSC 区基因变异程度最大,LSC 区次之,IRa 和IRb 区的基因变异程度最低(图6),并发现trnS-trnG 和ndhF-rpl32(π>0.5)分别为SSC 区和LSC 区中最高的变异位点,这2 个区域均位于基因间区。
2.6 系统进化分析
叶绿体基因组是研究物种起源、进化演变及不同物种之间的亲缘关系等方面的重要分子依据之一。本研究利用MAFFT 软件比对分析表9 中红芽芋和荔浦芋,以及其他13 个天南星亚科代表属植物的叶绿体基因组,以天南星科浮萍(Lemnaminor)和泽泻科泽泻(Alisma plantago-aquatica)植物叶绿体基因组作为外群,利用MEGA 软件构建进化树,探究芋与其他天南星科植物间的系统进化关系。由图7 可知,系统进化树分支上的bootstrap 值均大于95,表明该树结构对于揭示植物亲缘关系的置信程度较高。从水平方向分支可知,红芽芋、荔浦芋与皂七属横向距离相加最短,表明与其他13 个属相比,芋属与皂七属进化分歧时间最短,亲缘关系相近。其次,红芽芋(多子芋,三倍体)和荔浦芋(魁芋,二倍体)各自分支均有一定长度,表明二者在进化过程中遗传变量的变化程度有差异。
3 讨论
高等植物叶绿体基因组通常为典型的四分结构,序列长度在120~160 kb 范围内[23]。红芽芋和荔浦芋叶绿体基因组结构与之相似,全长分别为162 478 bp 和162 453 bp,呈典型的环状双链四分体结构,均由1 个SSC 区,1 个LSC 区和1 对反向重复序列(IRa 和IRb)组成。在二者叶绿体基因组所有翻译蛋白表达的密码子中,亮氨酸Leu是编码率最髙的氨基酸,表明芋可能富含亮氨酸重复序列结构的蛋白质,从而提高芋的天然免疫防御能力[24-25]。二者叶绿体基因组蛋白编码基因第三密码子均具有明显的A/T 偏好性,进一步证明了A/T 密码子偏好性普遍存在于高等植物的叶绿体基因组中[26]。
SSR 是以PCR 技术为核心的DNA 分子标记技术,SSR 标记能在遗传水平上直接识别特定的基因型,在芋种质资源鉴定与分类、遗传多样性分析和新品种开发中具有重要作用。近年来,随着芋的食药同源价值被大众认可和芋产业经济的发展,芋特异性SSR 分子标记开发逐渐受到重视。YOU 等[27]根据芋头转录组序列,开发了2858 对SSR 引物,随机合成100 对,其中72 对可以扩增出条带,62 对在芋头的品种中存在多态性;CHAR等[28]使用11 对SSR 标记成功地将来自19 个国家的芋头品种进行分类。本研究利用MISA 和Primer3 软件对红芽芋和荔浦芋叶绿体基因组进行SSR 鉴定及引物开发,鉴定到红芽芋和荔浦芋叶绿体基因组分别有130 和124 个SSR,以多聚A 和多聚T 单核苷酸重复序列为主,分别为65.38%和62.9%,二者的SSR 序列主要分布在非编码区。通过对红芽芋和荔浦芋叶绿体基因组SSR 位点的比较分析,开发出15 对能扩增出条带清晰、多态性丰富的SSR 引物,将为深入研究芋种质资源鉴别、遗传多样性分析及分子标记辅助选择育种等提供理论依据。
叶绿体基因组是植物细胞中重要的遗传物质之一,红芽芋、荔浦芋的表型性状,生长习性等方面有较大差别。为了明确2 种芋叶绿体基因组之间遗传差异,通过对红芽芋、荔浦芋叶绿体基因组的比较分析,发现尽管二者基因组结构相近,总基因数、编码蛋白基因数、rRNA 数和tRNA 数均一致,但它们在系统发育进化树上遗传距离约为0.001 486,表明存在遗传差异。对红芽芋和荔浦芋叶绿体基因组中SNP 位点进行分析,共鉴别到SNP 位点236 个,63 个位点发生在基因编碼区,致使accD、matK、ndhA、ndhD、ndhF、rbcL、rpoC1、rpoC2 等25 个基因发生错义突变。accD 基因编码乙酰辅酶A 羧化酶的β-羧基转移酶亚基[29],是参与脂肪酸合成的重要调节酶之一,研究发现accD也是调节叶片生长发育的重要基因[30-31],荔浦芋的叶片一般比红芽芋的叶片大,accD 的变异可能促进了它们之间的叶片产生形态差异。matK 基因编码内含子成熟酶K,主要参与RNA 转录内含子的剪接[32]。rpoC1 和rpoC2 基因编码β-RNA 聚合酶,在植物授粉和性别分化的调控中发挥重要作用[33]。ndhA、ndhD、ndhF 和rbcL 是光系统中重要的调控基因,对2 种芋的光合作用具有重要作用。这些叶绿体功能基因对芋适应生态环境与生长发育过程发挥重要作用,它们的变异可能促使2 种芋的农艺性状与生长习性存在较大差异。
通过2 种芋与13 个天南星亚科代表属植物叶绿体基因组的比较分析, 发现trnS-trnG 和ndhF-rpl32 分别是SSC 区和LSC 区的最高变异位点,这2 个区域已经作为DNA 条形码(DNAbarcode)被广泛地用于禾本科[34]、葫芦科[35]、豆科[36]植物系统进化研究中,表明这2 个高变异区域可开发为DNA barcode 用于芋植物及其近缘物种的种质资源鉴定评价、遗传多样性分析及群体进化关系等研究。在本研究的系统进化分析中,与其他天南星亚科代表属相比,芋属与皂七属(Steudnera)亲缘关系最近,该结果与CABRERA等[37]、CUSIMANO 等[38]、NAUHEIMER 等[39]对天南星科植物系统进化关系的研究结果相似,表明本研究准确分析了芋属的系统分类位置。芋属中红芽芋、荔浦芋与新西兰芋(NC016753.1)聚在同一分支上,但3 种芋之间存在一定的遗传距离,表明我国红芽芋、荔浦芋与新西兰芋存在遗传差异,体现出我国特色芋种质资源在芋属中的独特性与重要性,为深入研究我国芋特色种质资源群体遗传提供了参考。

