异基因造血干细胞移植患者泪液中IL-36的表达情况及其与眼表微环境的相关性分析
王仡宁,李德鹏,张 玲,黄小雨,阴小月,张照委,郭建新
0 引言
同种异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)是目前治疗多种血液系统疾病最常见的治疗方法[1]。但移植物抗宿主病(graft-versus-host disease,GVHD)仍是影响接受allo-HSCT患者成功率及威胁其预后最主要且最严重的并发症,据统计约有40%~60%接受造血干细胞移植患者发生[2-3]。眼部移植物抗宿主病(ocular graft-versus-host disease,oGVHD)影响眼前段及眼后段,其中,最主要影响眼前节。对于oGVHD何时发生及其具体病理机制,尚不十分明确。现有的研究认为oGVHD发病与供体淋巴细胞相关,是T效应细胞自身免疫中枢失耐受的结果[4]。此外,还有研究认为oGVHD发病与T细胞亚群的改变、B细胞失调、细胞因子的改变等有关[5]。白细胞介素(interleukin,IL)因在免疫细胞的成熟、活化、增殖过程中发挥重要的免疫调节作用[6],因此,在IL水平进行监测及干预,对oGVHD进行诊断及治疗十分重要。白细胞介素-36(interleukin-36,IL-36)是IL-1家族新成员,由3个生物学功能相似的分子IL-36α、IL-36β和IL-36γ组成[7]。近期,有研究发现,人白细胞抗原-B27(human leukocyte antigen-B27,HLA-B27)相关性急性前葡萄膜炎和特发性急性前葡萄膜炎患者的房水和血清中可发现改良的IL-1家族谱细胞因子,包括IL-36[8-9],且IL-36相关细胞因子被发现参与了纤维化的发病机制[10]。但是关于IL-36在oGVHD患者泪液中的表达水平及与患者临床表现的相关性有待研究。因此,本研究对行allo-HSCT患者泪液中IL-36(α、β、γ)表达水平、眼表微环境各指标及联合结膜印迹细胞学染色(CIC)进行动态监测及术后随访,为oGVHD的诊断及治疗提供新的生物标志物。
1 对象和方法
1.1 对象本研究为前瞻性研究。选取2020-01就诊于我院血液科,经血液科医师确诊的可行allo-HSCT的患者35例70眼,其中男21例,女14例,年龄18~52(平均35±9.73)岁。另选取年龄、性别相匹配的健康志愿者35例70眼作为正常对照组。本研究经徐州医科大学伦理委员会批准(批件号:XYFY2020-KL020-01),受试者均签署知情同意书,受试者、项目参与人仔细阅读知情同意书后,签名并注明日期。
1.1.1 纳入标准(1)就诊于我院血液科,经血液科医师确诊的可行allo-HSCT的患者;(2)年龄≥18岁;(3)双眼前节无异常;(4)未经过任何眼部治疗。
1.1.2 排除标准(1)在纳入研究前6mo给予外用治疗,包括外用类固醇、环孢素、治疗性隐形眼镜使用;(2)存在眼表疾病,如干眼(dry eye,DE)、结膜炎、角膜炎、泪道、泪腺疾病;(3)存在其他眼部疾病及其可能影响眼表状态,包括高度近视、高眼压症、青光眼和视网膜疾病;(4)合并其他全身疾病影响眼表稳态者,包括糖尿病、干燥综合征、系统性红斑狼疮、银屑病;(5)进行过任何眼部手术;(6)存在精神系统疾病或配合不佳或拒绝参加者;(7)绝经期女性。
1.2 方法正常对照组及allo-HSCT患者在移植开始前7~9d和allo-HSCT后3、6、9mo均接受了全面的眼科检查,包括视力、眼压、裂隙灯检查眼表、散瞳检查眼底。每次就诊前使用眼表疾病指数(ocular surface disease index score,OSDI)量表对眼部不适的主观症状进行评分,同时对患者进行眼表微环境相关检查[包括泪液分泌试验(Schirmer试验)、角膜荧光素钠染色(cornea fluorescein staining,FL)[11]、泪膜破裂时间(tear break-up time,TBUT)]、结膜印迹细胞学染色(conjunctival impression cytology,CIC)观察结膜杯状细胞与结膜上皮细胞[12-13],采用改良Nelson分级对其进行评分[14],以及使用酶联免疫吸附法(ELISA)检测泪液中炎性因子IL-36(α、β、γ)的表达情况。根据国际眼部移植物抗宿主病共识工作组标准(International Chronic Ocular Graft-versus-Host-Disease Consensus Group,ICCGVHD)与国际泪膜和眼表协会干眼工作组第二次会议(Tear Film and Ocular Surface Society Dry Eye Workshop Ⅱ,TFOS DEWS Ⅱ),分别由血液学科医生和眼科医生做出全身性和眼部GVHD的诊断[15],该标准基于Schirmer试验、角膜染色、结膜染色、干眼症状和系统性GVHD的存在。考虑GVHD可能累及多系统多组织,本研究根据德国/奥地利/瑞士慢性移植物抗宿主病(cGVHD)临床实践共识会议(German/Austrian/Swiss Consensus Conference on Clinical Practice in cGVHD,GAS CC)标准对其进行疾病分级[16-17]。在每次就诊期间,告知患者眼部GVHD的发生率和潜在的严重后遗症,以及眼部干涩不适、光敏感、流泪、异物感、疼痛、发红、肿胀、分泌物增多或视力下降等警告信号。对患者随访9mo,在随访过程中,当检查患者眼表出现异常时,即使患者没有临床症状,应对其进行治疗。
1.2.1Schirmer试验在无眼表麻醉下进行,嘱患者静坐,采用泪液检测滤纸,末端折叠5mm,轻轻置于下睑结膜中外1/3交界处,尽量避免刺激角膜引起反射性泪液分泌,嘱患者闭眼5min,取出滤纸静置2min后观察,观察滤纸浸润长度。滤纸浸润长度<10mm为轻度,<5mm为中度,<2mm为重度。
1.2.2TBUT和FL 将1μL 2%荧光素钠液体滴入结膜囊后眨眼3次,以s为单位记录TBUT,即自最后一次瞬目后睁眼至角膜出现第一个黑斑记录时间,正常>10s,5s 1.2.3CIC 将醋酸纤维滤膜预先剪成直边为4mm×6mm×9mm大小的梯形备用。盐酸奥布卡因滴眼液点眼1次,5min后,用棉签吸去穹窿部泪液。将其粗糙面贴于颞下侧角膜缘外1mm处的球结膜表面,轻轻加压,用玻棒轻轻按压3~5s后用无齿镊将滤纸从尖端小心剥离。95%酒精固定10~30min,4℃冰箱保存[14]。采用PAS联合苏木素染色法。各组分析眼表结膜上皮鳞状化生程度及杯状细胞密度,采用改良Nelson分级。 1.2.4 泪液中炎症因子IL-36三种亚型水平检测泪液取样:用Schirmer条取样泪液。将滤纸以直角折叠并使用镊子放置在下穹窿内测2/3和外侧1/3之间,然后将其放置在0.2mL EP管中,收集后立即储存在-80℃下。提取泪液[19]:将湿润长度的条带剪成碎片后加入200μL磷酸盐缓冲液(PBS),离心震荡1h后取100μL上清液保存在聚丙烯管中置于-80℃冰箱保存。两眼的泪液混合在一起,采用ELISA(试验程序遵循制造商的说明)测定泪液中IL-36α、IL-36β、IL-36γ水平。所有定量数据均行3次取平均值,所有检查与标本取样均由同一名经验丰富的眼科医师完成。 2.1 一般情况受检患者的清髓调理方案:白血病包括:羟基脲40mg/kg,阿糖胞苷2.0g/m2,白舒非0.8mg/kg,环磷酰胺1.8g/m2,司莫司汀250mg/m2,即复宁2.5mg/kg;再生障碍性贫血包括:氟达拉滨30mg/m2,环磷酰胺30mg/kg,即复宁3.75mg/kg。调理方案的选择基于患者的年龄、既往治疗、共病和恶性肿瘤的状态。所有患者均接受甲氨蝶呤和霉酚酸酯预防GVHD。 研究期间5例因病情加重去世,6例失访,共纳入24例48眼allo-HSCT患者,其中男10例,女14例,年龄18~52(平均34.04±9.15)岁;正常对照组35例70眼,其中男17例,女18例,年龄18~48(平均33.34±8.47)岁,两组年龄、性别比较差异均无统计学意义(P>0.05)。对24例完成术前及术后3次随访的患者进行眼表参数和生化参数的统计分析见表1。 表1 24例allo-HSCT患者的基本信息 2.2 炎症因子IL-36三种亚型水平分析 2.2.1 术前allo-HSCT组与正常对照组IL-36三种亚型水平比较使用ELISA检测各组受检者泪液中IL-36(α、β、γ)的表达水平结果显示,与正常对照组相比,allo-HSCT组IL-36(α、β、γ)术前基线表达水平更高,其中,无论在正常对照组还是allo-HSCT组,以IL-36γ表达水平最高,见表2。 表2 术前allo-HSCT组与正常对照组IL-36三种亚型水平比较 2.2.2oGVHD组与Non-GVHD组不同时点IL-36三种亚型水平比较allo-HSCT组受检者术后随访3次,每3mo 1次,对术后是否出现眼部症状的受检者分为oGVHD组(8例)和非oGVHD(Non-oGVHD,16例)组。两组间不同时点IL-36(α、β、γ)水平经双因素重复测量方差分析结果显示,IL-36α、IL-36β在不同时点、分组、时点与分组的交互效应上均有统计学意义(IL-36α:F时点=47.018,F分组=325.416,F时点×分组=45.600,均P<0.01;IL-36β:F时点=103.606,F分组=107.577,F时点×分组=98.052,均P<0.01),IL-36γ在不同时点上有统计学意义(F=4.491,P=0.019),在不同分组、时点与分组的交互效应上无统计学意义(F分组=2.975,P分组=0.099;F时点×分组=3.138,P时点×分组=0.058),见表3。 表3 不同时点oGVHD组和Non-oGVHD组泪液中IL-36三种亚型水平比较 2.2.3oGVHD组和Non-oGVHD组组内不同时点泪液中IL-36三种亚型水平比较Non-oGVHD组组内不同时点IL-36α、IL-36β、IL-36γ两两比较差异均无统计学意义(P>0.05)。oGVHD组组内不同时点IL-36三种亚型水平两两比较结果显示,术后6、9mo时IL-36α、IL-36β均明显高于术前、术后3mo;术后9mo时IL-36α、IL-36β均明显高于术后6mo;术后3mo时IL-36β明显高于术前。术后6、9mo时的IL-36γ均明显高于术前,差异均有统计学意义(P<0.05),见表3。 2.2.4oGVHD组和Non-oGVHD组组间不同时点泪液中IL-36三种亚型水平比较术前,术后3、6、9mo,oGVHD组与Non-oGVHD组IL-36γ比较,差异无统计学意义(t=0.377,P=0.710;t=1.717,P=0.100;t=2.018,P=0.056;t=2.827,P>0.05);术前,术后3、6、9mo,oGVHD组IL-36α、IL-36β均明显高于Non-oGVHD组,差异有统计学意义(IL-36α:t=4.111,P=0.001;t=4.374,P<0.001;t=12.517,P<0.001;t=9.925,P<0.001;IL-36β:t=2.216,P=0.037;t=4.497,P<0.001;t=9.080,P<0.001;t=12.225,P<0.001),见表3。 2.2.5 术后oGVHD组受检者泪液中IL-36三种亚型与临床参数的相关性在所有研究对象和对照对象中,观察到双眼的临床参数与眼部症状相似,8例oGVHD患者的眼表损害程度均为轻度,CIC结果见图1,Nelson分级为0~2级。故本研究记录了两只眼睛眼表参数的平均值与受检者术后泪液中IL-36(α、β、γ)的水平,采用Pearson相关性分析对各指标间的相关性进行分析显示,oGVHD患者泪液中IL-36(α、β、γ)表达水平与眼表参数具有相关性。术后3mo时,IL-36β与FL不具有相关性(r=0.707,P=0.050),IL-36γ与TBUT呈正相关(r=0.775,P=0.024);术后6mo,IL-36α与TBUT不具有相关性(r=-0.635,P=0.091)。其余随访时间,IL-36(α、β、γ)与OSDI评分、FL、CIC呈正相关,与TBUT、Schirmer试验呈负相关(均P<0.05),见表4。 图1 CIC图片 A:正常,结膜上皮细胞小而圆,细胞间连接紧密,杯状细胞>500/mm2,形态大而圆;B:1级,轻度鳞状上皮化生,结膜上皮细胞较大,细胞间距较0级大,细胞大,核小,杯状细胞350~500/mm2,形态较0级无明显变化;C:2级,中度鳞状上皮化生,结膜上皮细胞大,分辨差,细胞间距更大,细胞核小,杯状细胞严重减少100~350/mm2。 表4 oGVHD组受检者术后泪液中IL-36三种亚型与临床参数的相关性分析 GVHD为allo-HSCT术后的常见并发症,根据美国国立卫生研究院(National Institutes of Health,NIH)的共识标准,以往根据临床症状的发病时间将移植物抗宿主病分为急性或慢性[20-21]。然而,在2005年,NIH发布共识表示根据临床表现来定义急性和慢性移植物抗宿主病[22]。cGVHD较多见,通常发生在病程晚期,常累及多器官系统,致残率和致死率均较高,是影响HSCT治疗效果的主要障碍[23-24]。眼部是cGVHD主要靶器官之一。眼部受累的常见表现可与DE相似。但是oGVHD临床症状较普通DE更为复杂,显著影响患者的视力和生活质量[25]。 oGVHD的发病机制尚不十分明确,根据oGVHD目前研究得出的发病机制,炎症是DE发生的核心,减轻眼表的炎症是其治疗中必不可少的一步,如环孢素滴眼液有益于抗炎治疗[26]。在GVHD患者中,正确识别眼部受累对于全身性疾病严重程度的评估也至关重要,迄今为止,眼科医生尚无眼部特异性生物标志物。 CIC是一种简单易行的眼表细胞学检查方法,主要通过检查眼表疾病中结膜上皮杯状细胞的改变及鳞状上皮化生程度,分析眼表上皮细胞的病理学改变。本研究通过CIC观察allo-HSCT患者的结膜上皮细胞、结膜杯状细胞,发现oGVHD患者有不同程度的鳞状上皮化生、杯状细胞密度减少,这些可能是影响泪膜层稳定性的重要因素,并且杯状细胞的密度可能反映了眼表面的整体健康状况,这与Kinoshita等[27]研究者观点一致。并且有研究表明oGVHD患者主要靶组织是结膜与泪腺,并发现结膜纤维化的病理改变与其临床表现有关[28],一旦由于眼表面上的微环境(包括杯状细胞,其除了产生黏蛋白外还具有免疫调节功能)的紊乱而导致内环境稳定失调,眼表面就变成免疫高级部位[29]。对于allo-HSCT术后于眼科随访的患者,应对其进行CIC检查,进一步评估其眼表状态。 近年来,国内外学者对oGVHD患者泪液中IL因子表达水平进行检测,以求发现与oGVHD发病相关的生物标志物,用于预测oGVHD的发生及早期治疗干预。研究发现,IL-1β、IL-6、IL-8、IL-7在oGVHD患者泪液中表达增高,并与患者临床严重程度相关[30]。此外,Sridevi等同样发现与Non-oGVHD和健康对照相比,oGVHD患者泪液中IL-6,IL-8,IL-10,IL 12AP70,IL-17A等细胞因子表达升高[19]。IL-36是新发现的一类细胞因子,IL-36细胞因子家族是IL-1家族的一部分。由IL-36α、IL-36β、IL-36γ和天然的拮抗剂IL-36Ra组成[31],主要分布在皮肤、肺脏、关节、肠道、肾脏和大脑中,可由单核/巨噬细胞、T淋巴细胞、B淋巴细胞、角质细胞、M2细胞、朗格汉斯细胞等多种细胞产生[32]。据报道,IL-36γ在银屑病、炎性肠病、关节炎、系统性红斑狼疮等多种炎性疾病动物模型和患者体液中也被报道表达增高,并能促进IL-17、IL-20、IL-22、IL-23、TNF和IFN-γ等炎症因子产生,这些证据均提示IL-36是一类“促炎细胞因子”[31,33-35]。 本研究发现,与正常对照组和Non-oGVHD组相比,oGVHD患者泪液中IL-36(α、β、γ)显著升高,以IL-36(α、β)更明显,且在两组间不同时点IL-36(α、β)表达具有统计学意义,可能因为IL-36γ在术前已呈高表达,而在眼表微环境受损的情况下升高趋势不明显,这与Li等[36]研究者发现一致。allo-HSCT患者IL-36(α、β、γ)术前基线表达水平较正常对照组较高,这可能提示我们,原发疾病致机体免疫功能受损对IL-36(α、β、γ)的表达可能存在影响。对oGVHD组患者术后IL-36(α、β、γ)的表达水平与眼表参数进行分析,结果显示,IL-36细胞因子表达水平与OSDI评分、FL、CIC呈正相关,与TBUT、Schirmer试验呈负相关。如前所述,IL-36是一类促炎细胞因子,根据此次研究结果,oGVHD眼表微环境受损可能与其异常表达有关;无相关性临床参数与样本量偏少有关。本研究发现,在oGVHD眼部症状出现之前,IL-36(α、β、γ)因子已出现高表达,随时间推移呈现增高趋势,且与Non-oGVHD组有统计学意义,且与临床眼表参数有相关性,这可能提示我们,在oGVHD眼表不适症状出现之前,眼表稳态结构可能已被破坏;IL-36细胞因子可能是oGVHD的早期敏感指标。 IL-36在许多器官/组织(包括皮肤、肺和肠道)中表达及其受体参与炎症反应[37]。在上皮细胞和特异性免疫细胞上观察到IL-36上调,诱导细胞进一步激活和分泌细胞因子和趋化因子,导致多种免疫细胞募集和激活[38]。在急性葡萄膜炎的房水中检测到高度升高,与自身反应性T细胞免疫反应有关[8],表明IL-36参与了针对致病性入侵的宿主免疫的发展。本研究观察到oGVHD的泪液中IL-36(α、β、γ)升高。尽管oGVHD的发病涉及非感染性原因,但本研究数据表明,oGVHD的发病机制与微环境中的宿主免疫介导的炎症有关。此外,我们发现IL-36和眼表微环境参数之间存在相关性,这进一步支持了IL-36可能参与了oGVHD发病机制。 综上,本研究认为检测泪液中IL-36细胞因子对allo-HSCT后oGVHD的诊断有重要意义;警醒我们定期随访allo-HSCT手术的患者,即使他们没有眼部症状。本研究中样本数量相对较少,无法全面研究不同严重程度oGVHD各临床变量的差异。另外,未来可进一步研究IL-36细胞因子与已证实在oGVHD患者泪液中有诊断价值的炎症因子的关系。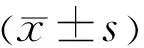
2 结果




3 讨论

